銅離子熒光探針的研究進展
向雨秘 龍少波 朱 勍
(浙江工業大學生物與環境學院,浙江 杭州 310014)
銅元素是生物體內所必需的一種微量重金屬元素和必需的營養素,在細胞中的含量僅次于鋅和鐵,在各種有機體的基本生理過程中發揮著重要作用[1]。銅離子作為生命系統中重要的微量元素,它以作為金屬酶(如細胞色素氧化酶、過氧化物歧化酶、酪氨酸酶、多巴胺β-羥化酶、賴氨酰氧化酶和銅藍蛋白等二十多種酶類)的催化輔助因子的形式,廣泛參與了生命體系中電子傳遞、氧化還原等一系列過程,在生物體內的酶反應、酶轉錄以及一些氧化還原過程發揮重要的作用[2-3]。銅離子在生物體內的含量很小,但銅缺乏可導致生長和代謝的紊亂,銅離子的含量過多同樣也會對生物體產生巨大的毒害作用。體內的銅離子代謝平衡受到破壞會導致神經退行性疾病的發生,例如緬克斯綜合癥、威爾森氏綜合癥、家族性肌萎縮癥和阿爾茨海默氏癥等疾病[4-6]。因此,尋求一種快速靈敏簡便的銅離子檢測方法在生物研究和醫學診斷中具有重要的意義。
目前傳統的檢測方法主要有原子吸收光譜法[7]、電感耦合等離子體-質譜法[8]、電感耦合等離子體-原子發射光譜法[9]、分光光度測定方法[10]和循環伏安法[11]等檢測銅離子的方法。但這些檢測方法需要昂貴復雜的檢測設備,且檢測過程中較為繁瑣,不適合大批量檢測和實時檢測。熒光探針檢測方法具有靈敏度高,選擇性好,方法簡便等優勢,并且可通過熒光成像技術對生物體內的銅離子進行觀測和實時檢測[12,13]。因此,熒光探針檢測技術作為一種新型高效簡便的檢測手段,被廣泛的應用于銅離子的檢測中。本文通過參考一些最新前沿的相關文獻報道,根據銅離子熒光探針的不同作用原理,總結了近幾年銅離子熒光探針的研究進展。
1 基于光誘導電子轉移過程的熒光探針
在眾多銅離子熒光探針中,基于光誘導電子轉移(photoinduced electron transfer,PET)機理[14]而設計的熒光分子探針最為常見,而這種探針也常常用于對其他陽離子的檢測中。一般情況下,一個典型的PET結構是由識別基團通過間隔基和熒光基團相連而成,PET熒光探針的熒光基團和識別基團之間存在著光誘導電子轉移,對熒光有非常強的猝滅作用。
2006年,Zeng等[15]報道了一種高度選擇性的Cu+熒光探針,機理見Scheme 1所示。該探針采用硫冠醚結構作為探針的識別基團,而熒光基團則為BODIPY染料。由于PET作用,探針本身的熒光強度十分微弱,當探針的識別基團與Cu+螯合后,PET受到限制,探針的量子產率從之前的0.016增至0.13,發出強烈熒光。實驗結果表明,在所有檢測的離子 (Ca2+、Mg2+、Mn2+、Fe2+、Co2+、Ni2+、Cu2+、Zn2+、Cu+)中,該探針對 Cu+表現出良好的選擇性和靈敏性。最后成功的應用于活細胞熒光成像檢測,有助于幫助闡釋亞銅離子在細胞內的生理學及病理學作用。
2010年,Domaille D W等[16]對此探針進行了改進,將硫冠醚結構連接到BODIPY的5位,合成了一種新型的探針結構。該探針與Cu+螯合后熒光強度隨之增加了20倍,并表現出良好的選擇性。

Scheme 1
2 基于C-O鍵斷裂過程的熒光探針
基于C-O鍵斷裂作用的熒光探針最為常見。熒光探針分子中的熒光團通過醚鍵和識別基團連接后熒光淬滅,當與目標作用后醚鍵斷裂,熒光團上的識別基團脫落而發出強熒光。這種熒光探針主要是通過識別基團與熒光團之間的醚鍵斷裂而檢測,因此,該探針也常常用于酶活性的檢測中。2010年,Taki M等[17]合成了一種以熒光素為熒光基團的的熒光探針(Scheme 2),這種新型的熒光探針和銅離子作用后發生水解,熒光素上的識別基團脫落,隨后產生強熒光的熒光素。通過對 Ca2+、Mg2+、Mn2+、Fe2+、Co2+、Ni2+、Cu2+、Zn2+、Cu+等離子的檢測,該探針表現出極好的選擇性和極高的靈敏性,并成功的用于細胞熒光成像檢測。該探針設計簡便,靈敏度高且容易操作,因而被廣泛應用于銅離子的檢測。
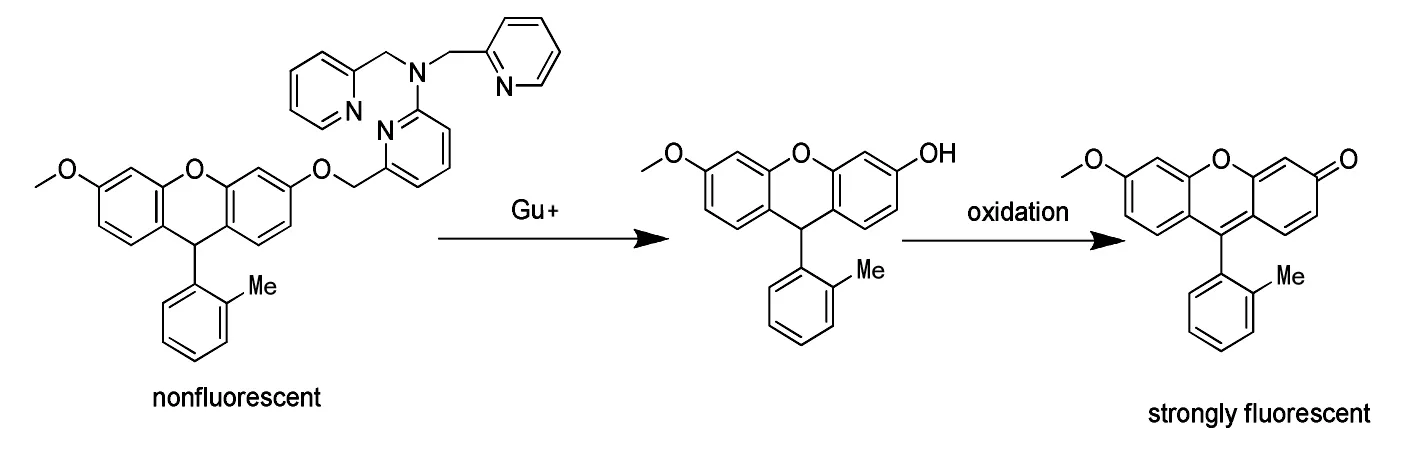
Scheme 2
3 基于胺及酰胺配位作用的熒光探針
由于胺中N原子上具有孤對電子,它可以和Cu2+的空軌道發生配位,因此利用配位作用可以用來識別銅離子,常用來作為Cu2+的識別基團有胺和酰胺基團。近年來,羅丹明的內酰胺螺旋結構已成為了研究熱點[18]:羅丹明B處于內酰胺螺環狀時并無熒光,當內酰胺螺環狀結構受到破壞而開環時會產生玫瑰色和強熒光。這種獨特的開環識別的機理已被廣泛的用于制備熒光增強型Cu2+熒光分子探針。
1997年,Czarinik等[19]首次利用該機理設計和合成了羅丹明B酰肼探針(Scheme 3),該探針可以選擇性識別銅離子,其原理是基于銅離子催化羅丹明B酰肼水解生成強熒光的羅丹明B分子。
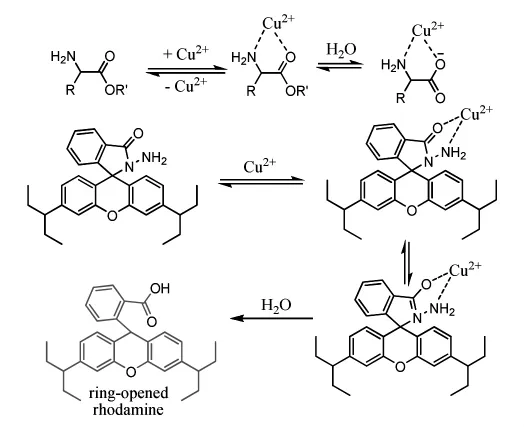
Scheme3
2012年,Kumar M等[20]巧妙的對該探針進行了改進,將具有熒光的酰肼衍生物替代酰肼,設計和合成了一種新型的銅離子熒光探針。機理見Scheme 4。該探針與銅離子作用后,羅丹明B酰肼結構發生水解,生成了強熒光的羅丹明B分子以及強熒光的酰肼衍生物(HZD)。因此,該探針可以測定雙發射波長的熒光信號,更能精確的檢測銅離子的濃度變化。并且該探針成功地用于細胞熒光成像檢測,為進一步在分子水平上對銅離子的的研究奠定了基礎。

Scheme 4
4 基于FRET作用的熒光探針
熒光共振能量轉移 (fluorescence resonance energy transfer,FRET)[21]是激發態時能量供體與受體通過遠程偶極-偶極耦合作用,發生的非輻射能量轉移過程。熒光共振能量轉移的效率與供受體熒光團之間的距離有著十分重要的關系,因此,任何改變兩個熒光團的距離和方向都能影響著的FRET效率。相比于單信號的熒光探針,FRET熒光探針能夠實現更大的stoke位移,減少背景信號的干擾;通過檢測雙波長的發射光譜,能夠實現比率檢測,削弱其他因素的干擾,極大地提高了探針的靈敏性。
2012年,Lin Yuan等[22]根據羅丹明B酰肼與銅離子的配位作用機理設計了一種新型的FRET熒光探針(Scheme 5)。當環境中不存在銅離子時,由于探針中羅丹明B酰胺處于閉合狀態,此時從香豆素到羅丹明B的FRET是被阻止的,只能檢測到供體的發射波長。當環境中存在銅離子時,探針的內酰胺結構打開,FRET開啟,能量發生了轉移,此時用410 nm波長的光激發,可以檢測到581 nm的主峰和473 nm的小峰,分別對應著羅丹明B基團和香豆素基團的最大發射波長,把581 nm和473 nm的熒光強度的比值作為檢測值,隨著銅離子的濃度增大,比值也相應的增加。這種比率檢測方法能夠極大降低檢測環境中背景的干擾,提高了探針的靈敏度。通過對Ca2+、Mg2+、Mn2+、Fe3+、Co2+、Ni2+、Cu2+、Zn2+、Cu+、Ag+、Cd2+、Cr3+、Hg2+、Pb2+、Al3+、Sn2+等離子的檢測,探針對Cu2+表現出極好的選擇性和極高的靈敏性。

Scheme 5
Lee等[23]設計了雙供體 FRET熒光探針(Scheme 6),該探針以連接兩個丹磺酰熒光染料作為雙供體,極大的提高了該探針的靈敏度和準確性。
2010年,Wegner S V等[24]在酵母細胞內通過基因編碼表達構建了一個Amt1-FRET銅離子熒光探針。該探針由青色熒光蛋白(CFP)通過類金屬硫蛋白的多肽(Amt1)和和黃色熒光蛋白(YFP)連接而成。它主要通過Amt1上的巰基與銅離子發生絡合作用后改變其空間構象,使得兩個熒光基團相互靠近,能量發生了轉移,從而達到檢測的目的。該探針是由基因編碼表達而成的,減少了有機染料給細胞帶來的毒害作用,提高了探針的靈敏度。它在酵母細胞中對銅離子檢測的良好表現也為在哺乳動物細胞內對銅離子進行動態研究提供了可能。
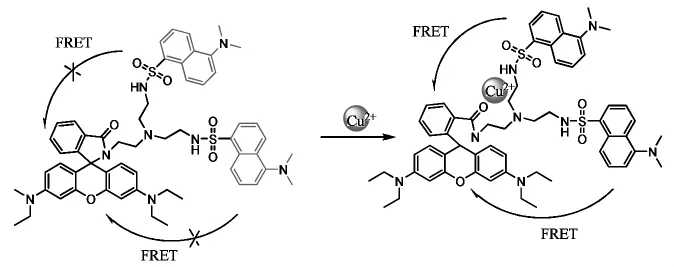
Scheme 6
5 基于核磁共振技術的雙功能探針
核磁共振成像(MRI)檢測[25]是最近新興發展的一種新的檢測技術,相比于熒光探針檢測技術,具有更高的空間分辨率和對比度,且可同時獲得三維解剖結構及生理信息等優勢,因此,MRI探針也常常用于對銅離子的檢測中。2012年,Zhang等[26]將一萘衍生物熒光基團連接在Gd3+-DO3A核心結構上,設計和合成了一個雙功能探針 (Scheme 7)。當環境中沒有銅離子時,Gd3+-DO3A核心結構由于萘衍生物導致的空間位阻使環境中的水未能進入,降低了其縱向弛豫值。當探針與銅離子結合后,萘衍生物受體與銅離子形成螯合結構,減少了對Gd3+-DO3A的阻塞作用,使得環境中的水能夠進入里面,提高了探針的縱向弛豫值,發出明顯的核磁共振信號,而萘衍生物熒光基團由于銅離子的螯合作用熒光發生淬滅。該探針采用了雙信號檢測,既然檢測MR信號,又能檢測熒光信號變化,提高了探針的靈敏度和準確性。
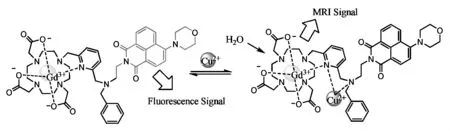
Scheme 7
6 展望
本文綜述了各種類型的銅離子熒光探針,總結了大多數銅離子熒光探針的設計原理和應用。隨著對銅離子研究的不斷深入,熒光探針在生物及醫學領域中越來越發揮其重要的作用。相信,通過不斷的努力,最終會開發一種更高效、更靈敏、簡單方便的探針,在生物學研究、環境監測、臨床醫學以及疾病診斷等領域方面發揮著重要的作用。
[1]Barceloux D G J,Barceloux D.Copper[J].Clin.Toxicol.,1999,37(2):217-230.
[2]Gaggelli E,Kozlowski H,Valensin D,et al.Copper Homeostasis and Neurodegenerative Disorders(Alzheimer's,Prion,and Parkinson's Diseases and Amyotrophic Lateral Sclerosis)[J].Chem.Rev.,2006,106(6):1995-2044.
[3]劉希玲,鄭明花,金京一.銅離子熒光傳感器的研究進展[J].廣州化工,2010,38(4):30-33.
[4]Harrison M D,Dameron C T.Molecular mechanisms of copper metabolism and the role of the Menkes disease protein[J].J.Biochem.Mol.Toxicol.,1999,13(2):93-106.
[5]Strausak D,Mercer J F B,Dieter H H,et al.Copper in disorders with neurological symptoms:Alzheimer's,Menkes,and Wilson diseases [J].Brain.Res.Bull.,2001,55(2):175-185.
[6]Waggoner D J,Bartnikas T B,Gitlin J D.The role of copper in neurodegenerative disease [J].Neurobiology of Disease,1999,6(4):221-230.
[7]Pourreza N,Hoveizavi R.Simultaneous preconcentration of Cu,Fe and Pb as methylthymol blue complexes on naphthalene adsorbent and flame atomic absorption determination[J].Analytica Chimica Acta,2005,549(1):124-128.
[8]Becker J S,Zoriy M V,Pickhardt C,et al.Imaging of copper,zinc,and other elements in thin section of human brain samples(hippocampus)by laser ablation inductively coupled plasma mass spectrometry [J].Anal.Chem.,2005,77(10):3208-3216.
[9]Romani J O,Moreda A P,Barrera A B,et al.Evaluation of commercial C18 cartridges for trace elements solid phase extraction from seawater followed by inductively coupled plasma-optical emission spectrometry determination[J].Analytica Chimica Acta,2005,536(2):213-218.
[10]Pinto J J,Moreno C,Garcia-Vargas M.A very sensitive flow system for the direct determination of copper in natural waters based on spectrophotometric Detection[J].Talanta,2004,64(22):562-565.
[11]Beni V,Ogurtsov V I,Bakunin N V,et al.Development of a portable electroanalyticalsystem forthe stripping voltammetry of metals:determination of copper in acetic acid soil extracts[J].Analytica Chimica Acta,2005,552(1):190-200.
[12]Zhao M L,Yang X F,He S F,et al.A rhodamine-based chromogenic and fluorescent chemosensor for copper ion in aqueous media[J].Sensors and Actuators B-Chemical,2009,135(2):625-631.
[13]王松濤,姜云,程秀萍,等.銅離子傳感器的研究進展 [J].渤海大學學報,2010,31(3):231-236.
[14]Valeur B,Leray I.Design principles of fluorescent molecular sensors for cation recognition[J].Coordination Chemistry Reviews,2000,205:3-40.
[15]Zeng L,Miller E W,Pralle A,et al.A selective turn-On fluorescent sensor for imaging copper in living cells [J].J Am Chem Soc,2006,128(1):10-11.
[16]Domaille D W,Zeng L,Chang C J.Visualizing ascorbatetriggered release of labile copper within living cells using a ratiometric fluorescent sensor[J].J.Am.Chem.Soc.,2010,132(4):1194–1195.
[17]Taki M,Iyoshi S,Ojida A,et al.Development of highly sensitive fluorescent probes for detection of intracellular copper(I)in living systems[J].J Am Chem Soc,2010,132(17):5938–5939.
[18]王曉春,劉曉瑞,楊永亮,等.羅丹明類熒光探針在重金屬和過渡金屬離子檢測中的應用 [J].光譜學與光譜分析.2010,30(10):2693-2699.
[19]Dujols V,Ford F,Czarnik A W.Long-wavelength fluorescent chemodosimeter selective for Cu(II)ion in water[J].J.Am.Chem.Soc.,1997,119(31):7386-7387.
[20]Kumar M,Kumar N,Bhalla V,et al.Highly Selective fluorescence turn-on chemodosimeter based on rhodamine for nanomolar detection of copper ions[J].Org Lett,2012,14(1):406-409.
[21]孫學剛,張麗華,姜勇.FRET的理論基礎及應用 [J].中國病理生理雜志,2004,20(9):1721-1724.
[22]Yuan L,Lin W Y,Chen B,et al.Development of FRET-based ratiometric fluorescent Cu2+chemodosimeters and the applications for living cell imaging[J].Org Lett,2012,14(2):432-435.
[23]Lee M H,Kim H,Yoon S,et al.Metal ion induced FRET OFF-ON in tren/dansyl-appended rhodamine[J].Org Lett,2008,10(2):213-216.
[24]Wegner S V,Arslan H,Sunbul M,et al.Dynamic copper(I)imaging in mammalian cells with a genetically encoded fluorescent copper(I)sensor[J].J Am Chem Soc,2010,132(8):2567–2569.
[25]Werner E J,Datta A,Jocher C J,et al.High-relaxivity MRI contrast agents:where coordination chemistry meets medical imaging[J].Angew Chem Int Ed,2008,47(45):8568-8580.
[26]Zhang X L,Jing X,Liu T,et al.Dual-functional gadolinium-based copper(II)probe for selective magnetic resonance imaging and fluorescence sensing[J].inorg Chem,2012,51(4):2325-2331.

