1株鴻雁源新城疫強毒的分離鑒定
陳雪龍,吳海燕,王忠偉,郭 麗,齊艷萍,2
(1.黑龍江八一農墾大學動物科技學院,黑龍江 大慶163319;
2.農業部農產品加工質量監督檢驗測試中心(大慶),黑龍江 大慶163319)
新城疫病毒(NDV)是一種嚴重危害養禽業的重要傳染病病原,曾經對全球養禽業造成嚴重經濟損失。過去一般認為水禽對NDV的易感性較差,多呈隱性感染[1]。然而自20世紀90年代以來,國內外愈來愈多的報道顯示NDV對水禽的致病力逐漸增強,鵝、鴨等水禽已成為易感禽類[2]。
2012年5月,黑龍江大慶某大雁養殖場的大雁(后鑒定為鴻雁)中發生了以輕微呼吸道癥狀和稀便、腿麻痹、站立不穩等為主要癥狀的疾病,使用多種抗生素治療無效。為了查明發病原因,采集了發病大雁病料,進行了病原分離鑒定工作。
1 材料與方法
1.1 主要試劑及試驗動物 TRIzol試劑、M-MLV反轉錄酶、RNasin、dNTP,購自Invitrogen公司;ExTaqDNA 聚合酶、DNA Marker(DL-2 000),購自寶生物工程(大連)有限公司。NDV標準陽性血清、H5、H9亞型禽流感病毒(AIV)標準陽性血清、減蛋綜合征病毒(EDSV)標準陽性血清,購自中國農業科學院哈爾濱獸醫研究所;陰性血清,購自瑞普生物藥業有限公司。PBS、1%雞紅細胞、雙抗(濃度為4 000IU(μg)/mL的青霉素與鏈霉素)按常規方法本實驗室自制。
實驗用1日齡及6周齡SPF雛雞和10日齡的SPF雞胚,均由中國農業科學院哈爾濱獸醫研究所實驗動物中心提供。
1.2 病料處理 現場采集大慶某大雁養殖場發病鴻雁(Ansercygnoides)的腦、脾、肺、腸等組織。其后于實驗室內將病料剪碎研磨,用滅菌PBS按照體積比1∶4制備懸液,反復凍融3次后,8 000r/min離心10min,取上清加入雙抗,37℃作用1.5h,-20℃保存備用。
1.3 病毒分離與血清學鑒定 將病理處理后的上清液接種雞胚,每胚接種200μL,共接種4個10日齡SPF雞胚,每天照蛋3次,棄去24h內死亡的雞胚,收獲36~96h死亡雞胚的尿囊液進行血液凝集試驗(HA),若有血凝性再與NDV陽性血清、AIV陽性血清(H5/H9)和EDSV陽性血清進行血凝抑制(HI)試驗,操作方法按文獻[3]方法進行。
1.4 分離株F基因RT-PCR鑒定
1.4.1 引物設計 參照GenBank中發表的鴨NDVF基因序列設計一對通用引物,用于擴增F基因,序列如下:上游引物 P1:5′-GAGGTTACCTCYACYAAGCTRGAGA-3′,下游引物P2:5′-TCATTAACAAAYTGCTGCATCTTCCCWAC-3′,預計目的擴增片段為535bp。
1.4.2 RT-PCR反應 取尿囊液,按照 TRIzol試劑說明提取病毒RNA,加入適量的DEPC處理水溶解。在 PCR 管中加入 RNA 10.5μL,10μmol/L dNTP 2μL,20μmol/L 上游引物2μL,5×RT Buffer 4μL,40U/μL RNasin 0.5μL;200U/μL M-MLV 1μL,反應總體積20μL,混勻在42℃水浴中作用1.5h。PCR反應體系采用25μL體系,模板cDNA 3μL,10×Buffer 3μL,F1、F2 引物各1 μL,dNTP 3μL,Ex-TaqDNA聚合酶1μL,DEPC水13μL。PCR反應條件為95℃3min,94℃40s,54℃30s,72℃1min,進行30個循環后,72℃延伸10min,最后取PCR產物5μL,在10g/L瓊脂糖凝膠上電泳觀察結果。
1.5 NDV致病指數測定 參照文獻[4]方法進行致死雞胚平均死亡時間(MDT)、1日齡雛雞腦內接種致病指數(ICPI)和6周齡雛雞靜脈接種致病指數(IVPI)等NDV致病指數的測定。
1.5.1 MDT的測定 將尿囊液用滅菌PBS作10倍稀釋成10-6~10-10,每個稀釋度經尿囊腔接種6個10日齡SPF雞胚,0.1mL/個,置37℃培養,棄去24h內死亡雞胚,每日照蛋3~4次,連續觀察7d,記錄使所有雞胚死亡的最高稀釋度致死雞胚的平均時間(MDT)。
1.5.2 ICPI的測定 用滅菌PBS(1∶10)稀釋病毒尿囊液,接種10只1日齡的非免疫雛雞,每只腦內接種0.05mL。每天在與接種相應的時間觀察雞群的健康狀況,并對試驗雞進行評定:正常記0分,發病記1分,死亡記2分。連續觀察8d,最后計算ICPI。
1.5.3 IVPI的測定 將分離株尿囊液以PBS稀釋10倍,翅靜脈接種6周齡SPF雞10只,0.1 mL/只,每天在與接種相應的時間檢查雞群的健康狀況,連續觀察10d。記錄正常、發病、麻痹與死亡雞的每日累計數,最后計算IVPI。
2 結果
2.1 鴻雁臨床癥狀及剖檢變化 現場觀察病雁表現一定程度的精神不振,食欲和飲水減少;鼻孔流出少量清亮水樣液體,張口伸頸呼吸;腹瀉,排白色、黃色或黃白色稀便;翅膀下垂,雙腿輕微麻痹無力,站立不穩或者不愿行走。
經剖檢觀察:腹段食管黏膜有白色壞死點;腸黏膜嚴重壞死脫落并伴有較為嚴重的出血;脾臟色暗紅并腫大,可見不規則的灰白色壞死點;肺臟表面有纖維素性滲出物形成纖維性假膜;肝臟邊緣散在有針尖大出血點和黃白色壞死點,膽囊壁增厚并擴張;腺胃乳頭有出血點,與肌胃交界處出血或有潰瘍灶;心外膜和心內膜均有出血點,并有白色壞死灶;腦輕微水腫、充血;其他組織或器官無肉眼可見病變。
2.2 病毒的分離與初步鑒定結果 雞胚接種后,大多數在接種后45~70h死亡,胚體有出血現象,尤其胚體的頭、頸和爪出血嚴重。收集死亡雞胚的尿囊液,HI試驗測得死亡雞胚的尿囊液均具有血凝價(6~9lb)。分離株的這種血凝性可被NDV標準陽性血清所抑制,而不能被流感 H5、H9亞型AIV和EDSV陽性血清所抑制,說明分離毒為NDV,命名為DQBT01。
2.3 分離株F基因RT-PCR擴增鑒定結果 對病毒尿囊液進行F基因的RT-PCR擴增后,將擴增產物經瓊脂糖凝膠電泳后,檢測結果如圖1所示:
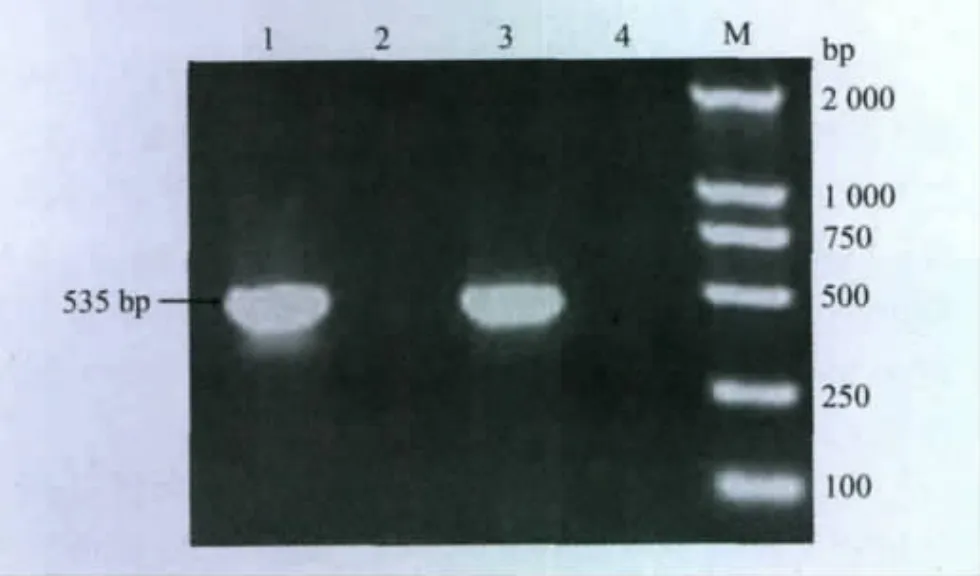
圖1 NDV F基因RT-PCR擴增結果
如圖1所示,對照DNA相對分子質量標準,NDV特異性檢測引物的擴增片段長度為535bp,擴增結果與預計片段大小相同,因此可以進一步判斷此分離毒為NDV。
2.4 NDV的致病指數測定結果
2.4.1 MDT的測定結果 分離毒株尿囊液接種10日齡SPF雞胚后的死亡情況見表1,從表中可見,引起全部雞胚致死的最高稀釋度為10-8,經計算,MDT為55h。
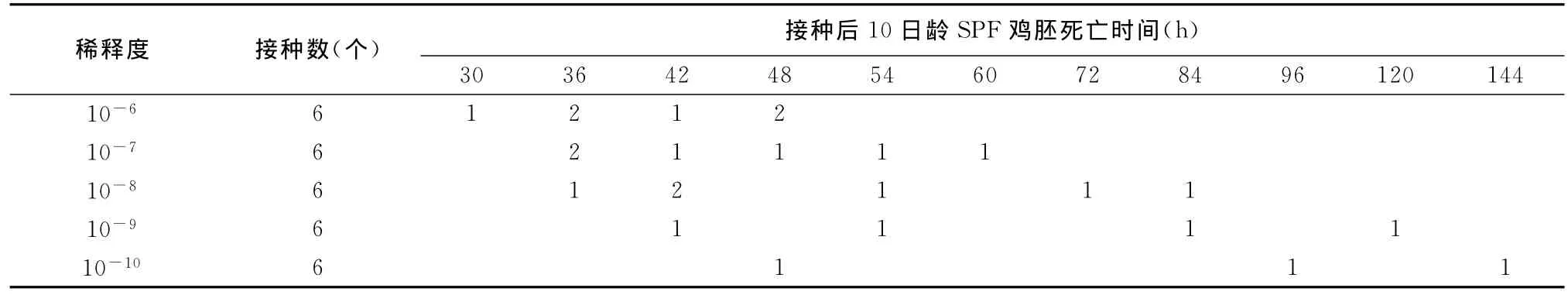
表1 DQBT01分離株MDT測定
2.4.2 ICPI測定結果 1日齡雛雞腦內接種分離病毒發病及死亡情況見表2,雛雞接種后2~4d后出現典型癥狀進而死亡。雛雞剖檢見腺胃黏膜充血,十二指腸充血、出血。經計算ICPI為1.68。
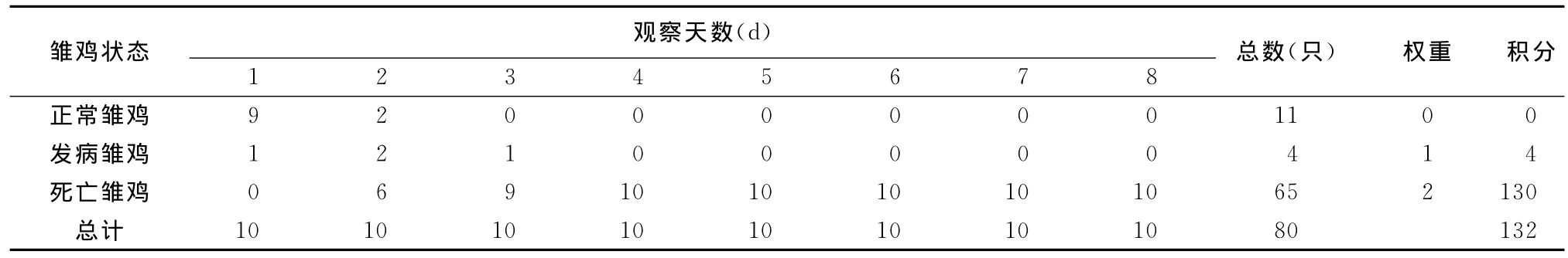
表2 DQBT01分離株ICPI測定
2.4.3 IVPI測定結果 6周齡SPF雞靜脈接種分離病毒發病及死亡情況見表3,接種后第2天雛雞開始出現癥狀并有2只死亡,在接種第四天SPF雞全部死亡,剖檢主要在腺胃和肌胃交界處有出血斑或出血帶,腺胃黏膜腫脹充血。按公式計算:IVPI為2.54。
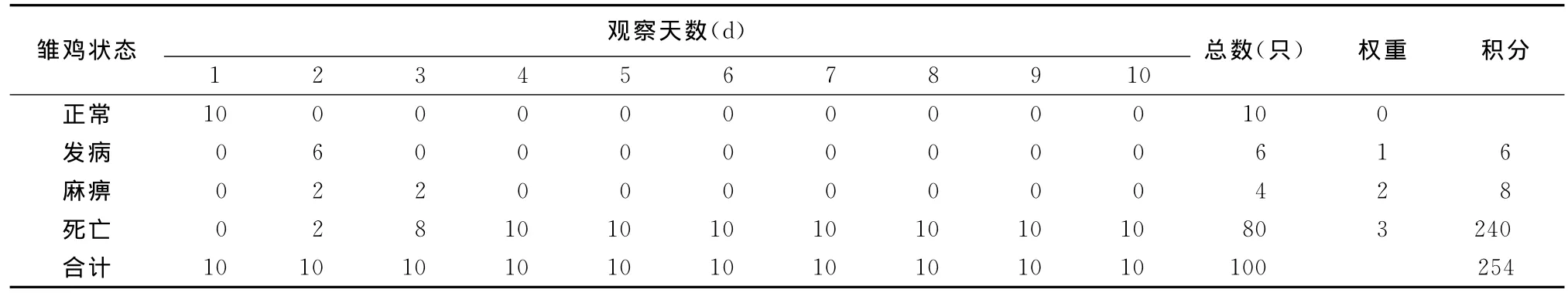
表3 DQBT01分離株IVPI測定
3 討論
本試驗從發病死亡的鴻雁體內分離得到1株病毒,該病毒可使SPF雞胚出現全身出血性變化,死亡雞胚的尿囊液經過血清學試驗以及NDVF基因RT-PCR擴增證明該病毒株為 NDV,命名為DQBT01。該病毒MDT、ICPI和IVPI致病指數分別為55h、1.68、2.54,按照 OLE標準屬于 NDV強毒株。
NDV對鳥類感染宿主范圍比較廣,目前經過報道的野禽已達200多種[5-7],一般情況下,野禽在自由生活狀態下對NDV的有較強的抵抗力,因此所分離的NDV大部分為弱毒株。而在人工飼養條件下,多種野禽可以感染NDV并發病,其涉及的公共衛生問題也受到了高度關注。目前在我國越來越多的野禽感染NDV并且發病的報道越來越多[8],涉及的物種也開始增多,大雁感染NDV并且發病的報道也有少量報道[9],而前人認為水禽對于NDV可以攜帶而不發病,因此認為水禽對NDV有較強的抵抗力。然而,隨著鵝、鴨、大雁等水禽感染NDV并且發病的報道逐漸增多,說明在我國NDV的致病性有增強的趨勢[10]。同時NDV在野禽和家禽間存在相互感染并傳播的現象,并且在相互傳遞的過程隨著宿主免疫系統的選擇壓力不同,NDV存在著一定程度的變異,這種變異可能導致毒力變強,而這種變異趨勢已引起研究者的高度關注,如有研究報道,野禽中自然存在的無毒力毒株,但當其在雞群中傳播時,則具有變成高致病性病毒的能力[11],這對于我國的養禽業是嚴重的威脅。
本次從鴻雁體內分離出NDV強毒株,為野生水禽在人工飼養條件下感染NDV并發病提供了相關依據,提示禽類養殖業,特別是水禽養殖業,對于NDV的防疫要引起足夠的重視,這對于我國控制ND的傳播和流行,降低養殖戶的損失具有重要意義。
[1] Vickers M L,Hanson R P.Newcastle Disease Virus in waterfowl in Wisconsin[J].JWildDis,1982,18(2):149-158.
[2] Liu X F,Wan H Q,Ni X X,etal.Pathotypical andgenotypical characterization of strains of Newcastle disease viruses isolated from outbreaks in chicken and goose flocks in some regions of China during 1985-2001[J].ArchivesofVirology,2003,148(7):1387-1403.
[3] 中國獸藥典委員會.中華人民共和國獸藥典[M].第三部.北京:中國農業出版社,2005.
[4] OLE.哺乳動物、禽類和蜜蜂A類和B類疾病診斷試驗和疫苗標準手冊[M].農業部畜牧獸醫局譯.北京:中國農業科技出版社,1996:140-146.
[5] Seal B S,Wise M G,Pedersen J C,etal.Genomic sequences of low-virulence avian paramyxovirus-1(Newcastle disease virus)isolates obtained from live-bird markets in North America not related to commonly utilized commercial vaccine strains[J].VetMicrobiol,2005,106(1-2):7-16.
[6] Nolen R S.Exotic Newcastle disease strikes game birds in California[J].J Am Vet Med Assoc,2002,221(10):1369-1370.
[7] 胡北俠,王艷,楊少華,等.產蛋下降鴨群強毒新城疫病毒的分離鑒定與分子特征[J].中國獸醫雜志,2012,48(4):10-12.
[8] 杜景嬌,薛強,鄒明強,等.新城疫檢測技術的研究新進展[J].中國畜牧獸醫,2012,39(2):187-191.
[9] 張爽,李丹,李志萍,等.大雁新城疫病毒的分離鑒定[J].吉林畜牧獸醫,2011,32(5):7-9.
[10]劉文斌,崔尚金,劉立奎,等.東北地區不同宿主NDV分離株的系統發育進化分析[J].中國獸醫雜志,2005,41(7):3-6.
[11]于圣青,丁鏟,Noriko Kishida,等.新城疫病毒某水禽分離株經雞體傳代后由非致病型轉變為速發型的研究[J].中國預防獸醫學報,2003,25(1):59-64.

