卡托普利對酸吸入所致急性肺損傷的影響
王鑫淵 陳 麗 張 莉 胡 博
山西醫科大學第二附屬醫院麻醉科,山西太原 030001
在臨床麻醉及危重患者的搶救過程中,嘔吐和反流時有發生。麻醉期間的酸性胃內容物誤吸入肺常是導致臨床急性肺損傷(ALI)的原因之一,同時誤吸也是臨床急危重癥患者中所必須注意的一種嚴重的并發癥,它是導致急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)的主要原因[1],因而,對反流、誤吸的防治是臨床麻醉及危重病醫學領域中的重要課題之一。近年來,隨著人們對組織腎素-血管緊張素系統(renin-angiotesin system,RAS)的進一步研究發現,由血管緊張素轉換酶(ACE)催化產生的血管緊張素Ⅱ(AngⅡ)能夠刺激肺成纖維細胞的DNA 合成表達增強,促進成纖維細胞的增殖,分泌更多的膠原成分,從而導致肺組織纖維化。而卡托普利是ACE 抑制劑,可清除多種自由基,降低血管的通透性,減輕炎性滲出和組織水腫,具有一定的抗炎、抗纖維化作用[2-3]。但卡托普利對胃酸誤吸所致的肺損傷能起到什么樣的作用,目前罕見報道。本研究旨在通過建立模擬胃酸誤吸入肺造成肺損傷模型之后用卡托普利對其進行治療,觀測其治療效果,為今后的臨床應用提供實驗基礎。
1 材料與方法
1.1 實驗動物與分組
健康成年Wistar大鼠30只(由山西醫科大學生理教研室動物房提供),雌雄不拘,體重200~250 g,隨機分為三組,分為對照組、ALI組、卡托普利干預(CAP)組,每組10只。
1.2 儀器及試劑
SG-850型高速臺式離心機(山西醫科大學寄生蟲實驗室提供),腫瘤壞死因子-α(TNF-α)試劑盒(武漢博士德生物工程有限公司),Rapidpoint 405-血氣分析儀(德國siemens)。
1.3 方法
各組分別經腹腔注射25%烏拉坦1.0 mL/kg對大鼠進行麻醉后,游離大鼠氣管進行氣管內置管,對ALI組、CAP組分別經氣管滴入0.1 mmol/L 鹽酸0.4 mL/kg,5 min后CAP組大鼠腹腔注射卡托普利5 mg/kg。
1.4 標本的采集
各組于置管后1.5h后抽取尾靜脈血,凝血后以3500r/min速率離心,取上清測定血清中TNF-α的含量,然后抽取頸動脈血測出其血氣值,最后在肺組織病理變化致傷后2 h時處死動物,打開其胸腔取出肺臟,剪取右肺后葉。
1.5 觀察指標及測定方法
按照試劑盒說明采用雙抗夾心酶聯免疫吸附法(ELISA 法)測定血清中TNF-α的濃度。將動脈血隔離空氣用血氣分析儀測定pH值、動脈血氧分壓(PaO2)值、動脈血二氧化碳分壓(PaCO2)值。將采集的肺葉置于10%中性福爾馬林溶液中固定24 h,組織脫水、透明、浸蠟、包埋、切片(厚度5 μm),蘇木精-伊紅染色,光鏡下觀察肺組織病理變化。
1.6 統計學方法
數據采用SPSS 13.0 軟件進行統計學處理,計量資料以均數±標準差(±s)表示,組間比較采用單因素方差分析。以P<0.05 為差異有統計學意義。
2 結果
2.1 TNF-α含量情況
與對照組比較,ALI組和CAP組TNF-α 含量均有增多(P<0.05);CAP組與 ALI組相比,TNF-α 含量明顯減少,差異有統計學意義(P<0.05)。見表1。
表1 三組大鼠 TNF-α、pH、PaO2、PaCO2水平比較(±s)
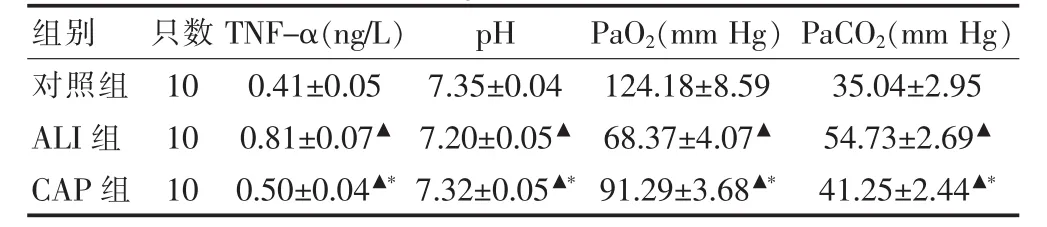
表1 三組大鼠 TNF-α、pH、PaO2、PaCO2水平比較(±s)
注:與對照組比較,▲P<0.05;與 ALI組比較,*P<0.05;TNF-α:腫瘤壞死因子-α;PaO2:動脈血氧分壓;PaCO2:動脈血二氧化碳分壓;1 mm Hg=0.133 kPa
組別 只數 TNF-α(ng/L)pH PaO2(mm Hg) PaCO2(mm Hg)對照組ALI組CAP組10 10 10 0.41±0.05 0.81±0.07▲0.50±0.04▲*7.35±0.04 7.20 ±0.05▲7.32±0.05▲*124.18 ±8.59 68.37±4.07▲91.29±3.68▲*35.04±2.95 54.73±2.69▲41.25±2.44▲*
2.2 血氣分析情況
與對照組比較,ALI組和CAP組PaO2均有下降(P<0.05),PaCO2均有上升(P<0.05)。CAP組與 ALI組比較,PaO2明顯升高(P<0.05),PaCO2明顯降低(P<0.05)。見表1。
2.3 病理改變
光鏡下觀察對照組肺組織結構清楚,未見明顯病理改變,ALI組則見彌漫性充血水腫,肺泡壁明顯增厚,大量中性粒細胞浸潤,CAP組肺組織輕度水腫,肺泡壁略有增厚,少量中性粒細胞分布。
3 討論
曾經有研究證實,ARDS 患者血清中TNF-α的水平較正常人明顯升高,能夠反映肺組織損傷的嚴重程度[4]。TNF-α被認為是引起ALI 最重要的細胞前炎性因子之一,其來源于巨噬細胞,是多種細胞分泌IL-6的強誘導物[5],是一種多功能促炎因子,它可以直接損傷內皮細胞,使內皮細胞通透性增加;激活中性粒細胞釋放各種氧化物質及蛋白分解酶;抑制肺表面活性物質的合成,使肺順應性降低引起肺水腫;激活凝血系統使凝血增加而形成微血栓;激活補體系統加重肺內炎癥反應[6-8],能促進中性粒細胞的吞噬能力,促進中性粒細胞脫顆粒和釋放溶酶體,增強中性粒細胞呼吸爆發,產生大量脂質代謝產物,引起微血管舒縮異常和微血栓形成,加速ALI的發展進程[9],這些因素最終導致了急性肺損傷的形成。而卡托普利的結構中含有一個巰基具有類似超氧化物歧化酶的清除自由基的功能[10],有助于更好地發揮保護內皮細胞的作用,其抑制AngⅡ合成,減少緩激肽的降解,降低肺動脈高壓,促進肺血管內皮功能障礙的恢復,清除多種自由基降低血管通透性,減輕炎性滲出和組織水腫,具有一定的抗炎、抗纖維化作用。在本次試驗中,ALI組肺組織中TNF-α含量明顯增高,而CAP組TNF-α的濃度顯著降低,同樣從實驗結果中的血氣值可以看出CAP組的大鼠肺功能較ALI組有了明顯改善,從最終的肺組織病理改變也可以看出,CAP組的肺組織損傷情況較ALI組有了明顯的減輕,可見卡托普利的這些藥理特性可以對應地抵抗TNF-α的部分損傷作用,說明卡托普利對稀鹽酸酸吸入氣管而引起的急性肺損傷存在一定的治療作用,同時也說明卡托普利對胃酸誤吸入肺導致的急性肺損傷也具有一定的治療作用。
[1]Hudson LD,MilBerg JA,Anardi D,et al. Clinical risks for development of the acute respiratory distress syndrome [J]. AmJ Respir Crit Care Med,1995,151(2):293-301.
[2]李玖軍,薛辛東.卡托普利對高氧致新生大鼠慢性肺疾病的保護作用及機制探討[J].中國當代兒科雜志,2007,9(4):169-173.
[3]劉新,余金甫,黃海波.TNF-α介導酸誤吸引起的急性肺損傷[J].中華麻醉學雜志,1997,17(8):484-486.
[4]Baggiolini M.Chemokines and leukocyte traffic[J].Nature,1998,392(6676):565.
[5]Oliknwsky T,Wang ZQ,Dudhane A,et al.Two distinct path-ways of human macrophage differentiation are mediated by interferon-gamma and interleukin-10[J].Immunology,2007,91(1):104.
[6]劉紅菊,李元桂,畢愛華,等.腫瘤壞死因子在急性肺損傷發病機制中的作用[J].國外醫學:免疫學分冊,1996,5:229-231.
[7]Bauer TT,Monton C,Torres A,et al.Comparison of systemic cytokine levels in patients with acute respiratory distress syndrome,severe pneumonia,and controls[J].Thorax,2000,55:46-52.
[8]Park WY,Goodman RB,Steinberg KP,et al.Cytokine balance in the lungs of patients with acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2001,164:1896-1903.
[9]劉和亮,趙金恒.血管緊張素轉換酶抑制劑對化學性急性呼吸窘迫綜合征治療作用的實驗研究[J].中華預防醫學雜志,2002,36(2):93-96.
[10]Mittra S,Singh M.Possible mechanism of captopril induced endothelium-dependent relaxation in isolated rabbit aorta[J].Mol Cell Bioc hem,1998,183:63-67.

