大豆中轉基因成分的定性PCR檢測
南京曉莊學院 郭云鸝 俞淑芳 張鳳紅 周紅霞*
隨著轉基因技術的飛速發展,轉基因產品市場不斷拓展,越來越多的轉基因農產品商品化。轉基因生物(GMO)抗逆性強、產量高、生產成本相對較低,具有較好的市場競爭性和應用前景。但轉基因生物的廣泛應用是否會對生態環境和人類及其他生物的健康造成不良影響,至今仍無定論(金蕪軍等,2004)。PCR技術手段由于其高效性而成為轉基因食品的最常用檢測方法。國際通用方法是以PCR技術為平臺,通過特異擴增轉基因調控原件花椰菜花葉病毒(CaMV35S)啟動子、脂肪堿合酶 (NOS)終止子以及目的基因抗除草劑基因Cp4-EPSPS來篩選檢測轉基因食品 (Su等,2003)。本實驗以轉基因大豆為原料,采用CTAB法從中提取了基因組DNA。設計并合成引物對轉基因大豆的內源基因Lectin,外源基因CaMV35S啟動子、NOS終止子和Cp4 EPSPS基因進行檢測,為轉基因大豆及產品的檢測奠定基礎。
1 材料與方法
1.1 實驗材料 轉基因大豆,由南京農業科學院作物科學研究所提供;非轉基因大豆為東北大豆。
1.2 儀器與試劑 PCR儀 (Biomera TGRADIENT)、Y04S-C型凝膠成像分析系統;CTAB緩沖液、酚、三氯甲烷、異戊醇、異丙醇、70%乙醇、TE溶液、RNA酶溶液 (購自南京天為生物科技有限公司)、異丙醇、10×PCR反應緩沖液、氯化鎂 (25 mmol/L)、dNTP 溶 液 (2.5 mmol/L)、引 物(自行設計,由南京金瑞斯生物科技有限公司提供)、Taq 酶(5 U/μL)、Maker(購自寶生物工程有限公司)。
1.3 引物設計 根據 《大豆轉基因成分的定性PCR檢測方法(SN/T 1195-2003)》設計了轉基因大豆的Lectin內標基因、CaMV35S啟動子基因、NOS終止子基因、Cp4 EPSPS基因的引物序列(表1), 基因檢測片段的長度分別為118、195、180 bp和320 bp(Zhang 等,2007;程紅梅等,2007)。
1.4 實驗方法
1.4.1 大豆DNA的提取 采用CTAB提取法,分別稱取100 mg試樣在液氮中充分研磨成粉狀至
1.5 mL離心管中,同時設空白對照。加入600 μL CTAB緩沖液,振蕩均勻,65℃溫育30 min。加入500 μL 酚+三氯甲烷+異戊烷(25∶24∶1,V/V/V),振蕩均勻,12000 r/min離心15 min。吸取上清液,放入另一新管中,加入等體積的異丙醇,12000 r/min離心10 min。棄去上清夜,加入70%乙醇溶液洗滌,12000 r/min離心1 min。棄去上清夜,干燥,用50 μL TE溶液溶解沉淀。加入5 μL RNA酶溶液,37℃溫育30 min。加入400 μL的CTAB溶液,振蕩均勻。加入 250 μL 的三氯甲烷+異戊烷(24∶1,V/V),振蕩均勻,12000 r/min離心 15 min。吸取上清液,放入另一新管中,加入200 μL的異丙醇,12000 r/min離心10 min。棄去上清液,干燥,用50 μL TE溶液溶解沉淀即為大豆DNA提取液(金紅等,2006)。

表1 引物序列與擴增產物長度
1.4.2 PCR反應體系及反應條件 反應體系:10×PCR Buffer 2.5 μL,25 mmol/L MgCl 22.5 μL,dNTP 2.5 mmol/L 2.0 μL,20 pmol/μL 引物 (正:0.25 μL, 反:0.25 μL),5 U/μL Taq 酶 0.125 μL,DNA模板取量為0.6 μL,所補超純水量隨DNA模板量而變化,最終補足25 μL。PCR反應條件見表2,同時設陽性對照、陰性對照、空白對照。
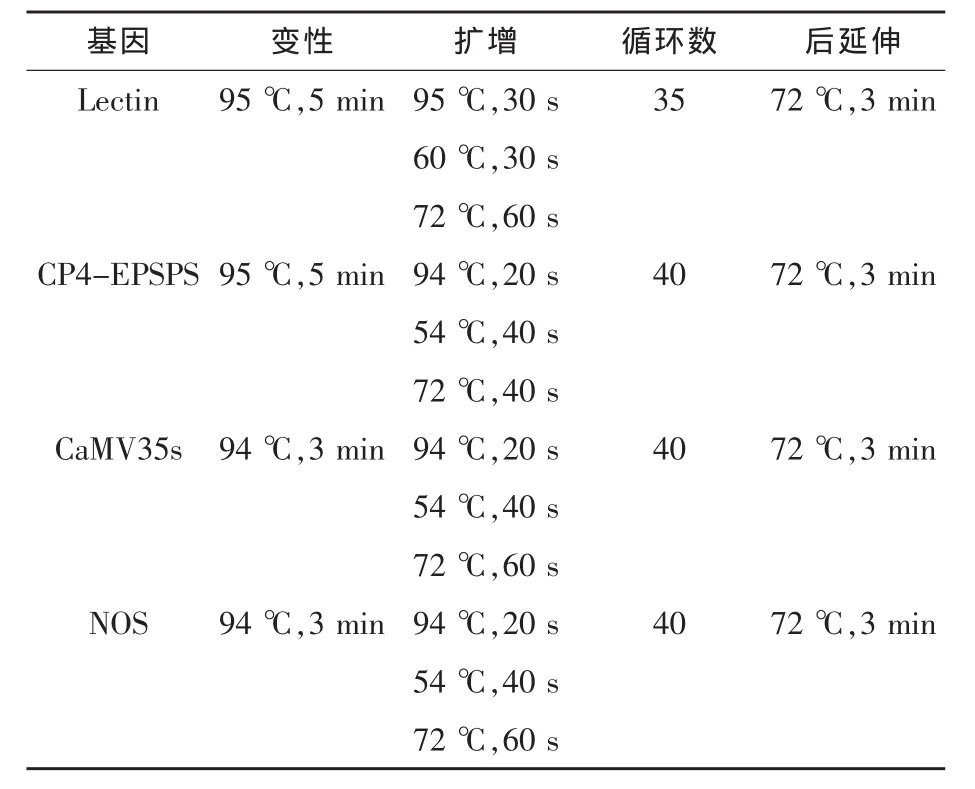
表2 PCR反應條件
1.4.3 瓊脂糖凝膠電泳檢測PCR產物 PCR產物在2%瓊脂糖凝膠中電泳,緩沖液為1×TAE電泳緩沖液,以5 V/cm電壓中電泳20 min,用凝膠成像系統觀察結果。
2 結果與分析
2.1 轉基因大豆的DNA電泳圖 將提取的DNA進行瓊脂糖凝膠電泳,結果如圖1所示。由圖1可知,轉基因大豆和非轉基因大豆均有明顯條帶,純度較高,可用于 PCR 擴增(Zhang等,2007)。
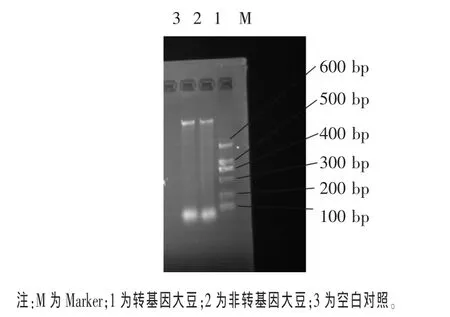
圖1 轉基因大豆的DNA電泳圖
2.2 大豆內源基因Lectin的檢測 Lectin基因是大豆所特有的內源性基因,檢測內源基因可以判斷所提取的DNA是否適合用于PCR擴增,同時還可以判斷所提取的DNA是否含有PCR擴增抑制物,從而避免結果出現假陰性。按表2的PCR反應條件首先檢測了Lectin基因,以水代替DNA模板作為空白對照。圖2為大豆內源基因Lectin的檢測結果。由圖2可見,轉基因大豆、非轉基因大豆均能擴增出118 bp片段,說明所提取的DNA質量較好,可用作PCR檢測模板。
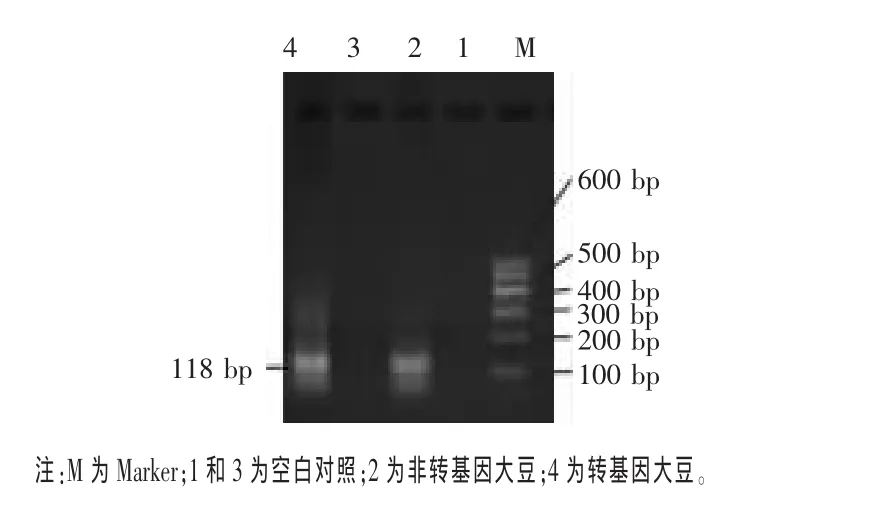
圖2 內源基因Lectin的PCR擴增電泳圖
2.3 大豆食用油中外源基因檢測結果 外源基因的檢測通常包括兩方面:一是調控基因的檢測;二是目的基因的檢測。首先對調控基因CaMV35S啟動子和NOS終止子按表2的PCR條件進行擴增檢測,以水代替DNA模板作為空白對照,結果見圖3和圖4。從圖3和圖4可見,轉基因大豆能擴增出 195 bp的CaMV35S啟動子和180 bp的NOS終止子片段,而非轉基因大豆未擴增出這兩個基因(程紅梅等,2007)。

圖3 CaMV35S啟動子基因擴增結果
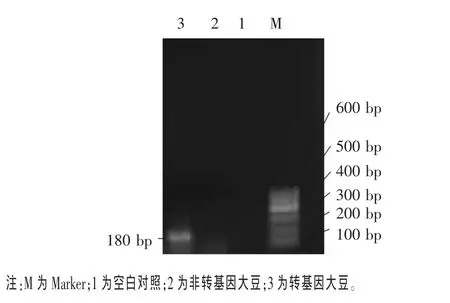
圖4 NOS終止子基因擴增結果
由于CaMV35S啟動子來源于花椰菜花葉病毒,NOS終止子來源于根際的農桿菌,因此若原料大豆被花椰菜花葉病毒或被根瘤膿桿菌侵染,檢測就會有假陽性出現。因此,除了檢測調控基因,還要檢測目的基因 Cp4-EPSPS(Zhang,2007)。Cp4-EPSPS基因的檢測結果見圖5。由圖5可見,轉基因大豆所提取的DNA可以成功檢測到目的基因Cp4-EPSPS 320bp片段,而非轉基因大豆和空白對照均未檢測出該片段。
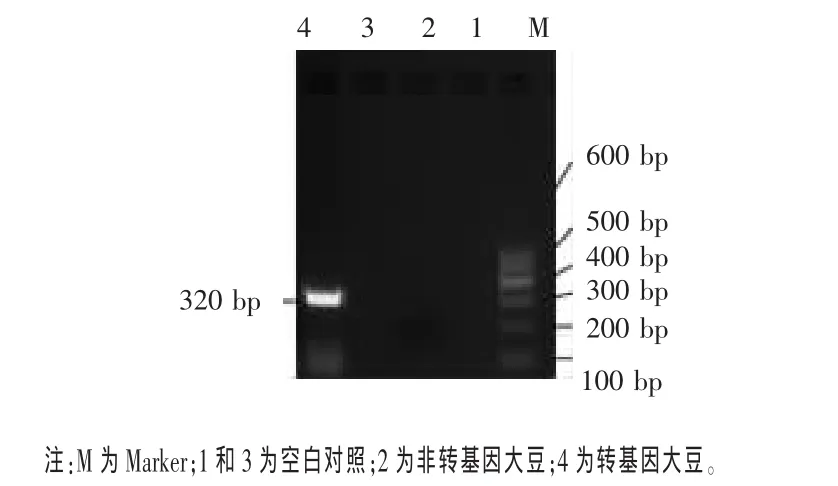
圖5 轉基因大豆Cp4 EPSPS基因擴增結果
3 結論
本實驗建立了轉基因大豆定性PCR檢測體系,該方法所檢測的CaMV35S啟動子、NOS終止子、Cp4-EPSPS等基本覆蓋了目前已商品化的轉基因大豆及其深加工產品,基本滿足各國家和地區轉基因大豆產品的定性檢測。
[1]程紅梅,彭于發,金蕪軍,等.一種快速、簡便提取大豆油DNA的方法及轉基因大豆油的檢測[J].中國農業科學,2007,40(5):1069 ~ 1072.
[2]金蕪軍,賈士榮,彭于發.不同國家和地區轉基因產品標識管理政策比較[J].農業生物技術學報,2004,12(1):1 ~ 7.
[3]Su W,Song S,Long M,et al.Multiplex polymerase chain reaction/menmbrene hybridization assay for detection of genetically modified organisms[J].Journanl of Biotechnology,2003,105:227 ~ 233.
[4]Zhang M H,Gao X J,Yu Y B,et al.Detection of Roundup Ready soy in hihgly processed products by triplex nested PCR[J].Food Control,2007,18:1277~1281.

