纈沙坦和阿托伐他汀治療高血壓合并持續性心房顫動療效研究
吳建國(河源市源城區人民醫院內科,廣東河源 517000)
持續性心房顫動是常見到心律失常之一,隨著心房肌重構,有可能發展至永久性心房顫動,且患者年齡越大,其危害性越強。高血壓是引起心房顫動的最常見原因。高血壓合并持續性心房顫動主要依賴于藥物治療。本研究比較了纈沙坦聯合阿托伐他汀與單獨服用阿托伐他汀對高血壓合并持續性心房顫動的療效,結果報道如下。
1 資料與方法
1.1 一般資料 本院2010年1月至2012年10月收治的高血壓合并持續性心房顫動患者108例,男66例、女42例,年齡49~81歲,平均65.43歲,符合高血壓(收縮壓不低于140mm Hg,舒張壓不低于90mm Hg)及持續性房顫(發病時間超過1周,發病時伴隨心悸氣短、胸悶、眩暈、出汗等癥狀)診斷標準[1],排除甲狀腺功能亢進、原發性及風濕性心臟病、腫瘤、呼吸道及消化道急性炎癥、血液病等疾病患者。108例患者隨機分為治療組54例和對照組54例,年齡、性別、體質量、病程、左心房內徑(LAD)組間比較差異無統計學意義(P>0.05)。
1.2 方法 治療組采用口服纈沙坦聯合阿托伐他汀治療,纈沙坦(瑞氏諾華)80mg/d,阿托伐他汀(美國輝瑞)第1周600 mg/d,第2周400mg/d,第3周開始維持200mg/d。對照組只采用阿托伐他汀治療,用法及用量同治療組。每個月隨訪患者2次,有心房復顫臨床表現時進行心電圖/動態心電圖檢測以確診是否發生心房復顫。在入院及治療第6、12、18個月分別進行LAD檢測、超敏C反應蛋白(hs-CRP)及腎功能、血脂、心電圖等檢測。
1.3 統計學處理 采用SPSS16.0軟件進行數據分析;計量資料±s表示,組間比較采用t檢驗;顯著性檢驗水準為α=0.05,P<0.05為比較差異有統計學意義。
2 結 果
治療前各指標組間比較差異無統計學意義(P>0.05)。第18個月治療組及對照組患者血壓均恢復至正常范圍,且組間比較差異無統計學意義(P>0.05),但三酰甘油(TG)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、hs-CRP、LAD、左室質量指數(LVMI)組間比較差異均有統計學意義(P<0.05)。見表1。
表1 治療前后各指標檢測結果比較(±s,n=54)
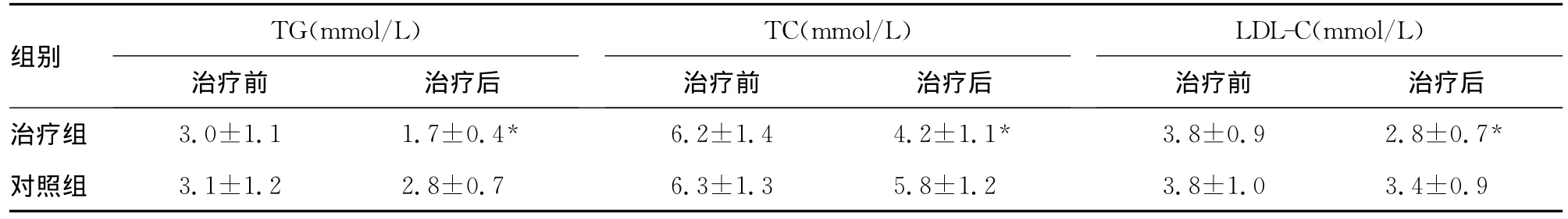
表1 治療前后各指標檢測結果比較(±s,n=54)
TG(mmol/L)TC(mmol/L)LDL-C(mmol/L)組別治療前 治療后治療組 3.0±1.1 1.7±0.4* 6.2±1.4 4.2±1.1* 3.8±0.9 2.8±0.7治療前 治療后 治療前 治療后*對照組 3.1±1.2 2.8±0.7 6.3±1.3 5.8±1.2 3.8±1.0 3.4±0.9
續表1 治療前后各指標檢測結果比較(±s,n=54)

續表1 治療前后各指標檢測結果比較(±s,n=54)
注:與對照組比較,*P<0.05。
LAD(cm)hs-CRP(mg/L)LVMI(g/m2)組別治療前 治療后治療組 4.6±0.5 2.9±0.4* 11.3±0.8 3.5±0.4* 116.5±1.9 82.6±1.3治療前 治療后 治療前 治療后*對照組 4.5±0.6 4.3±0.6 11.4±0.5 8.9±0.5 115.8±1.6 107.7±1.5
3 討 論
高血壓所致心房顫動已成為常見心律失常類型之一。高血壓患者動脈壓不斷升高,導致左心室內徑粗大并且肥厚,心肌間質內的纖維和二尖瓣乳頭肌增生,室間隔增厚,腱索松弛,使左心室舒張力減弱,左心房容積擴大,心肌纖維化,進而導致左心房重構[2]。與此同時,高血壓也可引起左心室肥厚,使左心室的順應性降低,并導致左心房壓力升高,使心房肌的多數小動脈管腔內膜增厚而導致狹窄或完全閉塞,局部心肌發生缺血變性及纖維化。發生于小動脈的病變在心房肌中形成大量缺乏應激功能的小島,進而為陣發性房顫的發生提供了心房電活動不一致的病理基礎[3]。另一方面,在上述病理因素的作用下,心房肌電活動的非均質性程度進一步加重,導致心房的除極速度減慢,而不同部位心房的自律性和興奮性的差異進一步增大,使不同部位心房電活動的空間向量及彌散度出現顯著差異。上述因素共同構成了高血壓發顫的基礎。高血壓合并房顫患者外周血內皮素水平的升高,則可能與房顫導致血流動力學異常,即心房肌收縮功能減弱、出現不規則心室律、血管壁應力性異常及局部心肌組織缺血、缺氧有關[4]。
高血壓之所以能夠誘發心房顫動,與多種因素有關。高血壓可導致心房結構及生物信號傳導的重構,進而導致心房顫動的發生,其中與炎癥及氧化應激等不良刺激的關系較為顯著[5-6]。此外,高血壓導致心房顫動,可能也與血管內皮功能損傷有關。纈沙坦屬于選擇性血管緊張素Ⅱ受體拮抗劑,可抑制血管緊張素Ⅱ和AT1受體結合,進而阻止由其導致的心臟血管收縮。纈沙坦對高血壓的治療效果好,耐受性高且不良反應小。Skalidis等[7]發現心房對NO的生物利用不足、心肌NO合成酶表達量下降與心房顫動關系緊密。他汀類藥物具有恢復血管內皮功能的作用,而氧化應激和炎癥可導致心房重構及心肌電生理紊亂,使心房擴張、有效不應期縮短,最終形成心房顫動[8-9]。
本研究證實纈沙坦聯合阿托伐他汀治療高血壓合并持續性心房顫動,可有效降低患者TG、TC、LDL-C、hs-CRP、LAD和LVMI等指標的水平,說明纈沙坦聯合阿托伐他汀可能是高血壓合并持續性心房顫動的有效治療方法。
[1]劉力生,王文,姚崇華.2009年基層版《中國高血壓防治指南》(摘錄)[J].柳州醫學,2011,4(2):104-117.
[2]戚文航.血管緊張素受體拮抗劑與心房顫動[J].中華心血管病雜志,2004,32(11):1042-1043.
[3]Blender S,Gerstenfeld EP,Lin D,et al.Ablation of atrial fibrillation:localizing triggers,mapping systems and ablation techeniques[J].Minerva Cardioangiol,2004,52(2):95-109.
[4]Gosselink ATM,Smith AJ,Crijn CJ,et al.Alteration of peripheral vasodilatory reservecapacity after cardioversion of atrial fibrilation[J].Eur Heart J,1996,17(8):926-934.
[5]van Wagoner DR.Oxidative stress and inflammation in atrial fibrillation:rold in pathogenesis and potential as a therapeutic target[J].J Cardiovasc Pharmacol,2008,52(4):306-313.
[6]Kourliouros A,Savelieva I,Kiotsekoglou A,et al.Current concepts in the pathogenesis of atrial fibrillation[J].Am Heart J,2009,157(2):243-252.
[7]Skalidis EI,Zacharis EA,Tsetis DK,et al.Endothelial cell function during atrial fibrillation and after restoration of sinus rhythm[J].Am J Cardiol,2007,99(9):1258-1262.
[8]Guazzi M,Berti M,Belletti S,et al.Exercise metaboreflex activation and endothelial function impairment in atrial fibrillation[J].Am J Physiol Heart Circ Physiol,2006,291(5):2396-2402.
[9]Adam O,Neuberger HR,Bohm M,et al.Prevention of atrial fibrillation with 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors[J].Circulation,2008,118(12):1285-1293.

