錳超氧化物歧化酶模擬化合物誘導人卵巢上皮性癌細胞株SKOV3凋亡的研究
李衛 何援利 米登海
(1.南方醫科大學珠江醫院婦產科,廣東廣州 510282;2.甘肅省第二人民醫院腫瘤科,甘肅蘭州 730000)
錳超氧化物歧化酶(manganese superoxide dismutase,MnSOD)主要存在于真核細胞、原核細胞及線粒體基質中,它作為一種重要的抗氧化劑在機體防御疾病的過程中起著重要作用。天然的MnSOD分子質量大、在體內半衰期短、穩定性差、易被蛋白水解,且長期應用可誘發免疫和過敏反應,這些不足限制了其臨床應用[1]。文獻[2-4]報道,人工合成的MnSOD即錳超氧化物歧化酶模擬化合物(mimics of manganese superoxide dismutase,MnSODm)對敏感和耐藥的白血病細胞的活性具有較強抑制作用。我們的試驗也表明,MnSODm對人卵巢上皮性癌細胞株SKOV3的裸鼠移植瘤有治療作用。本實驗研究MnSODm對SKOV3細胞的凋亡效應,并探討其可能的機制。
1 資料與方法
1.1 材料 MnSODm由蘭州大學化工學院劉偉生教授提供,分子式為C40H57Mn2N9O21;SKOV3細胞株購自韓國細胞銀行,RPMI1640培養基為美國GibcoBRL公司產品;新生牛血清購自杭州四季青生物工程材料研究所。活細胞計數試劑盒(cell counting kit-8,CCK-8)購自日本同仁化學研究所,生物潔凈安全柜購自江蘇蘇凈公司,碘化丙啶(propidium iodide,PI)單染試劑盒購自美國Sigma公司。
1.2 方法
1.2.1 細胞培養 SKOV3細胞置于含10%胎牛血清的RPMI1640培養基中,在37℃、5%二氧化碳、飽和濕度條件下進行培養,每2~3d換液1次,待細胞長滿80%~90%進行傳代。
1.2.2 細胞增殖能力和活性的測定 取對數生長期的SKOV3細胞,以0.25%胰酶消化,計數并接種于96孔培養板內,調整細胞濃度為3×103個/孔,加入 MnSODm(分為3個濃度梯度,即0、10、50μg/mL,0μg/mL為空白對照組)。分別培養0、24、48和72h后,按照CCK-8試劑盒說明書,在上述時間點,每孔加入10μL的CCK-8溶液,將培養板在培養箱內孵育2h,用酶標儀測定450nm處的吸光度,即A值。

1.2.3 PI單染檢測凋亡細胞 加入不同濃度梯度的 MnSODm(0、10、50μg/mL)處理SKOV3細胞72h后,去除上清液,加入200μL磷酸鹽緩沖液(phosphate buffered saline,PBS)洗滌,離心并去除PBS,加入冰預冷的70%乙醇固定,4℃放置24h,離心棄去固定液,加入100μL核糖核酸酶(RNase)和PI染液,4℃避光30min,熒光顯微鏡下觀察凋亡細胞變化。
1.2.4 細胞形態學觀察 SKOV3細胞經不同濃度梯度(0、10、50μg/mL)MnSODm處理0、24、48、72h后,在倒置顯微鏡下觀察活細胞數目和形態的改變。
1.2.5 caspase3/7 活性檢測 將對數生長期的SKOV3細胞加于96孔培養板中,依據 MnSODm的不同濃度(0、10、50μg/mL)將其分為3組,分別培養72h,將caspase3/7底物和PBS混合后取100 μL加入以上各孔,37℃反應30min。用熒光分光光度計分析。
1.3 統計學處理 采用SPSS13.0軟件處理數據,實驗數據以均數±標準差(±s)表示,組間分析比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 MnSODm處理SKOV3后細胞的增殖能力和活性 MnSODm對SKOV3細胞增殖有明顯抑制作用,對SKOV3細胞活性亦有明顯抑制作用。見表1。
表1 不同濃度MnSODm對SKOV3細胞增殖能力和活性及caspase3/7活性的影響(±s,n)
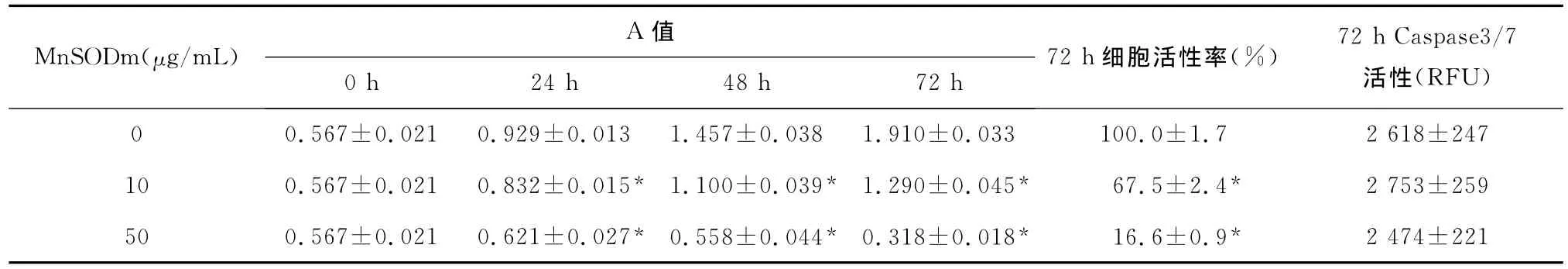
表1 不同濃度MnSODm對SKOV3細胞增殖能力和活性及caspase3/7活性的影響(±s,n)
注:與同時間0μg/mL濃度組比較,*P<0.01
MnSODm(μg/mL) A值0h 24h 48h 72h 72h細胞活性率(%) 72hCaspase3/7活性(RFU)0 0.567±0.021 0.929±0.013 1.457±0.038 1.910±0.033 100.0±1.7 2 618±247 10 0.567±0.021 0.832±0.015* 1.100±0.039* 1.290±0.045* 67.5±2.4* 2 753±259 50 0.567±0.021 0.621±0.027* 0.558±0.044* 0.318±0.018* 16.6±0.9*2 474±221
2.2 細胞凋亡形態學的變化 在熒光倒置顯微鏡下觀察發現,空白對照組細胞生長狀態良好,表現為細胞伸展、透亮且折光性好;而10、50μg/mL Mn-SODm處理后的細胞伸展度降低,部分細胞體積變小、皺縮,折光性差。見圖1。
2.3 PI染色檢測MnSODm對SKOV3細胞凋亡的影響 空白對照組細胞核呈圓形,邊緣清晰,染色均勻;而10、50μg/mL MnSODm處理的細胞核邊緣不規則,染色質凝集,著色較重,核固縮,核著色強陽性細胞數明顯高于空白對照組。見圖2。

圖1 MnSODm作用SKOV3細胞72h后細胞大體觀
2.4 不同濃度 MnSODm對caspase-3/7活性的影響 SKOV3細胞經10和50μg/mL MnSODm處理72h后,caspase-3/7的活性與空白對照組比較,差異無統計學意義(P>0.05)。見表1。
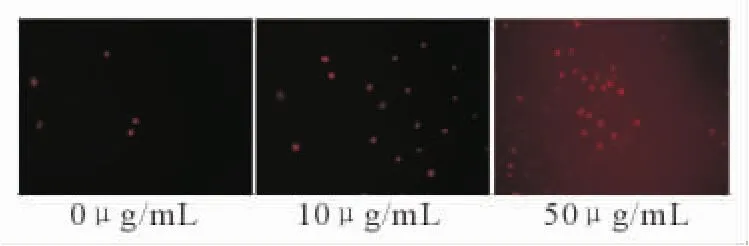
圖2 PI染色后熒光顯微鏡下凋亡細胞的改變
3 討 論
超氧化物歧化酶(superoxide dismutase,SOD)是一種廣泛存在于生物體內的含銅、錳、鐵等金屬離子的酶,它能夠有效清除活性氧以及氧化過程中產生的超氧陰離子自由基(O2-·),是生物體抗氧化系統的第一道防線[5]。
MnSOD過量表達在多數腫瘤細胞中可抑制細胞生長,其機制尚不明確。目前認為,細胞氧化還原狀態失衡引起細胞生長障礙,MnSOD過量表達使線粒體中的減少,如果分解H2O2的酶未相應增加,H2O2濃度將會增高,引起細胞代謝障礙和生長抑制。高濃度的H2O2和一氧化氮(NO)能夠協同抑制腫瘤生長,原因在于NO在H2O2存在下生成羥自由基(·OH),增加了單鏈 DNA 損傷[6]。MnSOD過量表達時,谷胱甘肽過氧化物酶和H2O2酶代償性增加,NO可能通過抑制H2O2酶的作用而減少H2O2的分解,維持 MnSOD過量表達,使H2O2處于高水平狀態。MnSOD過量表達使細胞對谷胱甘肽(glutathion,GSH)合成阻滯劑—丁胱亞磺酰亞胺的敏感性增加,并使H2O2產生增加,使還原性與氧化性谷胱甘肽(GSSG)的比值即GSH/GSSG減少,這可能與NO敏感性亢進有關。
Bernard等[7]研究顯示,MnSOD過量表達可清除腫瘤壞死因子α(TNF-α)誘導產生的而使細胞凋亡逃逸,但細胞內H2O2蓄積后則會抑制細胞的增生并促進其凋亡,當MnSOD轉化的H2O2超過MnSOD清除的能力時,將會導致由細胞色素C及caspase-3、6、8、9啟動的細胞凋亡。因此,MnSOD過量表達對腫瘤的保護或抑制作用受之間平衡的制約。MnSOD不僅可以通過調節平衡而抑制或促進細胞增殖,還可以通過調節信號轉導相關蛋白促進或抑制細胞凋亡[8]。
本研究結果顯示,MnSODm有促進SKOV3細胞凋亡的作用。MnSODm通過線粒體途徑和死亡受體途徑激發caspase家族活性,從而誘導敏感和耐藥的白血病細胞凋亡[3]。caspase家族成員以無活性的酶原形式存在于細胞內,caspase的活化途徑有線粒體途徑、死亡受體途徑和內質網通路。上述通路最終激活caspase-3、7、6、8、9,誘導細胞凋亡。但本實驗結果表明,MnSODm處理后的SKOV3細胞中caspase-3/7的活性與空白對照組比較差異無統計學意義(P>0.05),說明MnSODm并非通過激活caspase-3/7而誘導SKOV3細胞凋亡,其誘導SKOV3凋亡的機制尚待進一步研究。
[1] Kr?mer R.The pharmaceutical potential of manganese-based superoxide dismntase mimics[J].Angew Chem Int Engl,2000,39(24):4469-4470.
[2] 安嫻,魏虎來,祁萍,等.MnSOD模擬化合物誘導人白血病多藥耐藥 K562/ADM 細胞凋亡[J].現代腫瘤醫學,2008,16(5):703-706.
[3] 范臨蘭,魏虎來,竇偉,等.MnSOD模擬化合物通過線粒體途徑誘導K562/ADM細胞凋亡[J].第四軍醫大學學報,2008,29(24):2248-2251.
[4] 范臨蘭,魏虎來,竇偉,等.錳超氧化物歧化酶模擬化合物誘導K562細胞凋亡的機制研究[J].中國藥理學通報,2009,25(10):1363-1366.
[5] Ho JC,Chan-Yeung M,Ho SP,et al.Disturbance of systemic antioxidant profile in nonsmall cell lung carcinoma[J].Eur Respir J,2007,29(2):273-278.
[6] Kim KH,Rodriguez AM,Carrico PM,et al.Potential mechanisms for the inhibition of tumor cell growth by manganese superoxide dismutase[J].Antioxid Redox Signal,2001,3(3):361-373.
[7] Bernard D,Monte D,Vandenbunder B,et al.The c-Rel transcription factor can induce and inhibit apoptosis in the same cells via the uqregulation of MnSOD[J].Oncogene,2002,21(28):4392-4402.
[8] Zhang Y,Gu J,Zhao L,et al.Complete elimination of colorectal tumor xenograft by combinde manganese superoxide dismutase with tumor necrosis factor-related apoptosis-inducing ligand gene virotherapy[J].Cancer Res,2006,66(8):4291-4298.

