油菜籽多肽的制備工藝
冉仁森,陳錦屏,*,米瑞芳,楊 笑,楊秀玲,楊亞娟,陳 杰
(1.陜西師范大學食品工程與營養科學學院,陜西 西安 710062;2.陜西師范大學旅游與環境學院,陜西 西安 710062)
油菜籽餅粕中蛋白質含量高達30%~45%,卻沒有很好的開發利用,80%的油菜籽餅粕被用做肥料[1]。油菜籽蛋白氨基酸組成平衡,符合聯合國糧食及農業組織的要求,但是由于油菜籽餅粕中存在抗營養因子,因此目前油菜籽餅粕主要作為飼料和肥料[2-4]。油菜籽多肽是油菜籽蛋白經蛋白酶酶解后,得到的蛋白質水解產物,具有增強免疫力、抗氧化、降血壓、抑制腫瘤生長、抗艾滋病的生理功能[5]。因此研究油菜籽餅粕粗多肽的制備工藝,對于油菜籽蛋白資源的開發利用具有積極的現實意義。目前為止,前人對油菜籽多肽的研究多集中于油菜籽蛋白酶酶解最優工藝、油菜籽多肽功能性質和生物活性、油菜籽多肽分離純化。黃亮等[6]以油菜籽蛋白為原料,探究不同酶酶解油菜籽蛋白的效果,最終確定堿性蛋白酶酶解菜籽蛋白,水解度達32.19%;李菊芳等[7]研究了微波輔助風味蛋白酶酶解油菜籽蛋白制備油菜籽多肽的工藝,最終油菜籽蛋白水解度達25.64%,水解度偏低;鞠興榮等[8]用兩環枯草芽孢桿菌固態發酵法來制備油菜籽肽,最終獲得的油菜籽多肽具有較高的清除DPPH自由基能力;Sari等[9]詳細研究了不同酶解油菜籽蛋白與不同pH值下水解油菜籽蛋白獲得不同的油菜籽蛋白水解產物的抗ACE活性和防脂質氧化的活性,研究結果表明油菜籽蛋白水解產物是一種抗ACE活性的功能性食品資源。油菜籽蛋白酶解液一般先采用鹽析、等電點沉淀、超濾和有機溶劑分級等分離方法,去除大部分雜質或對溶液進行濃縮,再使用離子交換、凝膠過濾、吸附層析、高效液相色譜等方法進行下一步分離純化[10-11]。
對于油菜籽多肽而言,酶解液中的雜質大多為大分子物質,而這些雜質可采用調節蛋白酶解液的pH值,使未水解的蛋白質沉淀,從而除去部分雜質;也可以采用超濾,按膜的截留相對分子質量對物料進行分離,從而使酶解液中油菜籽多肽分離出來。但是鑒于以上方法存在操作復雜的問題,因此有必要找到一種操作簡單的制備油菜籽多肽的新方法。本實驗在單因素試驗的基礎上,利用正交試驗優化堿性蛋白酶酶解菜籽餅粕蛋白的工藝,以期在最優工藝的基礎上初步探究利用透析袋截留相對分子質量的差異來制備油菜籽餅粕粗多肽的可能性,為油菜籽餅粕粗多肽的制備提供新的研究方法。
1 材料與方法
1.1 材料與試劑
油菜籽餅粕購自陜西安康恒口鎮油菜籽油生產企業,油菜籽品種是秦優7號。
堿性蛋白酶(Alcalase,10000U/g) 西安市森博生物有限責任公司;其他試劑均為分析純。
1.2 儀器與設備
LGJ-18C真空冷凍干燥機 北京四環科學儀器廠;Kjeltec2300全自動凱氏定氮儀 瑞典福斯公司;722型可見分光光度計 上海光譜儀器有限公司;PHS-3C精密pH計 上海精密科學儀器有限公司;GZX-9146MBE數顯鼓風干燥箱 上海博訊實業有限公司醫療設備廠。
1.3 方法
1.3.1 指標測定
蛋白質含量的測定:GB5009.5—2010《食品安全國家標準 食品中蛋白質的測定》;水分含量的測定:GB5009.3—2010;硫苷葡萄糖苷的測定,參照氯化鈀快速檢測法[12];水解度的測定采用pH-stat法[13];肽氮含量的測定采用電位滴定法:肽氮=總氮含量-氨基酸態氮,總氮含量的測定:GB5009.5—2010《食品安全國家標準 食品中蛋白質的測定》,氨基酸態氮采用甲醛滴定法測定[14];菜籽餅粕蛋白的提取參照Wu等[15]的方法;菜籽餅粕蛋白的沉淀采用醇沉法;菜籽餅粕蛋白的純化參照Chabanon等[16]的方法。
1.3.2 菜籽餅粕蛋白制備
1.3.2.1 油菜籽餅粕脫脂脫毒工藝
油菜籽餅粕脫脂脫毒工藝參考何國菊[17]、李菊芳[18]等的方法,并略作修改。將油菜籽餅粕用萬能粉碎機粉碎,過40目篩備用;稱取粉碎后的油菜籽餅粕25.00g于1000mL磨口三角燒瓶內,加入氯仿-甲醇提取液300mL,再加入10mL蒸餾水,連接氯仿甲醇提取裝置進行提取,提取結束后抽濾,收集濾渣,80℃干燥約1h,冷卻至室溫粉碎過40目篩備用;稱取脫脂油菜籽餅粕200g于磁力攪拌器中,按料液比1:6(m/V)加入浸洗液甲(硫酸-甲醇-水體積比4:90:6),于室溫下用磁力攪拌器攪拌浸洗30min后,抽濾,留濾渣;再按料液比1:6(m/V)加入浸洗液甲,于室溫下用磁力攪拌器攪拌浸洗20min,抽濾,留濾渣;最后按料液比1:6(m/V)加入浸洗液乙(甲醇-水體積比90:10),于室溫下用磁力攪拌器攪拌浸洗10min,抽濾,留濾渣并于80℃烘干1h,過40目篩備用。
1.3.2.2 菜籽餅粕蛋白提取工藝
菜籽餅粕蛋白的提取參照Wu等[15]的方法,并加以修改。稱取50g脫脂脫毒油菜籽餅粕,按料液比1:10(m/V)加入pH8.0、0.05mol/L的磷酸鹽緩沖液,再加入0.5mol氯化鈉,攪拌均勻,室溫下振蕩提取1h,離心獲得上清液。菜籽餅粕蛋白的沉淀采用醇沉法:設置乙醇體積分數:65%、70%、75%、80%、85%,探究最佳醇沉時乙醇的體積濃度。對醇沉菜籽餅粕蛋白的純化參照Chabanon等[16]的方法,并作如下修改。截留分子質量為12kD的透析袋剪成20cm長的小段,菜籽餅粕蛋白沉淀物按1:6(m/V)溶于蒸餾水中,混合搖勻,再將混合液注入透析袋中約15cm處,然后將透析袋浸沒于透析液(去離子水)中于5℃中透析48h,于12、24h分別更換去離子水。醇沉菜籽餅粕蛋白純化后真空冷凍干燥得到菜籽餅粕蛋白,于-4℃冰箱中保存,備用。
1.3.3 堿性蛋白酶酶解菜籽餅粕蛋白
1.3.3.1 酶解pH值對堿性蛋白酶酶解菜籽餅粕蛋白的影響
稱取2g堿性蛋白酶溶解于100mL蒸餾水中(現配現用)配制成堿性蛋白酶液,稱取20g菜籽餅粕蛋白溶解于1000mL蒸餾水中制成菜籽餅粕蛋白溶液。設置酶解pH值梯度:7.0、7.5、8.0、8.5、9.0,在50℃、加酶量為1000U/g的條件下,酶解30min。采用加熱滅酶法[19]:沸水浴10min滅酶,冷卻至室溫測定菜籽餅粕蛋白水解度。
1.3.3.2 酶解溫度對堿性蛋白酶酶解菜籽餅粕蛋白的影響
設置酶解溫度梯度:30、40、50、60、70℃,在pH8.0、加酶量為1000U/g的條件下,酶解30min,沸水浴10min滅酶,冷卻至室溫測定菜籽餅粕蛋白水解度。
1.3.3.3 加酶量對堿性蛋白酶酶解菜籽餅粕蛋白的影響
設置加酶量為:200、600、1000、1400、1800U/g,在50℃、pH8的條件下,酶解30min,沸水浴10min滅酶,冷卻至室溫測定菜籽餅粕蛋白水解度。
1.3.3.4 酶解時間對堿性蛋白酶酶解菜籽餅粕蛋白的影響
設置酶解時間梯度:10、20、30、40、50min,在pH8.0、加酶量為1000U/g、50℃條件下酶解,沸水浴10min滅酶,冷卻至室溫后測定菜籽餅粕蛋白水解度。
1.3.3.5 堿性蛋白酶酶解菜籽餅粕蛋白的正交試驗設計
根據以上結果,選用L16(45)正交表設計試驗,對pH值、酶解溫度、加酶量、酶解時間4個因素進行優化。
1.3.4 油菜籽餅粕粗多肽制備
按照上述最優酶解條件,添加堿性蛋白酶酶解菜籽餅粕蛋白,在45℃的環境下真空濃縮酶解液到25mL,冷卻至室溫。將濃縮液與雙蒸水按積比1:6混合搖勻,再用截留分子質量為3.5kD的透析袋浸沒于透析液(去離子水)中于5℃的冰箱中透析,設置透析時間:12、24、48h,收集透析液,真空冷凍干燥,測定油菜籽餅粕粗多肽的質量和氮含量。
2 結果與分析
2.1 菜籽餅粕蛋白的制備
沉淀菜籽餅粕蛋白的最佳乙醇體積分數為75%,測定菜籽餅粕蛋白等幾種組分的含量見表1。菜籽餅粕蛋白含量為85.73%,硫代葡萄糖苷未檢出。菜籽餅粕蛋白提取率為76.69%,得率為47.84%,油菜籽餅粕經過脫脂脫毒,大部分的硫代葡萄糖苷、植酸、單寧等抗營養成分可能均被脫除,醇溶性蛋白質和少量的水溶性蛋白質也被脫除。在醇沉過程中,菜籽餅粕蛋白沉淀可能也會伴隨著一些糖和纖維素的沉淀以及一些醇溶性蛋白質的溶解,使菜籽餅粕蛋白的蛋白質含量只達到85.73%。透析過程中,理論上小分子物質和無機鹽均被脫除,但是也可能因為一些小分子物質與菜籽餅粕蛋白有弱相作用,如氫鍵、偶極作用等,導致這些小分子物質無法被透析掉,所以制備的菜籽餅粕蛋白呈現出淡黃色。

表 1 油菜籽餅粕、脫毒脫脂油菜籽餅粕、菜籽餅粕蛋白的部分成分含量Table 1 Composition of rapeseed meal, detoxicated and defatted rapeseed meal and rapeseed protein
2.2 堿性蛋白酶酶解菜籽餅粕蛋白的單因素試驗
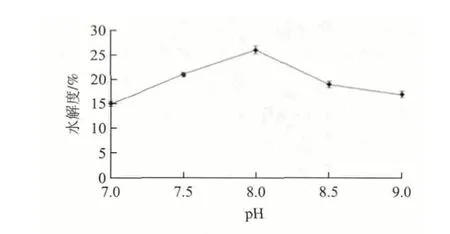
圖 1 pH值對堿性蛋白酶酶解菜籽餅粕蛋白的影響Fig.1 Effects of initial pH on the alcalse-catalyzed hydrolysis of rapeseed protein
2.2.1 酶解pH值對堿性蛋白酶酶解菜籽餅粕蛋白的影響由圖1可知,pH值低于8.0時,水解度隨著pH值的增加而增加;當pH值高于8.0時,水解度隨著pH值的增加而降低。當pH值為8.0時,堿性蛋白酶酶解菜籽餅粕蛋白的效果最好,達到26%,所以選擇酶解pH值為8.0。
2.2.2 酶解溫度對堿性蛋白酶酶解菜籽餅粕蛋白的影響
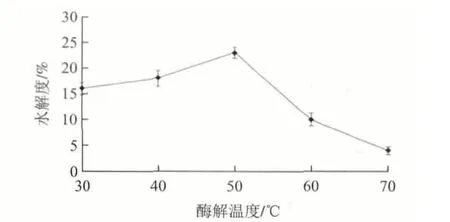
圖 2 酶解溫度對堿性蛋白酶酶解菜籽餅粕蛋白的影響Fig.2 Effect of hydrolysis temperature on the alcalase-catalyzed hydrolysis of rapeseed protein
由圖2可知,溫度低于50℃時,水解度隨著溫度的升高而增加;溫度高于50℃時,水解度隨著溫度的升高而急劇下降,這是由于酶解溫度超過50℃,導致堿性蛋白酶失活,而加熱導致菜籽餅粕蛋白內部化學鍵斷裂發生水解,所以菜籽餅粕蛋白仍有一定程度的水解。當酶解溫度為50℃時,菜籽餅粕蛋白的水解度達到最大值23%,所以選擇酶解溫度為50℃。
2.2.3 加酶量對堿性蛋白酶酶解菜籽餅粕蛋白的影響
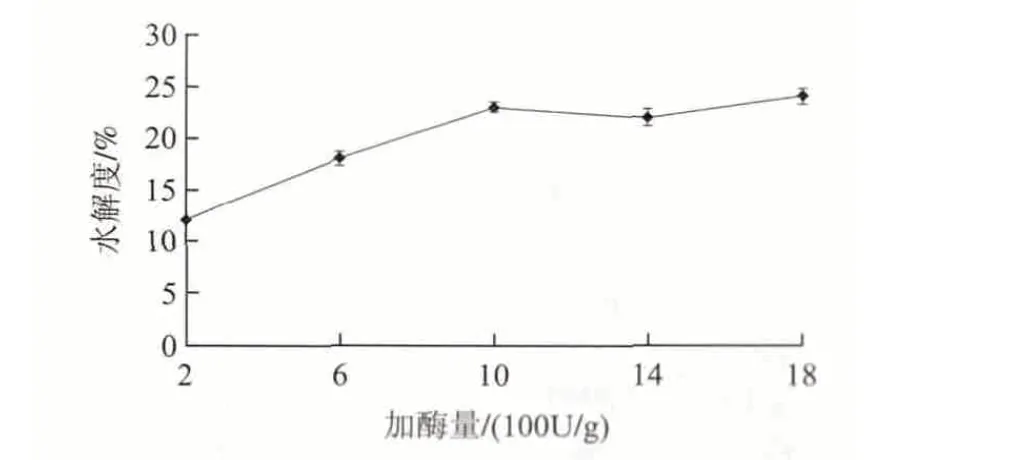
圖 3 加酶量對堿性蛋白酶酶解菜籽餅粕蛋白的影響Fig.3 Effect of enzyme/substrate ratio on the alcalase-catalyzed hydrolysis of rapeseed protein
由圖3可知,加酶量小于1000U/g時,隨著酶液體積的增加,水解度也增加;當加酶量大于1000U/g時,隨著酶液體積的增加,水解度基本保持不變。當加酶量為1000U/g時,水解度達到最大值23%,所以選擇加酶量為1000U/g。
2.2.4 酶解時間對蛋白酶酶解菜籽餅粕蛋白的影響
由圖4可知,隨著時間的延長,水解度呈現提高的趨勢,隨后水解度提高的速率幾乎為0。30min之前,酶解反應還在繼續進行,水解度隨著時間的延長而提高的;30min之后,酶解反應基本達平衡,故而水解度基本不再變化。當酶解時間30min左右,水解度達到最大值28%,所以選擇酶解時間為30min。
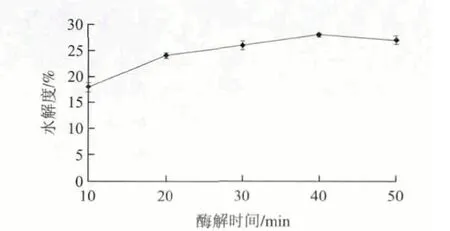
圖 4 酶解時間對堿性蛋白酶酶解菜籽餅粕蛋白的影響Fig.4 Effects of hydrolysis time on the alcalase-catalyzed hydrolysis of rapeseed protein
2.3 堿性蛋白酶酶解菜籽餅粕蛋白的正交試驗
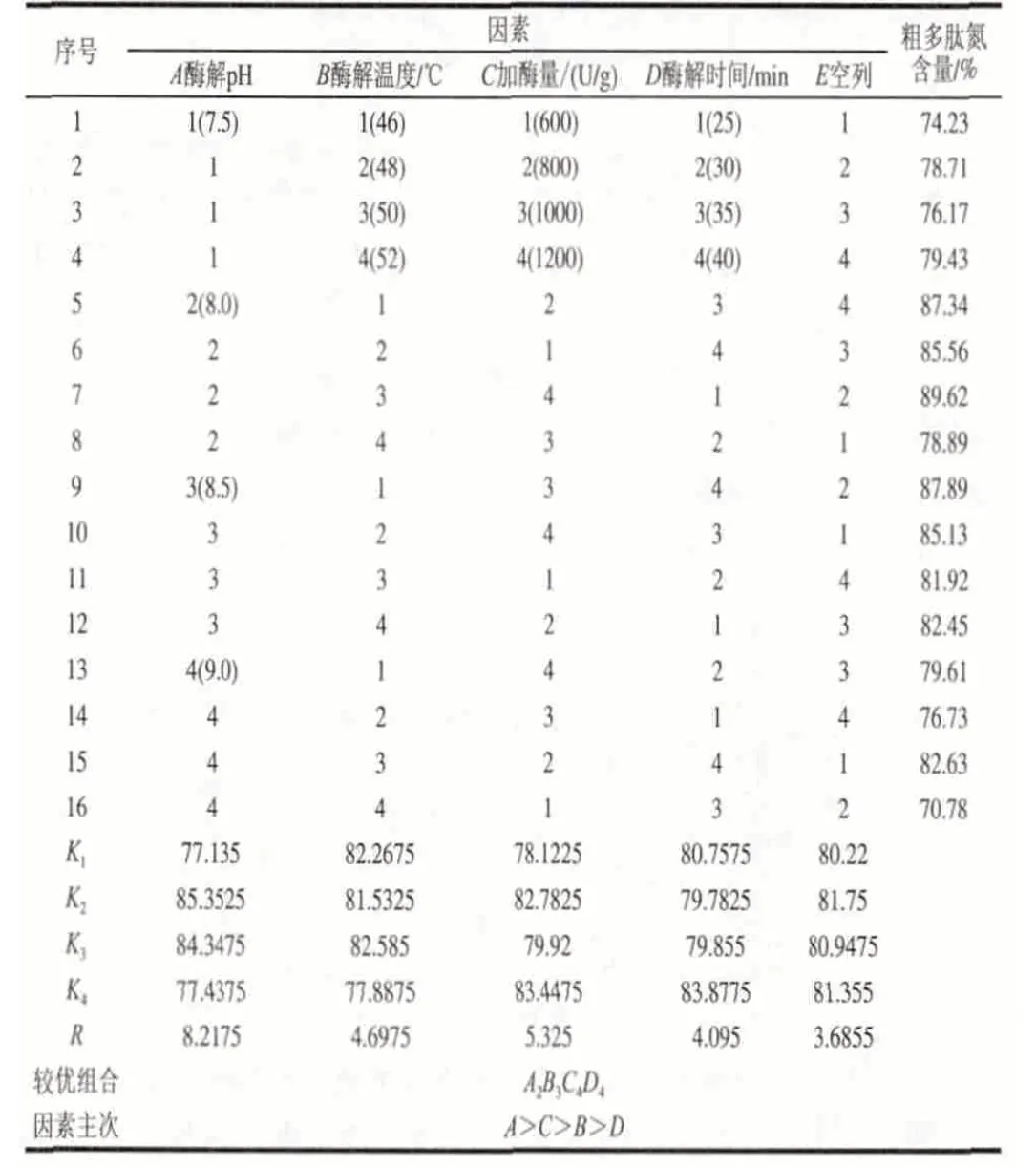
表 2 堿性蛋白酶酶解菜籽餅粕蛋白L16(45)正交試驗分析Table 2 Orthgonal array design L16(45) and results for the alcalasecatalyzed hydrolysis of rapeseed protein
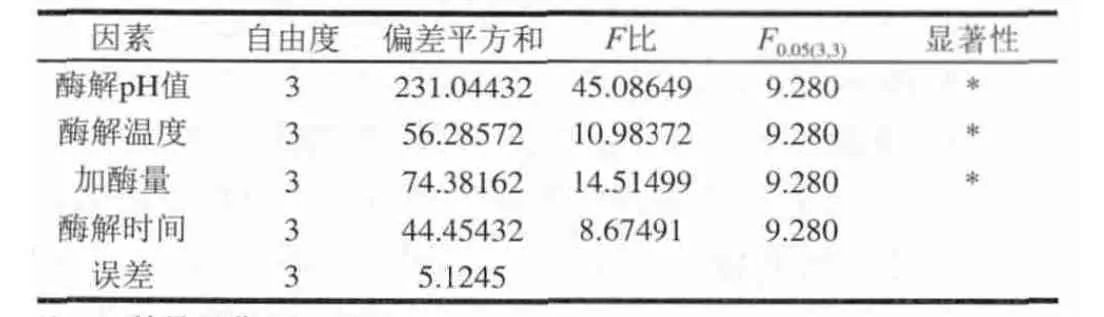
表 3 堿性蛋白酶酶解菜籽餅粕蛋白實驗因素方差分析表Table 3 Analysis of variance for the acalase-catalyzed hydrolysis of rapeseed protein
由表2可知,影響油菜籽餅粕粗多肽的氮含量的4個因素的主次順序依次為A>C>B>D,工藝組合為A2、B3、C4、D4,即酶解pH值為8.0、酶解溫度50℃、加酶量1200U/g、酶解時間40min。由表3可知,酶解pH值、酶解溫度和加酶量對菜籽餅粕蛋白的酶解效果影響顯著,與正交試驗的直觀分析結果一致。較優組合未出現在正交試驗中,對較優組合A2、B3、C4、D4進行3次重復驗證,得到油菜籽餅粕粗多肽的肽氮含量為90.05%,此時水解度為9.95%。酶解菜籽餅粕蛋白的水解度與由油菜籽餅粕粗多肽的肽氮含量計算出來的水解度有些誤差,可能是由于在油菜籽餅粕粗多肽的肽氮含量的測定過程中,沒有完全除去蛋白態氮的緣故。但是,油菜籽餅粕粗多肽的肽氮含量仍能夠作為堿性蛋白酶酶解菜籽餅粕蛋白的實驗指標,反映酶解效果。
2.4 油菜籽餅粕粗多肽制備工藝
透析時間不足48h時,所獲得的油菜籽餅粕粗多肽色澤較差質量也小,所以選擇透析時間為48h。按照優化后的工藝進行試驗,得到油菜籽餅粕粗多肽的肽氮含量達96.78%,色澤較好,為淡乳白色,油菜籽餅粕粗多肽的肽氮占菜籽餅粕蛋白總氮含量5.89%,肽氮含量較高,油菜籽餅粕粗多肽獲得量較低,雖然此種方法具有簡單易行的特點,但是還需要進一步探究完善。易起達等[20]也利用堿性蛋白酶制備油菜籽蛋白肽,水解度為14.71%,油菜籽肽得率為73.02%,但其沒有測定油菜籽肽的純度,與本研究有所不同。
3 結 論
堿性蛋白酶酶解菜籽餅粕蛋白的最佳工藝條件為:酶解pH8.0、酶解溫度50℃、加酶量1200U/g、酶解時間40min。在該酶解工藝條件下,得到油菜籽餅粕粗多肽肽氮含量為90.05%、水解度為9.95%的酶解液。
油菜籽餅粕粗多肽制備工藝為:將酶解液濃縮后,按體積比1:6與雙蒸水混合搖勻后,用截留分子質量為3500D的透析袋在5℃環境中透析48h后,將透析液進行冷凍干燥。在該工藝下,獲得油菜籽餅粕粗多肽,其多肽氮含量為96.78%,油菜籽餅粕粗多肽占油菜籽蛋白的5.89%。
制備的油菜籽餅粕粗多肽仍然含有其他的小分子物質,因而油菜籽餅粕粗多肽的肽氮含量為96.78%。油菜籽餅粕粗多肽的肽氮占菜籽餅粕蛋白總氮含量5.89%,可能有兩個原因:1)堿性蛋白酶作用于油菜籽蛋白時,酶解片段過大,只有少量的油菜籽餅粕多肽進入到透析液中;2)透析袋及透析的條件對于透析過程有很大的影響。所獲得的油菜籽餅粕粗多肽,分子質量都應小于3.5kD,與利用離子交換、凝膠過濾、吸附層析、高效液相色譜等方法分離純化所得的油菜籽餅粕粗多肽略顯不足。關于油菜籽餅粕粗多肽的制備研究,雖有較多的研究報道,但是大多在于酶解菜籽餅粕蛋白的研究和酶解產物的功能特性及生物活性的研究。本實驗提供了一種制備油菜籽餅粕粗多肽的可行方法,但油菜籽餅粕粗多肽組分的探究以及油菜籽餅粕粗多肽的功能特性及生物活性等問題,有待于進一步深入研究。
[1] 趙妍嫣, 胡林林, 趙宏偉, 等. 酶解冷榨菜籽蛋白制備肉味香精的工藝研究[J]. 中國調味品, 2011, 36(1): 93-96.
[2] 黃明亮, 王雪瑩, 孫穎, 等. 菜籽蛋白功能性質及抗氧化的研究進展[J]. 食品工業科技, 2012, 33(12): 405-413.
[3] PASTUSZEWSKA B, JABLECKI G, SWIECH E, et al. Nutritional value of rapeseed meal containing lecithin gums precipitated with citric acid[J]. Animal Feed Science and Technology, 2000, 86(1/2):117-123.
[4] 鞠興榮, 王丹丹, 嚴梅榮. Na2SO3對蛋白酶水解菜籽粕的影響[J]. 食品科學, 2010, 31(21): 45-49.
[5] 朱國富, 朱黨花, 陳劍兵, 等. 菜籽生物活性肽的研究進展[J]. 安徽農業科學, 2009, 37(28): 13547-13549.
[6] 黃亮, 馮菲, 鄭菲. 油菜籽餅粕中蛋白和肽的制取[J]. 中國糧油學報,2009, 24(9): 119-122.
[7] 李菊芳, 魏芳, 董緒燕, 等. 微波輔助菜籽蛋白水解產物的高效制備及其部分功能特性研究[J]. 中國糧油學報, 2010, 25(11): 83-88.
[8] 鞠興榮, 何海艷, 何榮, 等. 固態發酵菜籽肽功能特性研究[J]. 食品科學, 2010, 31(21): 45-49.
[10] 章紹兵, 石云, 王璋, 等. 離子交換色譜和凝膠過濾分離純化菜籽抗氧化肽[J]. 中國糧油學報, 2008, 23(5): 154-159.
[11] SOMMERER N, SALLERS C, PROME D, et al. Isolation of oligopeptides from the water-soluble extract of goat cheese and their identification by mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 402-408.
[12] 劉絢霞, 楊莉. 分光光度法測定油菜籽中的硫代葡萄糖甙[J]. 陜西農林科學, 2002(6): 5-7.
[13] ADLER NISEN J. Enzymatic hydrolysis of food proteins[M]. London and New York: Elsevier Applied Science Publishers, 1986: 122-123.
[14] 李理, 張靜. 蛋白水解產物中多肽得率的測定方法研究[J]. 現代食品科技, 2010, 26(8): 884-888.
[15] WU J, MUIR A D. Comparative structural, emulsifying, and biological properties of 2 major canola proteins, ruciferin and napin[J].Food Chemistry, 2008, 37(3): 210-216.
[16] CHABANON G I, CHEVALOT X, FRAMBOISIER, et al. Hydrolysis of rapeseed protein isolates: kinetics, characterization and functional properties of hydrolysates[J]. Process Biochemistry, 2007, 42: 1419-1428.
[17] 于洋, 王承明. 微波化學方法脫除油菜籽餅粕中硫苷的研究[J]. 中國糧油學報, 2011, 26(3): 47-51.
[18] 何國菊, 李學剛. 菜子餅粕淋洗脫毒工藝探討[J]. 食品工業科技,2008, 29(7): 165-167.
[19] 李菊芳, 魏芳, 董緒燕, 等. 微波輔助分步酶解菜籽粕制備菜籽多肽的研究[J]. 中國油脂, 2010, 35(3): 18-22.
[20] 易起達, 王茜茜, 王立峰, 等. 酶解制備菜籽蛋白肽條件的優化[J].食品科學, 2013, 34(1): 166-170.

