6種綠化灌木葉片PSⅡ的耐鹽性研究及綜合評價
王 娟,敖 紅,張會慧,田 野,孫廣玉
(東北林業大學 生命科學學院,黑龍江 哈爾濱 150040)
鹽脅迫是限制植物生長發育的主要環境因素之一,較高的土壤含鹽量不但限制植物的生長發育[1],而且植物吸收過量的鹽離子會使其體內離子平衡紊亂[2]、活性氧爆發[3]、細胞膜系統被傷害、光合機構被損傷及光合能力降低。植物光合作用中的PSⅡ反應中心的活性被認為是鹽脅迫下比較脆弱的環節之一[4],當環境條件發生變化時,植物體內葉綠素熒光的變化可在一定程度上反映出環境因子對植物的影響[5-7],根據快相葉綠素熒光動力學曲線(OJIP)可以推測出PSⅡ復合體的生理狀態,分析逆境脅迫對植物光合作用的作用位點,這已成為研究植物抗逆性的重要手段之一[8]。
黑龍江省的部分城鎮位于松嫩平原的鹽堿地區,同時該省所有城鎮均使用含鹽的融雪劑融化冬季道路上的積雪,因此,選育耐鹽的綠化植物是黑龍江省城鎮綠化工作中首要考慮的問題之一。目前,有關綠化樹種在鹽脅迫條件下其光合及生理特性的研究報道較多[9-11],這些研究涉及到植物的生長特點、滲透調節和抗氧化酶等方面,但有關鹽脅迫下黑龍江省綠化灌木樹種葉片光系統Ⅱ響應特性及利用PSⅡ參數進行耐鹽性評價方面的研究卻鮮見報道。為此,以紫丁香、白丁香、暴馬丁香、連翹、茶條槭和金銀忍冬等6種黑龍江省常見的綠化灌木樹種為材料,利用快相葉綠素熒光技術,研究了6種灌木葉片PSⅡ在不同濃度NaCl脅迫下的快速反應情況,并比較分析了NaCl脅迫下6種灌木葉片PSⅡ功能的耐鹽性,以期為篩選耐鹽性的綠化樹種提供一些基礎數據,為鹽堿地區的城市綠化和植被恢復提供技術支持。
1 材料與方法
1.1 試驗材料及處理
試驗于2012年6月在哈爾濱市東北林業大學植物生理實驗室進行,供試材料為紫丁香Syringa oblata、白丁香Syringa oblatavar.alba、暴馬丁香Syringa reticularvar.mandshurica、連翹Forsythia suspense(Thunb.) Vahl、茶條槭Acer ginnala和金銀忍冬Lonicera maackii(Rupr.) Maxim.,均為東北林業大學校園的多年生綠化植物,且其生境周圍并無高大樹木遮陰,用剪刀剪取位于樹冠南向外圍、長勢相對一致且無病蟲害的一年生枝條,迅速插入裝有蒸餾水的廣口瓶中立即帶回實驗室。
將6種灌木樹種的枝條剪成 40 cm左右長,每個枝條保留4片完全展開葉,將枝條下端分別放入含有不同濃度NaCl溶液的三角瓶中(但葉片不能浸入溶液中)進行鹽脅迫處理,在溶液中將各個品種枝條再剪掉一小段,以防形成的氣泡阻礙水分向上運輸,NaCl溶液濃度分別設為50、100、150和200 mmol·L-1,pH值保持在7.0左右,以蒸餾水為對照,每個處理3次重復,將處理好的試材放入設定溫度為25(光照)或23(黑暗)℃、光照強度為400 μmol·m-2s-1、光周期為12(光照)或12(黑暗)h、相對濕度為75%的光照培養箱中培養24 h后測定其葉綠素熒光參數值。
1.2 葉綠素熒光參數的測定方法
利用Mini調制式掌上葉綠素熒光儀(FluorPen FP 100 max,捷克)測定經0.5 h暗適應后每個處理的各個樹種變化趨勢均勻的完全展開葉片的OJIP曲線,得到其葉綠素熒光參數:PSⅡ最大光化學效率(Fv/Fm)、PSⅡ的潛在光化學活性(Fv/Fo)、OJIP曲線上2 ms時的相對可變熒光強度(VJ)、熒光上升的初始斜率(Mo)、活性反應中心的開放程度(Ψo)、原初光化學反應的最大量子產額(φPo)、非光化學猝滅的最大量子產額(φDo)、吸收光能用于QA-以后的電子傳遞的能量比例(φEo)、單位反應中心吸收的光能(ABS/RC)、單位反應中心捕獲的用于還原QA的能量(TRo/RC)、單位反應中心捕獲的用于電子傳遞的能量(ETo/RC)和單位反應中心耗散掉的能量(DIo/RC)等參數。葉片的測定部位選擇從葉基部數起的第3與第4葉脈之間,距離主葉脈2 cm左右處,每個處理的測定重復5次。
1.3 數據處理和統計方法
采用 Microsoft Excel軟件對測定數據進行整理和統計分析,文中各圖中的數值均為(平均值±標準差)(mean±SD)。采用隸屬函數法綜合評判了6個灌木樹種PSⅡ功能的耐鹽性,采用模糊數學隸屬函數值的方法計算其隸屬函數值X(ij),當某一參數與植物的耐鹽性呈正相關時,即采用如下公式計算:
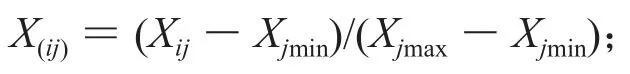
而當某一參數與植物耐鹽性呈負相關時,則采用如下反隸屬函數值的公式計算:
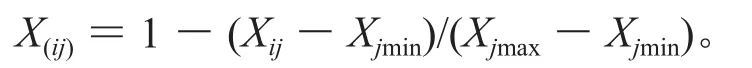
上述兩式中:X(ij)表示i種類j指標的隸屬值;Xij表示i種類j指標的測定值;Xjmax、Xjmin分別為指標的最大值和最小值[12]。然后求其各隸屬函數的總和,再據此值對6個灌木樹種的耐鹽性進行排序,總值越大,則表示該植物的耐鹽性越強。
2 結果與分析
2.1 鹽脅迫對葉片PSⅡ反應中心最大光化學效率和潛在光化學活性的影響
NaCl脅迫下6個灌木樹種葉片PSⅡ反應中心的最大光化學效率(Fv/Fm)和潛在光化學活性(Fv/Fo)的變化曲線如圖1所示。圖1顯示,6種綠化灌木葉片的Fv/Fm和Fv/Fo值隨著鹽濃度的增加均呈降低趨勢,但是,在不同鹽濃度下不同樹種的變化趨勢不同。當NaCl濃度低于50 mmol·L-1時,6個灌木樹種葉片的Fv/Fm值均無明顯變化;當鹽濃度在50~150 mmol·L-1時,暴馬丁香、連翹和紫丁香葉片的Fv/Fm值均明顯下降,金銀忍冬和茶條槭均無明顯變化;而當鹽濃度大于150 mmol·L-1時,白丁香葉片的Fv/Fm值才呈下降趨勢。隨著鹽濃度的升高,茶條槭和金銀忍冬的Fv/Fo值的變化幅度較小,同Fv/Fm值的變化情況相似,白丁香葉片的Fv/Fo值也僅在鹽離子濃度大于150 mmol·L-1時才明顯下降,但連翹、紫丁香和暴馬丁香葉片的Fv/Fo值隨著鹽離子濃度的增加其降低趨勢均較明顯。
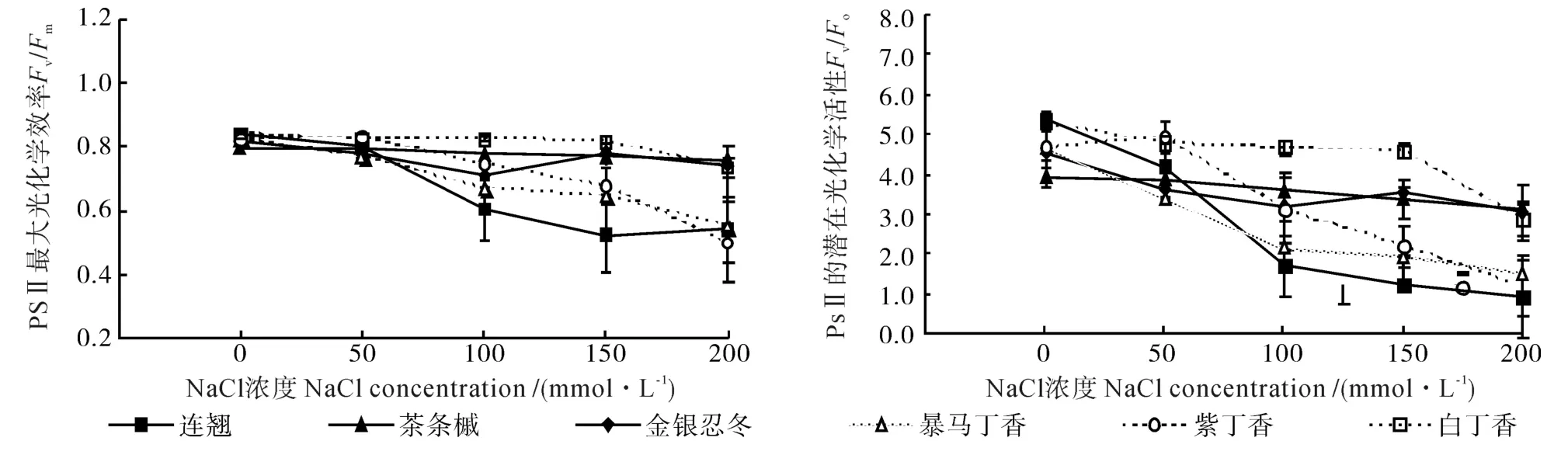
圖1 NaCl脅迫對6個灌木樹種葉片PSⅡ反應中心最大光化學效率(Fv/Fm)和潛在光化學活性(Fv/Fo)的影響Fig.1 Effects of NaCl stress on maximum photochemical efficiency (Fv/Fm) and potential photochemical activities (Fv/Fo)of PSⅡ in leaves of six kinds of shrubs
2.2 鹽脅迫對6個灌木樹種葉片光合電子傳遞鏈上QA-氧化還原狀態的影響
NaCl脅迫對6個灌木樹種葉片QA-氧化還原狀態的影響情況如圖2所示。從圖2中可以看出,當鹽濃度在0~50 mmol·L-1時,6個灌木樹種葉片的VJ和Mo值均無明顯的變化,而當鹽濃度大于50 mmol·L-1時,不同樹種葉片的VJ和Mo值的變化趨勢明顯不同,但隨鹽濃度的增加均呈增加趨勢。當鹽濃度大于100 mmol·L-1時,隨著鹽濃度的增加,連翹、紫丁香和暴馬丁香的VJ和Mo值均呈現出明顯的上升趨勢,而金銀忍冬的VJ和Mo值均無明顯的變化,茶條槭的VJ值無明顯變化,而其Mo值卻緩慢上升。白丁香的VJ和Mo值在鹽濃度小于150 mmol·L-1時與金銀忍冬和茶條槭的相似,沒有發生明顯的變化,而在鹽濃度大于150 mmol·L-1時卻顯著上升。
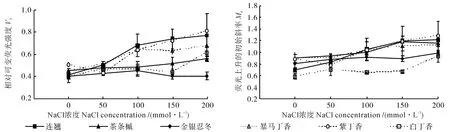
圖2 NaCl脅迫對6個灌木樹種葉片QA- 氧化還原狀態的影響Fig.2 Effect of NaCl stress on QA- redox state in leaves of six kinds of shrubs
2.3 鹽脅迫對6個灌木品種葉片PSⅡ反應中心吸收光能分配參數的影響
NaCl脅迫對6個灌木樹種葉片PSⅡ反應中心吸收光能量分配參數的影響情況如圖3所示。由圖3可知,隨著鹽濃度的增加,6個灌木樹種葉片的OJIP曲線上2 ms時有活性反應中心的開放程度(Ψo)降低,葉片的原初光化學反應的最大量子產額(φPo)和用于電子傳遞的量子產額(φEo)均降低,而用于熱耗散的比例(φDo)卻增加。當鹽濃度在0~50 mmol·L-1時,6個灌木樹種葉片的Ψo、φPo、φEo和φDo值均沒有發生明顯的變化;當鹽濃度大于50 mmol·L-1時,連翹、紫丁香和暴馬丁香這3種樹種葉片的Ψo、φPo和φEo值均隨著鹽濃度的增加而明顯降低,而金銀忍冬和茶條槭的Ψo、φPo和φEo各參數的變化趨勢均不明顯,白丁香葉片的以上各參數在鹽濃度超過150 mmol·L-1時才會發生明顯的變化。
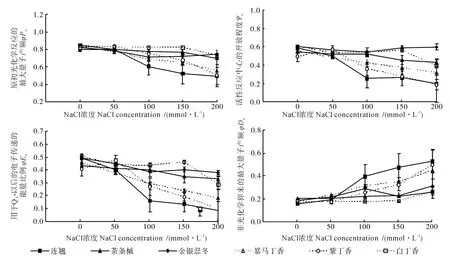
圖3 NaCl脅迫對6個灌木樹種葉片PSⅡ反應中心吸收光能分配參數的影響Fig.3 Effect of NaCl stress on the distribution parameters of PSⅡ light energy absorption in leaves of six kinds of shrubs
2.4 鹽脅迫對6個灌木品種葉片單位PSⅡ反應中心比活參數的影響
NaCl脅迫對6個灌木樹種葉片ABS/RC、TRo/RC、ETo/RC和DIo/RC值的影響情況如圖4所示。由圖4可知,當鹽濃度在0~50 mmol·L-1時,6個灌木樹種葉片PSⅡ反應中心的比活參數無明顯變化;當鹽濃度大于50 mmol·L-1時,天線色素吸收的能量ABS/RC和用于熱耗散的能量DIo/RC均呈上升趨勢,其中茶條槭和金銀忍冬變化不明顯;連翹葉片單位反應中心捕獲的用于還原QA的能量TRo/RC在鹽濃度逐漸升高時卻呈下降趨勢,而其他品種均無明顯的變化趨勢;當鹽濃度大于50 mmol·L-1時,隨著鹽濃度的增加,6個樹種葉片吸收光能用于電子傳遞的能量ETo/RC均明顯減少,其中金銀忍冬和茶條槭的變化趨勢均不明顯,而連翹和紫丁香的降低幅度均較大。
2.5 鹽脅迫對6個灌木品種光系統Ⅱ耐鹽性的綜合評價
植物的耐鹽性是一種復雜的生理反應,利用單一指標鑒定植物耐鹽性的局限性很大。因此,在對植物耐鹽性的研究中,往往采用多指標進行綜合評判。本試驗為了較全面地評價6個灌木樹種PSⅡ功能的耐鹽性,采用模糊數學中的隸屬函數法,根據隸屬函數總值的大小對6個灌木品種葉片PSⅡ反應中心能力進行排序,得到6個灌木樹種PSⅡ功能的耐鹽性由強到弱的順序為:金銀忍冬>茶條槭>白丁香>暴馬丁香>連翹>紫丁香。
3 討 論
鹽脅迫主要包括離子毒害和離子吸收不平衡即營養虧缺[13],許多研究結果已經表明,鹽脅迫使植物的生長受到抑制,能耗增加,衰老加速,生長量降低[14],鹽脅迫抑制植物光合碳同化過程而產生過剩激發能,進而能夠直接或間接地影響植物PSⅡ的功能[15]。試驗中發現,在低濃度的鹽(Na+濃度為0~50 mmol·L-1)脅迫下,6個灌木品種的各個葉綠素熒光參數均無明顯變化。當鹽濃度大于50 mmol·L-1時,各品種灌木的最大光化學效率Fv/Fm和潛在光化學活性Fv/Fo均有不同程度的降低,但不同樹種的變化程度不同,金銀忍冬和茶條槭的降低幅度最小,說明這兩種樹的PSⅡ對鹽脅迫的抵抗能力最強,而連翹、紫丁香和暴馬丁香PSⅡ的耐鹽性均較差,白丁香在低于150 mmol·L-1的鹽脅迫下可以保持較高的PSⅡ反應中心活性,而當鹽濃度大于150 mmol·L-1時其PSⅡ反應中心的活性才會明顯降低。鹽脅迫會使光合電子傳遞鏈上的電子傳遞受阻,特別是電子從QA-到QB過程是最為敏感的環節之一[16],試驗中發現,鹽濃度逐漸升高時,6個樹種葉片2 ms時的相對可變熒光強度VJ和QA被還原的最大速率Mo值均呈明顯增加的趨勢,表明了QA-明顯積累,由此推測,鹽脅迫可能抑制了電子從QA-到QB的傳遞,會使單位反應中心捕獲的用于電子傳遞的能量下降,從而使2 ms時有活性的反應中心的開放程度降低,說明鹽脅迫抑制了PSⅡ受體側QA向QB的電子傳遞,
其原因可能是鹽脅迫導致QB位點改變從而降低了其與質體醌結合的親和力。當鹽溶液濃度大于100 mmol·L-1時,隨著鹽濃度的增加,連翹、紫丁香和暴馬丁香的VJ和Mo值均呈現出明顯的上升趨勢,而金銀忍冬的VJ和Mo值均無明顯變化,說明鹽脅迫對金銀忍冬PSⅡ電子受體側的電子傳遞的影響較小,而對連翹、紫丁香和暴馬丁香的傷害較大,白丁香在鹽濃度大于150 mmol·L-1時其PSⅡ電子受體側的電子傳遞才會受到明顯的抑制。
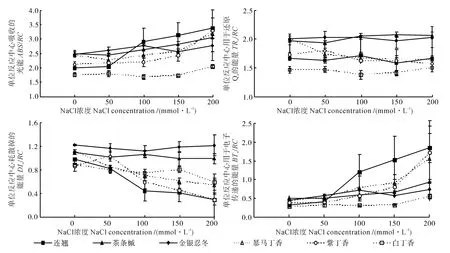
圖4 NaCl脅迫對6個灌木樹種葉片ABS/RC、TRo/RC、ETo/RC和DIo/RC值的影響Fig.4 Effect of NaCl stress on ABS/RC,TRo/RC,ETo/RC and DIo/RC in leaves of six kinds of shrubs
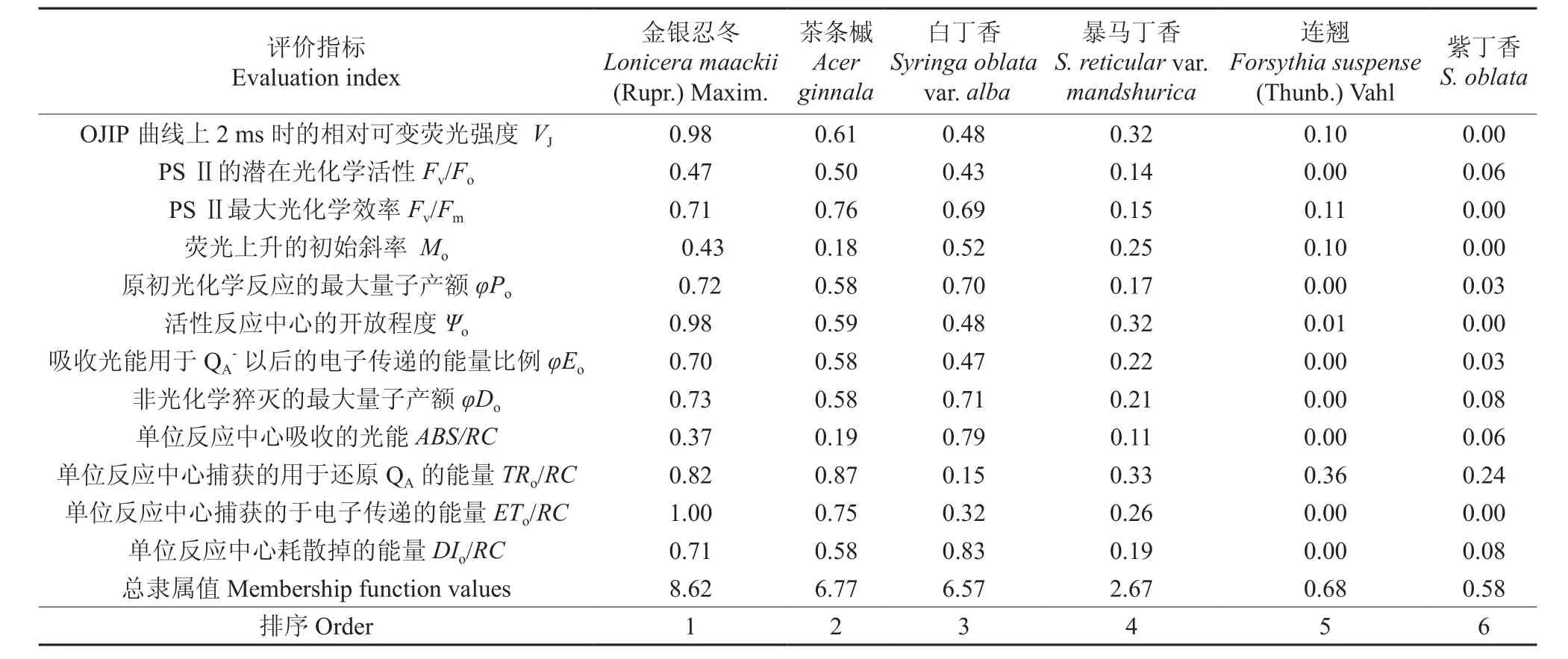
表1 NaCl脅迫下6個灌木品種的光系統Ⅱ耐鹽性各指標的隸屬函數值Table 1 Membership function values of salt tolerance of photosystem Ⅱ in leaves of six kinds of shrubs under NaCl stress
正常條件下有活性的 PSⅡ反應中心能將捕獲的光能轉化為化學能用于碳代謝中光化學反應途徑,而將剩余的激發能耗散掉[17]。在本研究中發現,鹽濃度逐漸升高時,6個樹種葉片的φPo值均降低,而其φDo和DIo/RC值均增加,其φEo和ETo/RC值均減少,說明鹽脅迫明顯改變了6個樹種PSⅡ反應中心吸收光能的分配情況,在較高濃度的鹽脅迫下,連翹、紫丁香和暴馬丁香3個樹種葉片的φPo、φEo和ETo/RC值隨著鹽濃度的增加而降低的趨勢均明顯大于金銀忍冬和茶條槭,而其φDo和DIo/RC值均呈相反的變化趨勢,說明在較高濃度的鹽脅迫下,金銀忍冬和茶條槭可以保證PSⅡ反應中心吸收的光能優先分配到光合電子傳遞鏈中,以保證同化力(ATP和NADPH)的積累。隨著鹽濃度的增加,6個樹種葉片有活性的反應中心的開放程度Ψo下降,有關研究者發現,逆境下PSⅡ反應中心會發生可逆失活,并且這些失活的反應中心只是作為一個能量陷阱,只吸收光能但不能將吸收的光能傳遞到電子傳遞鏈中,以防止過剩光能產生激發而誘導活性氧的爆發[18]。本試驗中發現,單位反應中心吸收的光能ABS/RC明顯增加,這可能是由PSⅡ反應中心的活性和數量降低而造成的,從而增加了剩余反應中心的活性。
用單一指標評價植物的耐鹽性往往具有片面性,植物抗鹽機制是錯綜復雜的,是受植物多因素控制的[19]。在復合鹽脅迫下植物耐鹽性的綜合評定中,不能僅僅對單一指標進行分析,還需將各種指標值進行綜合分析,從而建立合適的數量化指標體系來進行抗鹽堿脅迫的綜合評價。本研究中采用了Fuzzy數學隸屬函數綜合評判法,以12個葉綠素熒光參數為參考指標,對6種灌木光系統Ⅱ的耐鹽性進行了綜合評判,得出的6個灌木品種耐鹽性的高低順序為:金銀忍冬>茶條槭>白丁香>暴馬丁香>連翹>紫丁香。因此,在我國北方鹽濃度較高的鹽漬化地區進行城市綠化和植被恢復的過程中可以首先考慮金銀忍冬和茶條槭;而在鹽濃度低于150 mmol·L-1的鹽漬化地區,白丁香的光合特性反映了其具有很強的抗鹽能力,但連翹和紫丁香葉片的光合特性表現出其對鹽脅迫極為敏感,故在鹽漬化程度較高的地區種植時要慎重選用。
參考文獻:
[1]張會慧,張秀麗,李 鑫,等. NaCl和Na2CO3脅迫對桑樹幼苗生長和光合特性的影響[J].應用生態學報,2012,23(3):625-631.
[2]孫孟超,尹賾鵬,馬曉蕾,等.鹽脅迫對歐李幼苗生理響應及離子含量的影響[J].經濟林研究,2012,30(2): 33-37.
[3]陳健妙,鄭青松,劉兆普,等.兩種麻瘋樹苗對鹽脅迫的生理生態響應[J].生態學報,2010,30(4):933-940.
[4]Krause GH,Weis E. Chlorophyll fluorescence and photosynthesis:the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1991,42:319-349.
[5]Maxwell K,Johnson GN. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany,2000,51:659-668.
[6]Jiang CD,Gao HY,Zou Q. Changes of donor and accepter side in photosystem Ⅱ complex induced by iron deficiency in attached soybean and maize leaves [J]. Photosynthetia,41,267-271.
[7]張會慧,張秀麗,胡彥波,等.堿性鹽脅迫下桑樹幼苗葉片葉綠素熒光特性和激發能分配[J].經濟林研究,2012,30(1):12-17.
[8]張會慧,張秀麗,許 楠,等.外源鈣對干旱脅迫下烤煙幼苗光系統Ⅱ功能的影響[J].應用生態學報,2011,22(5):1195-1200.
[9]趙紅洋,陳 莉.鹽分脅迫對5種園林灌木生理生化指標的影響[J].草原與草坪,2012(3): 7-14.
[10]苑增武,張孝民,毛齊來,等.大慶地區主要造林樹種耐鹽堿能力評價[J].防護林科技,2000,(1): 15-16.
[11]張華新,宋 丹,劉正祥.鹽脅迫下11個樹種生理特性及其耐鹽性研究[J].林業科學研究,2008,21(2): 168-175.
[12]李 斌,劉立強,羅淑萍,等.扁桃花芽的抗寒性測定與綜合評價[J].經濟林研究,2012,30(3): 16-21.
[13]Akita S,Cabusla YGS. Physiological basis of differential response to salinity in rice cultivars [J]. Plant Soil,2000,123:277-294.
[14]劉友良,毛才良,汪良駒. Recent progress in studies on salinity tolerance in plants[J].植物生理學通訊,1987,23(4): 1-7.
[15]孫廣玉,侯 晨.鹽堿土條件下馬藺幼苗滲透調節物質和光合特性對干旱的響應[J].水土保持學報,2008,22(2):202-205.
[16]張會慧,張秀麗,朱文旭,等.桑樹葉片光系統Ⅱ對NaCl 和Na2CO3脅迫的響應[J].北京林業大學學報,2011,33(6):15-20.
[17]Strasser RJ,Srivastava A,Govindjee. Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria [J].Photochemistry and photobiology,1995,61: 32-42.
[18]夏建榮,鄒定輝.利用OJIP葉綠素a熒光評估干出對石莼(Ulva lactuca)光系統Ⅱ的影響[J].海洋通報,2007,26(4): 50-55.
[19]Foolad MR,Jones RA. Mapping salt-tolerance genes in tomato using trait-based marker analysis [J]. Theor Appl Genet,1993,87: 184-192.

