添加外源纖維水解酶對羊草體外瘤胃發酵酶活性及特性的影響
莊蘇,丁立人,周建國,王恬
(南京農業大學動物科技學院,江蘇 南京210095)
在反芻動物生產中,有關外源酶制劑應用一直存在著不少爭議。因為瘤胃內蛋白質水解菌能分解外源酶(如植物細胞壁水解酶類)而使之失活[1],同時瘤胃微生物能分泌蛋白酶、淀粉酶、纖維素酶等多種酶類,并且各種酶活性很高[2],因此無需額外添加外源酶制劑。但是,隨著酶制劑技術的發展,人們除了重視外源酶在單胃動物生產中應用研究外也開始關注外源酶制劑在反芻動物生產中的應用研究。研究表明,某些纖維素酶、半纖維酶與蛋白酶一起培養時能保持穩定酶活,并在瘤胃內穩定生存[3];外源酶制劑能夠增加瘤胃微生物在飼料顆粒上的附著并增加飼料降解率[4];Morgavi等[5]發現由長梗木霉(Trichodermalongibrachiatum)產生的酶能與瘤胃內酶一起協同地從玉米(Zeamays)青貯中釋放更多的還原糖;同樣外源纖維水解酶能改善動物生產性能[6,7]。即便如此,外源酶制劑在反芻動物生產應用研究還不夠深入,對其作用機理認識還不夠全面。就目前研究現狀而言,更多研究集中在外源酶制劑如何處理粗飼料(如作為青貯飼料添加劑)上[8,9],有關外源酶制劑的處理時間、添加劑量以及外源酶對內源酶活性的影響研究相對較少,國內在這方面研究僅處于起步階段。本試驗以羊草為底物,利用體外法研究不同劑量纖維酶與木聚糖酶、不同處理時間與瘤胃液共培養對發酵液中纖維素酶與葡聚糖酶活性與發酵特性的影響,旨在為豐富外源纖維水解酶在反芻動物中的應用提供一些理論依據。
1 材料與方法
1.1 試驗材料與時間
酶制劑為國產纖維素酶(40 000U/g)與木聚糖酶(42 000U/g)產品。使用時,用去離子水配制成各含10與50mg/mL纖維素酶與木聚糖酶混合酶液。發酵底物為羊草(Aneurolepidiumchinense)草粉。試驗于2009年10月在南京農業大學動物科技學院反芻動物營養研究室進行。
1.2 瘤胃液采集
選取5只體況良好、體重35~40kg裝有永久瘤胃瘺管的本地閹割山羊用于瘤胃液供體。試驗羊圈養,適量補飼精料(玉米∶豆粕=7∶3),自由采食青干草與飲水。瘤胃液采集當日,在飼喂后2h,經瘤胃瘺管分別從5頭山羊的瘤胃腹囊下部抽取含內容物的瘤胃液,放入經39℃預熱并充滿CO2的保溫瓶中,立即返回實驗室,用4層紗布分離內容物,濾液作為混合瘤胃微生物接種物,整個過程在厭氧條件下進行。
1.3 緩沖液制備
緩沖液參照Russel和Martin[10]的配方制備。將緩沖液裝入廣口瓶中,加入1%刃天青數滴,通CO2直至緩沖液呈無色為止,此時表示已達到厭氧條件。
1.4 接種液配制
將緩沖液預熱至39℃,在厭氧條件下按緩沖液與瘤胃液為4∶1(V/V)制備接種液。制備完成后立即使用。
1.5 試驗設計
試驗共設6組。分組如下:24h酶處理組,分別稱取2.0g羊草裝入150mL發酵瓶內,然后用注射器在羊草上均勻地噴灑含酶劑量為0,10.0與50.0mg/mL酶液1mL,3組分別標記為24-0,24-10與24-50,并置于20℃培養箱中處理24h后,向瓶內注入CO2排除空氣,接著向瓶內加入預熱至39℃接種液50mL,整個過程伴隨CO2通入以維持厭氧條件,分裝完畢后迅速蓋上異丁基橡膠塞密封,并以鋁蓋固定封口,最后置于39℃下培養。另3組為0h酶處理組:在裝入2.0g羊草瓶內均勻地噴灑酶劑量為0,10.0與50.0mg/mL酶液1mL,3組分別標記為0-0,0-10與0-50,通入CO2后直接加入接種液,余下操作同24h處理組。每組設3個重復。
1.6 樣本采集與處理
在4,6,8,12,24,36,48h培養時間點分別從每組中取出3個發酵瓶用氣壓轉換儀測定產氣量并計算累積產氣量,同時對其他發酵瓶進行放氣處理,所有操作過程均在39℃條件下進行。在0(接種后立即采樣),8,24,48h培養時間點分別從每組中取出3個發酵瓶,打開瓶蓋立即測定發酵液pH值,然后將發酵瓶內全部內容物倒入尼龍袋(200目,孔徑0.074mm)分離發酵液與內容物。發酵液分裝于3個10mL離心管中,置于-20℃冰柜中用于后期酶活性與揮發性脂肪酸(VFA,volatile fatty acid)測定。每次取樣后該時間點發酵瓶棄用。
1.7 樣品測定與方法
分別以濃度為20mg/mL的燕麥木聚糖(X-0627購自Sigma)、羧甲基纖維素鈉(國產)與Avicel PH101(購自Fluka)溶液用于木聚糖酶、內切葡聚糖酶與外切葡聚糖酶酶活測定底物。在pH 6.0和50℃條件下反應30min測定酶活力[11]。酶活(U)定義為此測定條件下1min內釋放1nmol的木糖或葡萄糖所需的酶量為1個酶活單位。
島津GC-14B氣相色譜儀測定VFA含量[12]并略作改進。
1.8 數據處理
試驗數據經Excel 2003初步整理后,采用SPSS 13.0統計軟件中GLM模塊中Multivariate進行方差分析,檢驗預處理時間、酶劑量、預處理時間與酶劑量間的互作效應。對同一時間點數據采用One-way ANOVA中Duncan’s法進行多重比較,顯著水平置于0.05。結果用平均數與平均標準誤表示。
2 結果與分析
2.1 纖維水解酶對體外發酵液木聚糖酶活性的影響
在0h,酶量、處理時間顯著影響木聚糖酶酶活(P<0.05);兩者互作效應為0.092(表1)。在8h,酶量顯著影響木聚糖酶活性(P<0.05);高劑量酶組酶活均顯著高于其他處理組(P<0.05),而處理時間對酶活的影響不顯著(P=0.127),酶量與處理時間無互作效應。在24與48h,酶量與處理時間效應、酶量與處理時間互作效應均不顯著(P>0.05);但在24h,24h處理的高劑量組酶活高于無酶組與0h處理的高劑量組(P<0.05)。
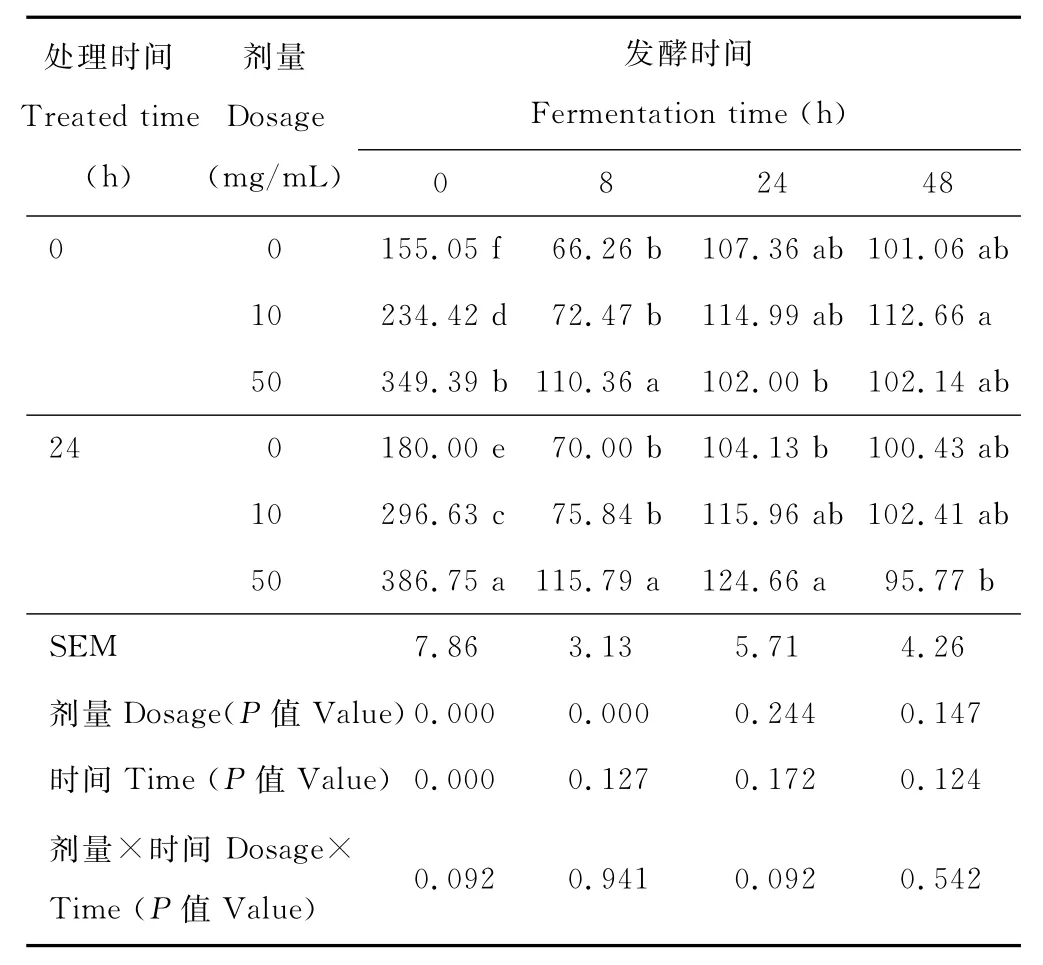
表1 纖維水解酶對體外發酵液中木聚糖酶活性的影響Table 1 Effect of the fibrolytic enzymes on xylanase activity in vitro nmol/(min·mL)
2.2 纖維水解酶對體外發酵液內切、外切葡聚糖酶活性的影響
在0與8h,酶量與處理時間均顯著影響內切葡聚糖酶活性(P<0.05)(表2);其中0h時間點,兩者存在互作效應(P<0.05);高劑量顯著增加內切葡聚糖酶活性(P<0.05)。與0h比較,8h內切葡聚糖酶活性大幅下降,下降幅度在65.52%~73.12%。當發酵至24與48h,酶量、預處理時間效應以及兩者間的互作效應均不顯著(P>0.05)。
在0h,酶量、處理時間顯著影響發酵液中外切葡聚糖酶活性 (P<0.05);劑量與處理時間具有一定的互作效應(P=0.06);24h酶處理組發酵液中外切葡聚糖酶活性顯著高于其他各組(P<0.05)。在發酵8h,僅處理時間對酶活性產生顯著影響(P<0.05)。發酵24與48h,酶量、處理時間及兩者間互作效應均不顯著 (P>0.05)。
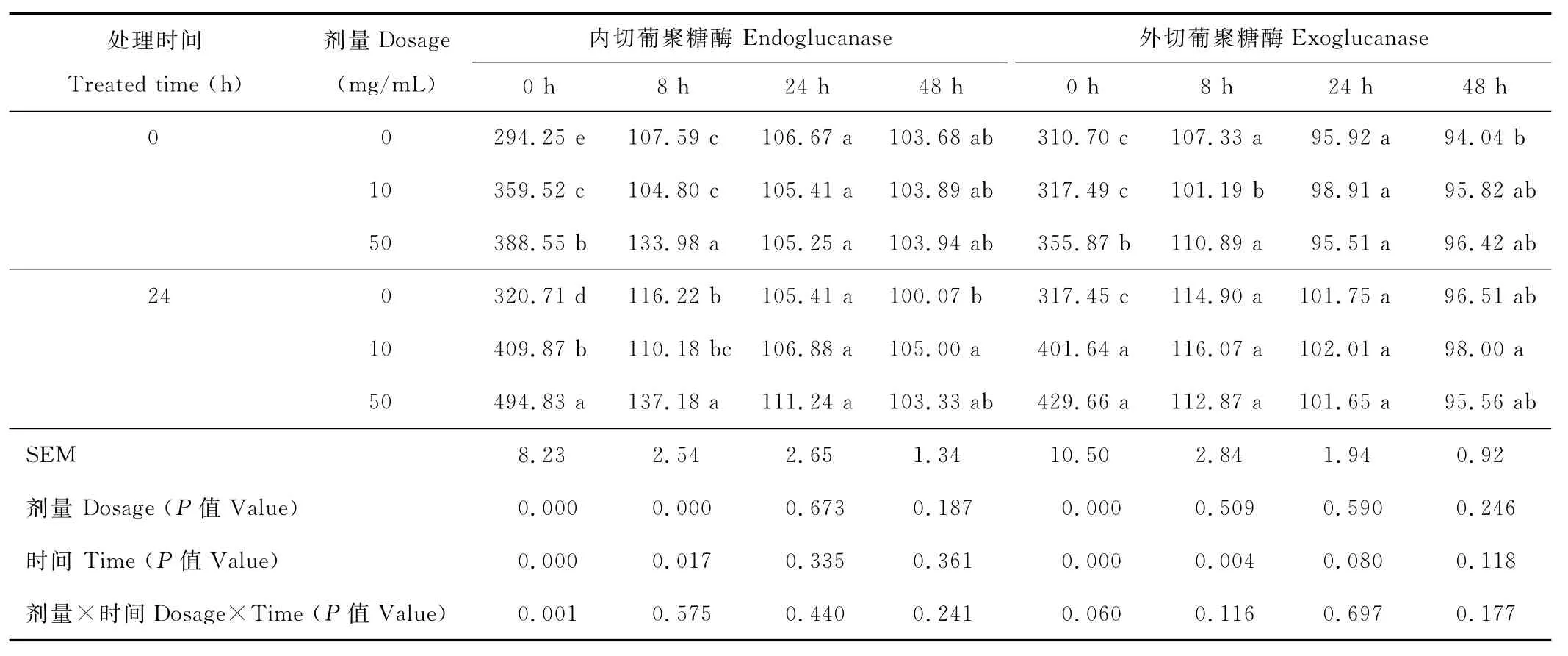
表2 纖維水解酶對體外發酵液中葡聚糖酶活性的影響Table 2 Effect of the fibrolytic enzymes on glucanase activity in vitro nmol/(min·mL)
2.3 纖維水解酶對體外發酵液揮發性脂肪酸含量的影響
在0h點,發酵液中乙酸含量在22.19~22.61mmol/L(表3),酶量、處理時間效應、酶量與處理時間互作效應對乙酸含量均無顯著影響(P>0.05)。當發酵至8h,外源酶具有增加乙酸含量作用的趨勢(P=0.091);而處理時間效應、酶劑量與處理時間互作效應不顯著(P>0.05)。在24與48h,添加酶劑量顯著增加發酵液中乙酸含量(P<0.05),50mg酶處理組均顯著高于無酶組(P<0.05);處理時間對乙酸產量沒有影響并且酶劑量與處理時間之間沒有互作效應(P>0.05)。
丙酸含量顯示,在0h,酶劑量、處理時間效應、酶劑量與處理時間互作效應均不顯著影響丙酸含量(P>0.05)。在8與24h,外源酶有增加發酵液中丙酸含量的趨勢并有劑量效應 (P=0.055與P=0.052)。發酵48 h,各組丙酸含量無顯著性差異(P>0.05)。
在8h,添加酶制劑顯著提高丁酸含量 (P<0.05)。在其他各時間點,酶劑量、處理時間效應及兩者的互作效應均不顯著(P>0.05)。
除0h外,添加外源酶顯著地增加總VFA含量(P<0.05),而處理時間效應、酶劑量與處理時間的互作效應不顯著(P>0.05)。
外源酶添加量與預處理時間并不影響發酵液中戊酸與異戊酸含量 (P>0.05)。
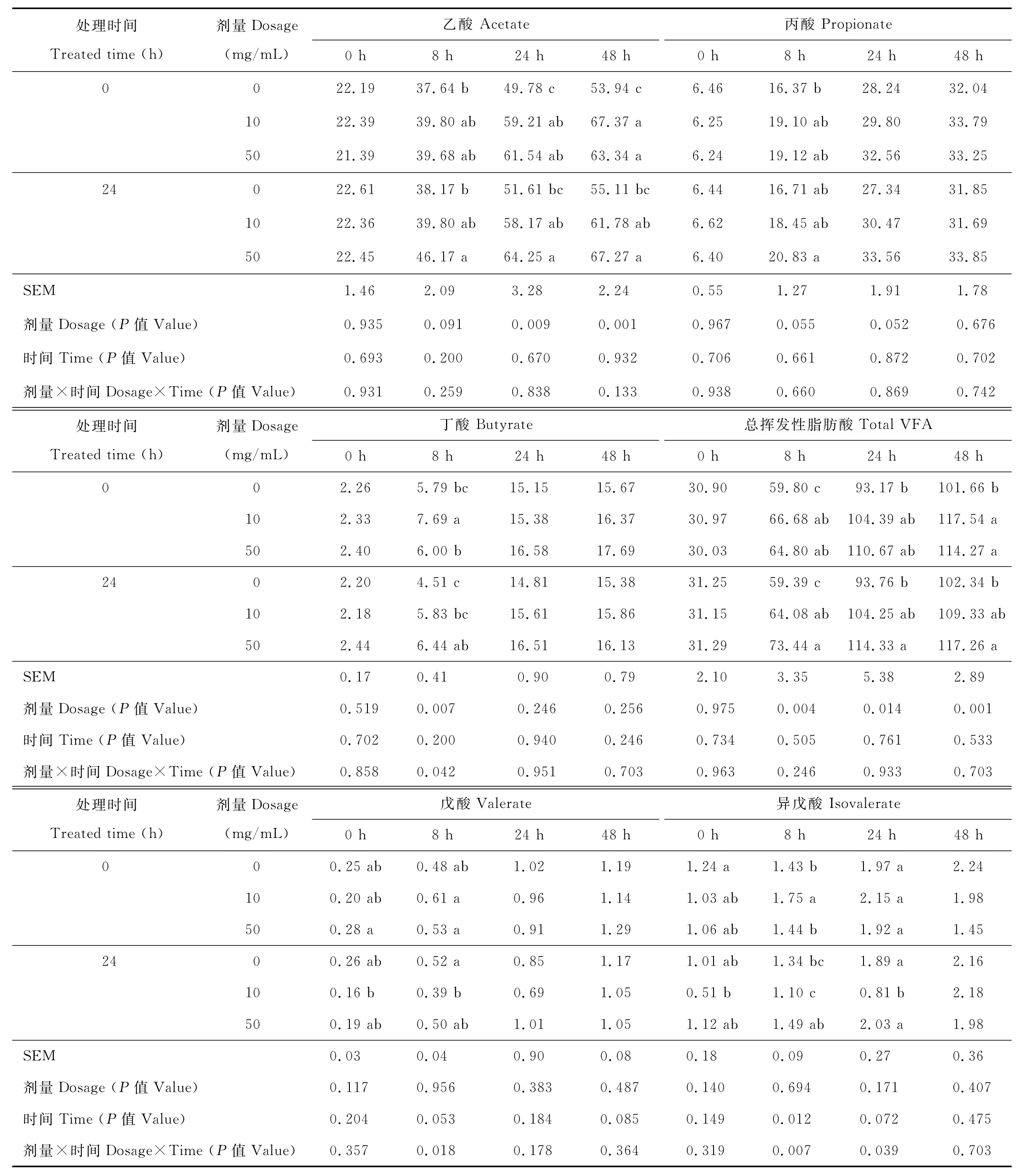
表3 纖維素水解酶對體外發酵液中VFA含量的影響Table 3 Effect of the fibrolytic enzymes on VFA content in vitro mmol/L
2.4 纖維水解酶對體外發酵體系中pH值與產氣量的影響
在發酵8與24h,酶劑量效應、酶劑量與處理時間互作效應顯著影響發酵液pH值 (P<0.05)(表4)。發酵結束時,處理時間顯著影響pH值(P<0.05)。產氣量分析,酶量、處理時間顯著影響48h累積產氣量(P<0.05),但兩者沒有互作效應(P=0.954)。
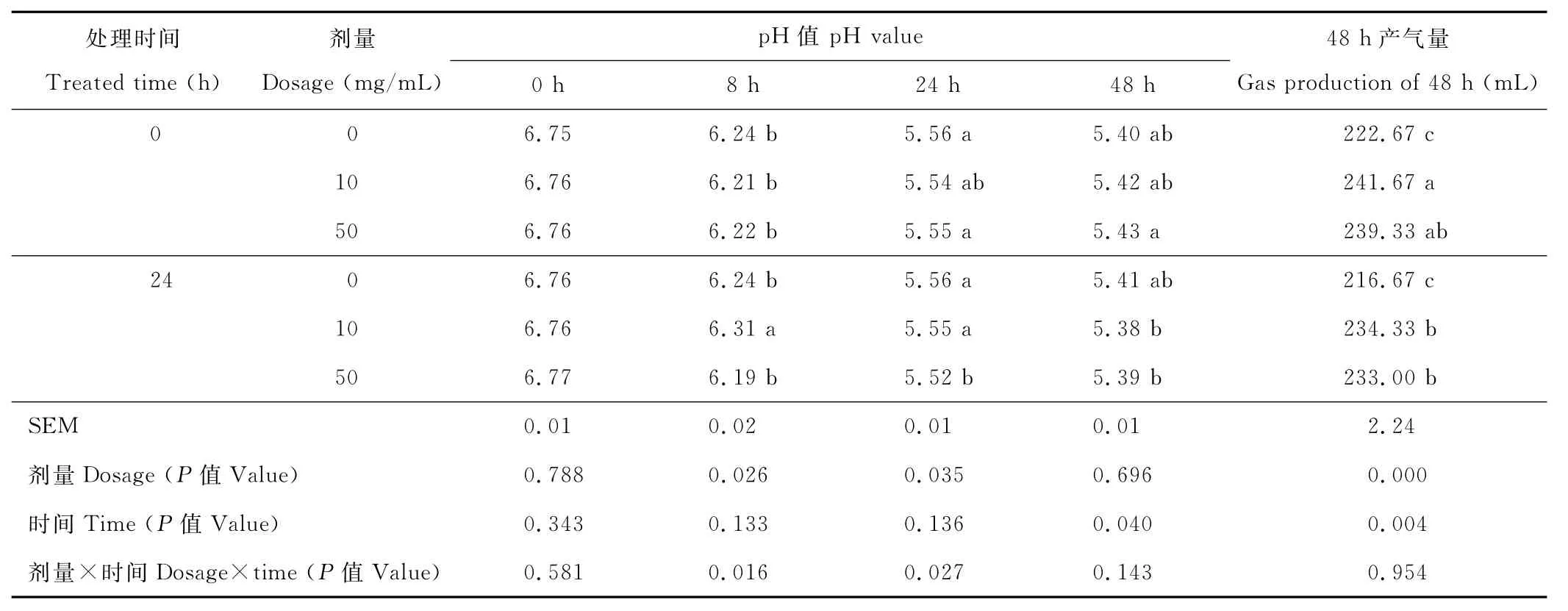
表4 纖維素水解酶對體外發酵體系中pH值與總產氣量的影響Table 4 Effect of the fibrolytic enzymes on pH value and cumulative gas production in vitro
3 討論
3.1 外源酶制劑對體外瘤胃發酵酶活的影響
在反芻動物日糧中添加外源酶制劑能夠增加飼料消化率和動物生產性能[13-15]。外源酶制劑作用機理歸類為3個方面:首先,采食前外源酶預處理飼料以增加底物消化率[16];其次,在瘤胃內外源酶直接或間接與瘤胃微生物協同作用分解飼料底物[5];第三,外源酶增強后段消化道的消化能力[17]。在反芻動物應用中,外源酶無論通過何種作用途徑產生效果,其關鍵點是外源酶能否抵抗瘤胃微生物降解。本研究發現,羊草經過0或24h混合酶處理后與瘤胃液共培養,在起始點,添加外源酶能顯著增加培養液中木聚糖酶、內切葡聚糖酶和外切葡聚糖酶活性,且效果與酶添加量、處理時間相關(P<0.05)。培養至8h,添加高劑量外源酶分別提高發酵液木聚糖酶與內切葡聚糖酶活性65%與20%,結果與在生長母牛瘤胃中直接投放多糖酶分別提高瘤胃內木聚糖酶與內切葡聚酶活性67%與20%[18]以及綿羊瘤胃液中內切葡聚酶活性51%與木聚糖酶活性34%[19]結果基本一致。隨著發酵時間延長(24或48h),外源酶作用效應消失。試驗結果與Colombatto等[20]發現的外源酶能增加早期(前6h)體外發酵液中木聚糖酶、內切葡聚糖酶及β-D-葡聚糖苷酶活性,但不能提高48h酶活性結果一致。綜合分析認為,在培養起始階段,由于添加外源酶,培養體系中葡聚糖酶與木聚糖酶瞬間得到提高;當培養到8h,添加外源酶也能增加培養體系纖維水解酶活性,這說明本次使用的外源酶制劑在一定時間內能抵抗微生物降解并保持活性。前人試驗證明木聚糖酶能夠抵抗蛋白酶的水解[21],纖維水解酶不被瘤胃微生物降解失活[22-24]。因此,本試驗結果與上述研究基本一致。除纖維水解酶外,外源蛋白酶也能增加瘤胃內木聚糖酶與內切葡聚糖酶活性,增加纖維素在瘤胃中降解[25]。由此可以得出,外源酶在反芻動物中應用是可行的。
3.2 外源酶制劑對體外瘤胃發酵揮發性脂肪酸含量的影響
為了獲得有效的飼料消化率,在動物采食前將飼料與酶進行預處理是必要的,但并非是必須的。Lewis等[16]試驗表明,外源纖維水解酶無論是采食前24h還是0h處理粗飼料,整個消化道干物質、中性洗滌纖維與酸性洗滌纖維消化率均顯著提高。在采食后16h,酶處理組瘤胃液中總揮發性脂肪酸含量顯著高于無酶組,但與酶處理時間關系不大。有人認為酶與飼料可形成一個穩定的酶-飼料復合體[7],改變植物纖維結構[26],繼而釋放更多的還原糖,有利于增加奶牛瘤胃中纖維二糖利用菌、木聚糖水解菌以及淀粉水解菌的數量[27],最終影響瘤胃發酵與產物的生成。Krzysztof和Magdalena[28]報道纖維水解酶能提高奶牛瘤胃液TVFA含量以及不同組分脂肪含量,但對乙酸丙酸比及各類型脂肪酸占總脂肪酸比例沒有影響。Giraldo等[29]體外試驗表明外源酶能顯著增加瘤胃中VFA產量(P<0.05),其中乙酸占到增加量50%。而Giraldo等[19]研究發現直接投飼外源纖維素酶并不影響綿羊瘤胃液中TVFA量,但是顯著提高丙酸的摩爾比例,降低乙酸與丙酸比(P<0.05)。綜合體內試驗[18,30,31]與體外試驗[32]研究結果,纖維水解酶對不同類型飼料可產生不同的VFA摩爾比例,日糧特性以及外源酶的類型均能影響瘤胃發酵類型。本研究發現,外源酶添加劑量直接影響培養液中VFA生成量,顯著影響24與48h發酵液中乙酸生成量及8,24與48hTVFA生成量(P<0.05),而VFA產量與酶處理時間關系不大。結果提示外源酶對乙酸的生成量影響程度遠高于對丙酸與丁酸生成程度,而對戊酸與異戊酸的含量沒有影響。分析原因這可能是添加外源酶后,增加前期發酵液中木聚糖酶與內切葡聚糖酶活性,有利于底物中半纖維素與纖維素的水解,從而增加了乙酸菌生長所需的底物,斷而增加乙酸產量。但是能否增加培養體系中乙酸菌數量還需進一步研究。從培養液pH值變化情況可知,pH值下降與培養液中VFA含量增加同步。
除酶活性與VFA產量等指標外,產氣量則是體外發酵程度的另一個重要指標。Wallace等[33]評價了2種商業纖維水解酶與瘤胃液共培養對玉米青貯與牧草青貯發酵特性的影響,結果顯示,在前8h發酵期,外源酶線性地增加產氣量。Tang等[34]試驗表明纖維水解酶與酵母發酵物能夠改善谷物秸稈的發酵過程,酵母培養物顯著地增加累積產氣量,纖維水解酶則傾向增加累積產氣量。本試驗結果也表明,添加外源酶能夠顯著地提高最終累積產氣量,且產氣量與外源酶添加劑量呈顯著相關。結合酶活性與VFA產量結果分析,可以推測由于外源纖維水解酶添加增加培養液中纖維水解酶活性,從而加速底物的水解速度,繼而增加培養液中還原糖生成量,這為瘤胃微生物提供更好營養源,最終結果是增加了培養體系中總VFA產量。
4 結論
用外源纖維水解酶處理羊草后與瘤胃液共培養能夠顯著地提高發酵早期(前8h)反應體系中木聚糖酶、內切葡聚糖酶與外切葡聚糖酶活性,提高反應體系中VFA產量以及改善瘤胃發酵特性。
[1] 刁其玉.酶制劑在反芻動物日糧中應用研究進展[J].飼料與畜牧,2010,3:15-17.
[2] 馮仰廉.反芻動物營養學[M].北京:科學出版社,2004:2-64.
[3] Hristov A N,McAllister T A,Chen K J.Stability of exogenous polysaccharide-degrading enzymes in the rumen[J].Animal Feed Science and Technology,1998,76:161-168.
[4] Yang W Z,Beauchemin K A,Rode L M.Effects of an enzyme feed additive on extent of digestion and milk production of lactating dairy cows[J].Journal of Dairy Science,1999,82(2):391-403.
[5] Morgavi D P,Beauchemin K A,Nsereko V L,etal.Synergy between ruminal fibrolytic enzymes and enzymes fromTrichodermalongibrachiatum[J].Journal of Dairy Science,2000,83(6):1310-1321.
[6] Beauchemin K A,Rode L M,Sewalt V J H.Fibrolytic enzymes increase fiber digestibility and growth rate of steers fed dry forages[J].Canada Journal of Animal Science,1995,5:641-644.
[7] Kung L J,Treacher R J,Nauman G A,etal.The effect of treating forages with fibrolytic enzymes on its nutritive value and lactation performance of dairy cows[J].Journal of Dairy Science,2000,83(1):115-122.
[8] 陳鑫珠,莊益芬,張建國,等.生物添加劑對水葫蘆與甜玉米秸稈混合青貯品質影響[J].草業學報,2011,20(6):195-202.
[9] Colombatto D,Mould F L,Bhat M K,etal.Invitroevaluation of fibrolytic enzymes as additives for maize(ZeamaysL.)silage II.Effects on rate of acidification,fibre degradation during ensiling and rumen fermentation[J].Animal Feed Science and Technology,2004,111:129-143.
[10] Russel J B,Martin S A.Effects of various methane inhibitors on the fermentation of amino acids by mixed rumen microorganismsinvitro[J].Journal of Animal Science,1984,59:1329-1338.
[11] Wood T M,Bhat M K.Methods for Measuring Cellulase Activities.Methods in Enzymology[M].In:Wood W A,Kellogg S T.London,UK:Academic Press Inc.,1988:87-111.
[12] 秦為琳.應用氣相色譜測定瘤胃液揮發性脂肪方法的研究改進[J].南京農學院學報,1982,4:110-116.
[13] Arriola K G,Kim S C,Staples C R,etal.Effect of fibrolytic enzyme application to low-and-concentrate diets on the performance of lactating dairy cattle[J].Journal of Dairy Science,2011,94(2):832-841.
[14] Arriola K G,Adesogan A T,Kim S C,etal.Effect of fibrolytic enzyme application to diets differing in concentrate proportion on the performance of lactating dairy cattle[J].Journal of Animal Science,2007,85(Suppl 1):304.
[15] House B P,Holden L,Varga G A.Effects of Bovazyme WPTMon microbil efficiency and metabolism in contunousculture of remen contents[J].Journal of Animal Science,2007,85(Suppl 1):301.
[16] Lewis G E,Hunt C W,Sanchez W K,etal.Effect of direct-fed fibrolytic enzymes on the digestive characteristics of a forage-based diet fed to beef steers[J].Journal of Animal Science,1996,74(12):3020-3028.
[17] Beauchemin K A,Yang W Z,Rode L M.Effects of grain source and enzymen additive on site and extent of nutrient in dairy cows[J].Journal of Dairy Science,1999,82(2):378-390.
[18] Hristov A N,McAllister T A,Cheng K J.Intraruminal supplementation with increasing levels of exogenous polysaccharidedegrading enzymes:Effects on nutrient digestion in cattle fed a barley grain diet[J].Journal of Animal Science,2000,78:477-487.
[19] Giraldo L A,Tejido M L,Ranilla M J,etal.Influence if direct-fed fibrolytic enzymes on diet digestibility and ruminal activity in sheep fed a grass hay-based diet[J].Journal of Animal Science,2008,86(7):1617-1623.
[20] Colombatto D,Mould F L,Bhat M K,etal.Influence of fibrolytic enzymes on the hydrolysis and fermentation of pure cellulose and xylan mixed ruminal microorganismsinvitro[J].Journal of Animal Science,2003,81(4):1040-1050.
[21] Fontes C M,Hall J G A,Hirst B H,etal.The resistance of cellulases and xylanases to proteolytic inactivation[J].Applied Microbiology and Biotechnology,1995,43(1):52-57.
[22] Hirstov A,McAllister T A,Cheng K J.Effect of dietary or abomasal supplementation of exogenous polysaccharide-degrading enzymes on rumen fermentation and nutrient digestibility[J].Journal of Animal Science,1998,76(12):3146-3156.
[23] Morgavia D P,Newbold C J,Beever D E,etal.Stability and stabilization of potential feed additive enzymes in rumen fluid[J].Enzyme and Microbial Technology,2000,26(2-4):171-177.
[24] Morgavi D P,Beauchemin K A,Nsserko V L,etal.Resistance of feed enzymes to proteolytic inactivation by rumen microorganisms and gastrointestinal enzymes[J].Journal of Animal Science,2001,79(6):1621-1630.
[25] Eun J S,Beauchemin K A.Effects of a proteolytic feed enzyme on intake,digestion,ruminal fermentation,and milk production[J].Journal of Dairy Science,2005,88(6):2140-2153.
[26] Nsereko V L,Morgavi D P,Rode M,etal.Effects of fungal enzyme preparations on hydrplysis and sybsequent degradation of alfalfa hay fiber by mixing rumen microorganisms in viro[J].Animal Feed Science and Technology,2000,88:153-170.
[27] Nsereko V L,Beauchemin K A,Morgavi D P,etal.Effect of a fibrolytic enzyme preparation fromTrichodermalongibrachiatumon the rumen microbial population of dairy cows[J].Canadian Journal of Microbiology,2002,48(1):14-20.
[28] Krzysztof B,Magdalena L R.Effect of adding fibrolytic enzymes to dairy cow rations on digestive activity in the rumen[J].Annals of Animal Science,2010,10(2):127-137.
[29] Giraldo L A,Tejido M L,Ranilla M J,etal.Effects of exogenous cellulase supplementation on microbial growth and ruminal fermentation of a high-forage diet in Rusitec fermenters[J].Journal of Animal Science,2007,85:1962-1970.
[30] Pinos-Rodriguez J M,Gonzalez S S,Mendoza G D,etal.Effect of exogenous fibrolytic enzyme on ruminal fermentation and digestibility of alfalfa and rye-grass hay fed to lambs[J].Journal of Animal Science,2002,80(11):3016-3020.
[31] Beauchemin K A,Colombatto D,Morgavi D P,etal.Use of exogenous fibrolytic enzymes to improve feed utilization by ruminants[J].Journal of Animal Science,2003,81(E.suppl.2):37-47.
[32] Wang Y,McAllister T A,Rode L M,etal.Effects of an exogenous enzyme preparation on microbial protein synthesis,enzyme activity and attachment to feed in the rumen simulation technique(Rusitec)[J].British Journal of Nutrition,2001,85:325-332.
[33] Wallace R J,Wallace S J A,McKain N,etal.Influence of supplementary fibrolytic enzymes on the fermentation of corn and grass silages by mixed ruminal micrioorganismsinvitro[J].Journal of Animal Science,2001,79(7):1905-1916.
[34] Tang S X,Yayo G O,Tam Z L,etal.Effects of yeast culture and fibrolytic enzyme supplementation oninvitrofermentation characteristic of low-quality cereal straws[J].Journal of Animal Science,2008,86(5):1164-1172.

