注射用頭孢曲松鈉的質量對比研究
賈國慧 呼海濤
(上海醫藥集團股份有限公司中央研究院 上海 201203)
注射用頭孢曲松鈉為第三代頭孢菌素類抗生素,大量用于臨床的抗菌治療,療效好副作用小,目前國內外有眾多企業生產,上海新亞藥業為其中之一。為提高產品質量、上海新亞藥業早在2009年即委托上海醫藥中央研究院對其自身產品、原研品及業內龍頭企業生產的頭孢曲松產品進行了全面深入的質量研究與評價,力求找出與同行企業間的質量差異,取長補短、精益求精。本研究采用上海新亞藥業(簡稱新亞)產品和本品原研企業(簡稱原研)市售樣品所開展的一系列質量對比研究。研究工作從物質基礎角度對可能影響產品療效與安全的相關指標進行了檢測與分析。
1 儀器與試藥
高效液相色譜儀(安捷倫1200)、液質聯用儀(THERMO LTQ)、旋光儀(魯道夫AOTO POLⅥ)、粒度分布儀(馬爾文Mastersizer 2000)、X-粉末衍射儀(Bruker D8 Advance XRD、RIGAKU/max 2550VB/PC)、差示掃描量熱儀(DSC Q2000)、元素分析儀(Elementar Vario EL Cube)等。
甲醇、乙腈(色譜純,Merck KGaA);純凈水[樂百氏(廣東)食品飲料有限公司];正辛胺(分析純,批號:O5802-100G,SIGMA);磷酸氫二鈉、磷酸二氫鈉(分析純,批號分別為:20101109和20040818,國藥集團化學試劑有限公司):藍色葡聚糖2000(批號:10012605,GE Healthcare);頭孢曲松對照品(批號:130480-200302,中國食品藥品檢定研究院);注射用頭孢曲松鈉樣品(上海新亞藥業,批號:100725;原研(市售),批號 :SH1259)。
2 方法與結果
2.1 有效性相關指標的比較
眾所周知,制劑有效性與其有效物質的含量息息相關,因此我們圍繞該指標,考察了兩企業樣品的原始含量、不同溶藥介質中的含量、藥品配置后不同放置時間對含量的影響以及輸液器過濾裝置對樣品量的影響。
2.1.1 含量測定
高效液相色譜法[1],固定相:Agilent C18柱(4.6 mm×150 mm,5 μm)。流動相:正辛胺溶液(0.02 mol/L)-乙腈=73:27,用磷酸調pH至6.5;流速:1.0 ml/min;檢測波長:254 nm;柱溫:25 ℃;進樣量:5 μl。
樣品配制:取本品約6.5 mg,精密稱定,至10 ml量瓶中,加流動相溶解并稀釋至刻度,搖勻,即得。
對照品配制方法:取頭孢曲松鈉對照品適量,同上制備。
測定結果表明新亞和原研企業生產的注射用頭孢曲松鈉產品,按無水物(C18H18N8O7S3)計,含量分別是84.94%和84.04%。測定結果無明顯差異。
2.1.2 臨床用藥穩定性與輸液器影響
為考察活性成分進入體內實際有效量的一致性,我們還對產品臨床使用中的各環節進行了研究。如樣品在常用稀釋液10%葡萄糖溶液中的穩定性、0.9%氯化鈉溶液中的穩定性,輸液器過濾前后濃度的一致性等,以避免因臨床用藥方式不同所帶來的療效差異[2-4]。
測定方法:稱取本品適量,分別用10%葡萄糖溶液、0.9%氯化鈉溶液溶解,測定過濾前后,峰面積的變化,并將過濾后樣品于0.5、1、2、4 h分別取樣測定,與過膜前樣品比較,觀察峰面積的變化。
計算公式:
過濾前后變化率=(過濾后峰面積-過濾前峰面積)/過濾前峰面積×100%
放置變化百分率=(取樣時間點峰面積-零時間點峰面積)/零時間點峰面積×100%
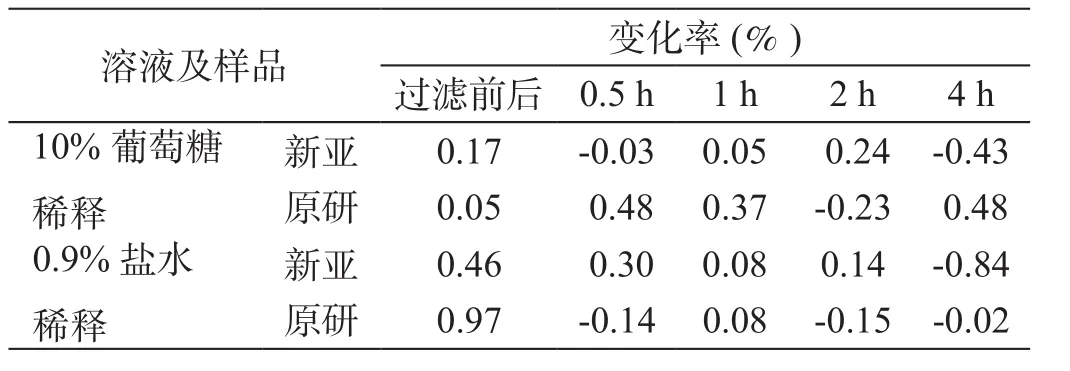
表1 稀釋劑、放置時間及過濾對本品有效量的影響
表1可見,臨床用藥過程中經常遇到的不同種類的樣品配置溶液、配置后放置時間、輸液器過濾膜對兩產品的有效樣品量影響,其波動均在±1%以內,可忽略。
上述結果表明兩產品用藥過程各因素對其有效劑量的影響可以忽略。
2.2 安全性相關指標的研究與對比
安全是藥品控制中最重要的考慮因素,除活性成分本身的特性影響外,雜質控制是安全性控制最重要的一環。本品根據其結構有機雜質控制主要包括有關物質、手性異構體、聚合物雜質這幾個方面。
2.2.1 有關物質
有關物質是雜質控制中最重要的控制手段,我們通過紫外、質譜兩種檢測器,對比了兩來源樣品的有關雜質分布,未見新亞樣品有需報告的雜質種類的不同,已有雜質的含量未見明顯高于原研品或超出標準規定。
采用高效液相色譜檢測,條件同2.1.1,流動相梯度洗脫見表2。

表2 有關物質流動相梯度表
供試品配制方法:取本品約6.5 mg,精密稱定,至10 ml量瓶中,加流動相溶解并稀釋至刻度,搖勻,即得。
對照品配制方法:精密量取上述供試品溶液1 ml,置100 ml量瓶中,用流動相稀釋至刻度,搖勻,即得。測定結果見表3。

表3 有關物質測定數據對比
作為HPLC-UV方法檢測有關物質的補充,我們同時開發了LC-MS方法,并對兩廠家樣品進行了檢測,測定結果顯示,新亞樣品與原研比對,在LC-MS譜圖上未見明顯的新增雜質,已有雜質的含量水平基本不高于原研品(圖2 A、B)。針對兩產品的質譜形貌,我們對正負離子模式下獲取的信息均進行了比對,確證了主成分正負離子模式的可靠性(圖2 C、D)。
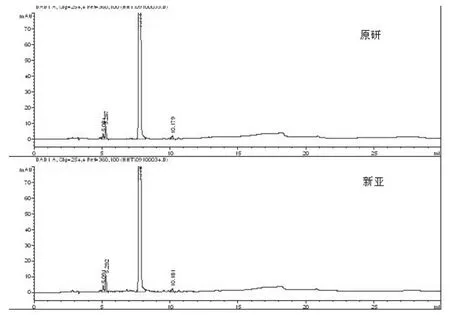
圖1 有關物質檢測圖(HPLC-UV)
2.2.2 聚合物雜質
聚合物雜質是抗生素類產品中容易產生的雜質,同時也經常與過敏等安全因素相關[5-6],因此我們對兩產品的聚合物雜質采用分子排阻色譜法進行了對比測定,測定結果無差異。
方法:采用高效液相分子排阻色譜法。
流動相A:0.1 mol/L磷酸鹽緩沖液[0.1 mol/L磷酸氫二鈉溶液-0.1 mol/L磷酸二氫鈉溶液(61:39),pH 7.0],流動相B:水,流速:1.5 ml/min,檢測波長:254 nm,進樣量 :100 μl。
對照品溶液的制備:取頭孢曲松對照品適量,精密稱定,加水溶解并定量稀釋成每ml約含0.1 mg的溶液。以流動相B進行測定。

圖2 LC-MS檢測雜質分布圖
供試品溶液的制備:取本品適量,精密稱定,加水溶解并定量稀釋成每ml約含20 mg的溶液。以流動相A進行測定。
限度與計算:按外標法以峰面積計,含頭孢曲松聚合物以峰面積計,不得過0.5%。
測定:經系統適用性評價后對新亞和原研頭孢曲松鈉的聚合物進行測定,結果分別為新亞樣品含0.39%、原研含0.32%,均符合中國藥典2010版規定(≤0.5%)。
2.2.3 比旋度與手性分析
頭孢曲松鈉結構中存在多個手性中心,為避免手性異構體雜質引起的實際有效性下降或安全風險增加,各國藥典在標準中都進行了考慮,其中中國藥典、日本藥典均采用比旋度進行控制[1,7]。美國藥典采用手性高效液相色譜法進行控制[8]。
我們在工作中,對比旋度和高效液相手性分離法都進行了考查,兩樣品比旋度測定數據均符合限度要求。采用美國藥典及其他多種手性固定相分析,均未檢測到其他構型的雜質。比旋度測定數據見表4,高效液相E型異構體檢測,未檢出E型異構體(圖3)。

表4 比旋度測定數據對比
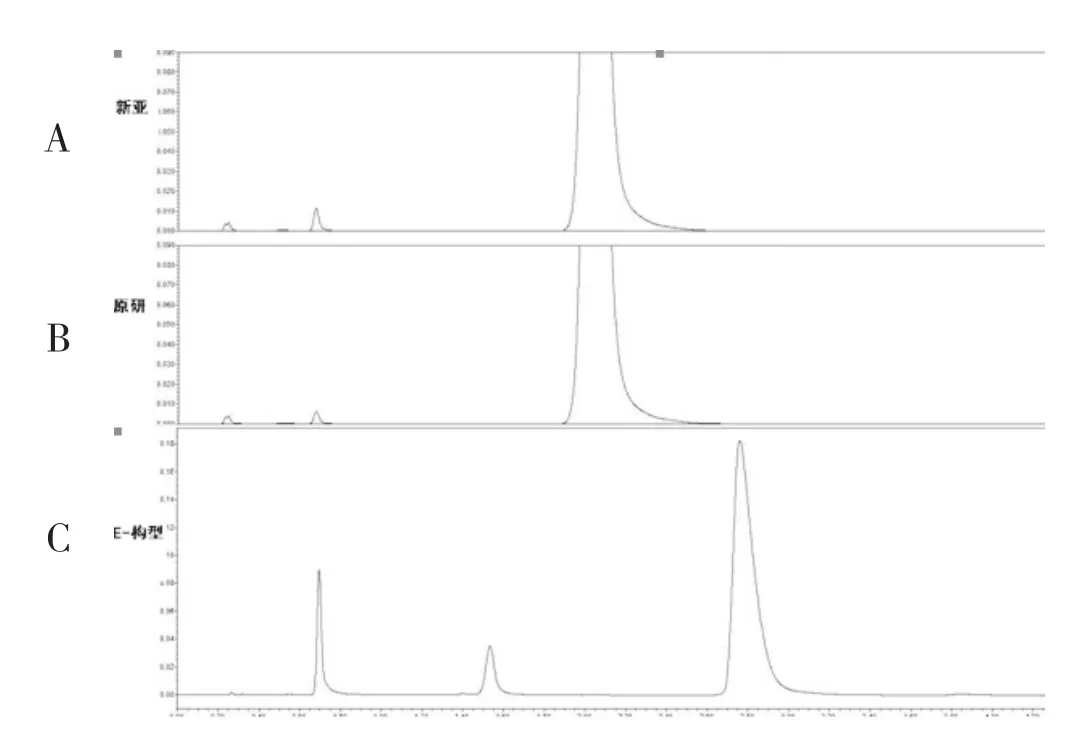
圖3 異構體雜質對比
上述有關物質、聚合物雜質、手性雜質的數據表明,兩產品在有機雜質水平上無明顯差異。
為從不同角度考察兩樣品純度、驗證樣品結構的正確性,我們對兩來源樣品進行了元素分析檢測(表5),其結果均與理論量一致(圖4)。
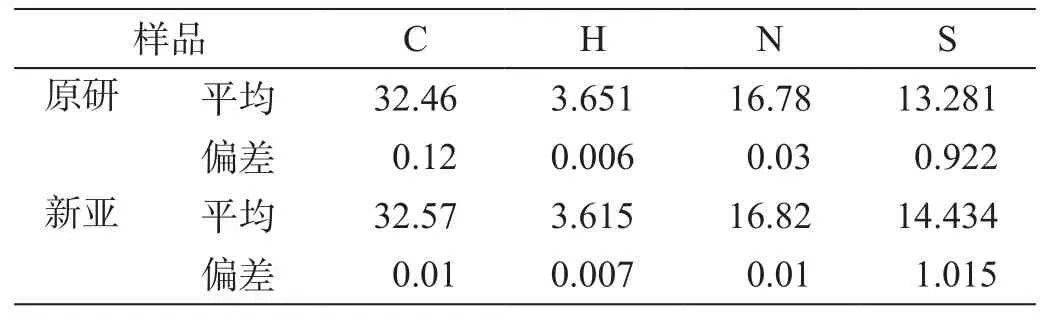
表5 元素分析測定數據(%)
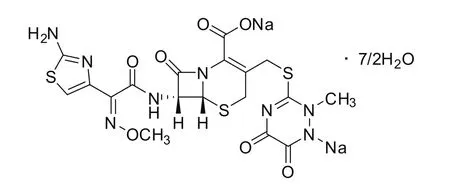
圖4 頭孢曲松鈉的化學結構和分子式
元素分析數據表明,兩樣品在主要元素的組成上,與理論量一致,進一步從元素組成上驗證了兩樣品的純度和結構的正確性。
2.3 理化相關指標的對比與分析
首先對兩樣品的溶解度、澄清度、酸堿度進行了考察[9-11]。
2.3.1 澄清度、酸堿度與溶解度
參照中國藥典pH測定、澄清度檢查及溶解度測定相關要求進行測定,兩樣品上述幾項指標的測定結果無明顯差異(表6)。

表6 澄清度、酸堿度、溶解度對比
2.3.2 粒度、結晶性與熱分析
從樣品理化特性差異對比的角度,我們還對兩樣品的粒度分布、X粉末衍射與差示掃描量熱的特性進行了對比。結果顯示原研樣品95%粒徑小于9.82 μm,新亞樣品95%粒徑小于51.84 μm。x-粉末衍射與DSC測定結果無明顯差異。
3 討論
本研究從探尋注射用頭孢曲松鈉國產仿制制劑與原研制劑物質基礎差異的角度出發,對上海新亞與原研注射用頭孢曲松鈉在含量、有關物質、異構體雜質、聚合物雜質、臨床用藥、理化特性等方面進行了對比研究。結果顯示,兩企業產品在我們所考慮到的影響其有效性、安全性相關的一系列指標上無明顯差異。粉末粒度分布的差異未影響產品宏觀溶解行為,應對產品的有效性與安全性無影響。
[1] 國家藥典委員會. 中華人民共和國藥典2010版(二部)[M].北京: 中國醫藥科技出版社, 2010: 181.
[2] 劉曉蘭, 李凌春, 周金彩. 頭孢曲松鈉與常用輸液配伍的穩定性[J]. 藥物研究, 2005, 2(20): 47.
[3] 鄭妍, 李廣乾, 劉敏. 頭孢曲松鈉在不同濃度氯化鈉、氯化鉀水溶液中的稀釋過程熱力學[J]. 聊城大學學報(自然科學版, 2013, 26(1): 57-64.
[4] 孫忠實, 朱珠. 頭孢曲松鈉與鈣劑配伍問題之釋疑[J]. 中國醫院用藥評價與分析, 2007, 7(2): 85-88.
[5] 任學毅, 李緒倫, 李寧, 等. 超聲處理對β-內酰胺類抗生素高分子雜質含量的影響[J]. 兒科藥學雜志, 2005, 15(1):38-40.
[6] 江曉玲, 劉昆, 鄧俊豐, 等. 頭孢菌素類抗生素中高分子雜質的研究進展[J]. 國外醫藥(抗生素分冊), 2007, 28(6):264-269.
[7] 日本厚生労働省. JP XVI[EB/OL]. [2013-06-03]. http://www. drugfuture. com/Pharmacopoeia/JP16/.
[8] The United States Pharmacopeial Convention. USP32-NF27[M]. Rockcille: The United States Pharmacopeial Convention, 2009: 1862.
[9] 李艷楓, 王晶. 頭孢曲松鈉生產工藝與色級的關系[J]. 黑龍江醫藥, 2010, 23(2): 203-205.
[10] 鄧凱順, 王鵬輝, 宋表, 等. 提高非無菌頭孢曲松鈉溶液澄清度的探討[J]. 河北醫科大學學報, 2006, 27(5): 441-442.
[11] 王海榮, 張春桃, 王永莉. 加晶種控制頭孢曲松鈉溶析結晶產品粒度分布的研究[J]. 中國抗生素雜志, 2009, 34(6):337-340.

