福辛普利聯合阿魏酸鈉注射液治療糖尿病腎臟病的療效與安全性
楊夢華,余彩霞,劉 麗
糖尿病腎臟疾病(diabetic kidney disease,DKD)是糖尿病最常見的慢性并發癥,也是糖尿病患者的主要死亡原因之一。研究資料表明,無論是1型還是2型糖尿病,大約30%~40%的患者可出現腎臟損害,最終進入終末期腎衰竭(ESRD)[1]。本研究采用福辛普利聯合阿魏酸鈉注射液治療糖尿病腎臟病III期病變,效果較好,現報道如下。
1 資料與方法
1.1一般資料納入研究的120例DKD患者均為2009年1月~2011年1月在我院住院治療的患者,按就診順序被隨機分為治療組(60例)和對照組(60例),其中治療組男35例,女25例,年齡38~65歲,平均(49.1±6.3)歲;對照組男34例,女26例,年齡37~68歲,平均(48.3±7.17)歲。兩組患者入院時年齡、性別、空腹血糖、血壓、血脂、血鉀及腎功能等方面差異無統計學意義(P>0.05)。
1.2診斷標準所有病例糖尿病的診斷符合WHO1999年制定的診斷標準[2],DKD診斷符合2007年美國糖尿病協會(ADA)的診斷標準[3],均處于Ⅲ期患者,UAER連續3次測定在20~200 μg/min或24 h尿蛋白的定量為30~300 mg/24 h。除外標準:糖尿病急性并發癥,感染,嚴重心、肝、腦疾病,近期使用腎毒性藥物史,其他腎臟病,己使用ACEI或ARB類藥物。
1.3治療方法兩組均給予常規基礎治療,優質低蛋白飲食、適量運動、降脂、控制血壓、糾正水電解紊亂及酸堿失衡、使用胰島素控制血糖等。使空腹血糖控制在4.4~7.0 mmol/L,餐后2 h血糖在4.4~9.0 mmol/L,血壓控制在130/80 mmHg以下。對照組給予福辛普利片10 mg,每天1次,口服;治療組在對照組基礎上聯合阿魏酸鈉注射液0.30 g加入生理鹽水250 mL中靜滴,每天1次,療程為14 d。觀察并記錄治療過程中藥物不良反應。
1.4觀察指標治療前后檢測患者的UAER、FBG、BUN、Scr、TC、TG及K+。血糖測定用葡萄糖氧化酶法,血鉀等用生化自動分析儀,UAER用Bayer DVA2000分析儀,尿蛋白排泄率(UAER)=尿白蛋白(μg/mL)×24 h尿量(mL)/(24×60 min)。
1.5療效評定標準[4]顯效:24 h尿蛋白定量減少50%以上;有效:24 h尿蛋白定量減少20%以上;無效:24 h尿蛋白定量減少20%以下。
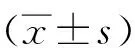
2 結果
2.1兩組治療效果比較治療組顯效30例,有效26例,無效4例,總有效率為93.3%;對照組顯效21例,有效24例,無效15例,總有效率為75.0%。治療組總有效率明顯優于對照組,兩組比較差異有統計學意義(P<0.05)。
2.2兩組治療前后臨床資料及生化指標比較兩組治療前后FBG、BUN、Scr、TC及TG均有明顯下降,與治療前比較差異有統計學意義(P<0.05),但組間比較差異無統計學意義(P>0.05);治療后兩組UAER均有下降,且治療組UAER下降較對照組明顯,差異有統計學意義(P<0.05);血鉀變化無統計意義(P>0.05)。見表1、2。
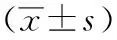
表1 兩組的UAER、FBG及K+比較
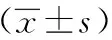
表2 兩組臨床資料及生化指標比較
2.3兩組治療期間的不良反應治療組出現咳嗽3例(5.0%),輕度水腫2例(3.3%);對照組出現咳嗽4例(6.7%),輕度水腫3例(5.0%)。經觀察及對癥治療后緩解,未影響繼續治療。兩組治療期間未出現其他嚴重不良反應,如低血壓、高血壓及高血鉀等,無1例患者退出研究。
3 討論
DKD是糖尿病常見而嚴重的微血管并發癥之一,其發病機制復雜,患者一旦進入臨床糖尿病腎病階段(DKDIV期),病情往往進行性發展,治療非常困難。大量研究證實,腎內腎素—血管緊張素—醛固酮系統(RAS)激活是DKD的重要致病因素之一,阻斷RAS可以明顯減輕DKD的病變程度,延緩腎功能減退的進展。血管腎張素轉化酶(ACE)活性的改變,使腎小球入球小動脈擴張,而出球小動脈擴張不明顯,從而使腎小球內“三高”:高濾過、高壓力和高灌注。血管緊張素轉化酶抑制劑(ACEI)的腎臟保護作用,正是通過降低系統內壓,從而降低腎小球內壓,減輕了腎小球內高濾過,減少DKD患者的UAER,減緩腎功能惡化[5]。同時ACEI還可通過改善腎小球基底膜屏障功能,抑制腎內血管活性物質和多種生長因子的功能,抑制了系膜增生、細胞外基質積聚等功能,在腎小球硬化和腎間質纖維化中起重要作用[6]。福辛普利是新一代含膦酸基的血管緊張素轉化酶抑制劑,具有優秀的藥代動力學特征,谷峰比值高,每日1次即可維持較好的療效,它可同時從腎臟和腸肝排泄,對于腎功能減退的老年患者也不易發生藥物蓄積[7]。本研究顯示,兩組給予福辛普利干預治療后,均取得了明顯療效(P<0.05),改善了UAER(P<0.05),延緩了DKD的進步惡化。
目前在腎臟病研究領域,認為轉化生長因子β1(TGF-β1)是各種進行性腎臟疾病發展為腎臟纖維化的主要因素之一,是引起腎小球硬化的主要介質[8]。腎間質纖維化是多種腎臟疾病走向腎衰竭的共同病理過程,其發病機制迄今仍未得到確切的闡明,通常認為是多因素綜合作用的結果。其中TGF-β1作為一種強效的致纖維因子,在腎間質纖維化的發生、發展的多個環節起作用。TGF-β表達升高,尤其是TGF-β1刺激細胞外基質的過量合成,同時介導腎小管上皮細胞表型轉化,最終導致腎小管上皮細胞的損傷及間質成纖維細胞增殖,從而加速間質纖維化的形成。邵曉珊等研究表明,TGF-β1在不同病理類型腎小球疾病中表達均明顯增高,其過度表達參與了腎小球疾病的進展,主要參與腎小管間質的損害[9]。阿魏酸鈉是中藥川芎中的主要成分,是我國自行研制開發出來的新的非肽類的內皮素受體拮抗劑[10],可拮抗TGF-β1的產生,并增加ACEI的協同作用[11]。本研究結果提示阿魏酸鈉與福辛普利聯合應用能較好地減少尿蛋白排泄率,效果優于單用福辛普利組(P<0.05),而且治療期間兩組均未出現嚴重的不良反應,具有較好的療效和安全性。
綜上所述,糖尿病腎臟疾病是嚴重影響糖尿病患者預后的并發癥之一,要早期篩查、早期干預治療。在降糖、降血脂、控制血壓、飲食及運動治療等治療的基礎上,聯合使用新型的血管緊張素轉化酶抑制劑福辛普利及內皮素受體拮抗劑阿魏酸鈉是治療早期糖尿病腎臟疾病的有效措施之一。
參考文獻:
[1] 陳灝珠,林果為.實用內科學[M].第13版.北京:人民衛生出版社,2009:2303-2312.
[2] 許曼音,陸廣華,陳各道.糖尿病學[M].上海:上海科學技術出版社,2003:16.
[3] 程樺.內科學[M].第7版.北京:人民衛生出版社,2008: 776.
[4] 李洪林.214例2型糖尿病的相關性分析[J].中國民族民間醫藥,2009,11:63.
[5] Goto H,Wakui H, Komntsuda A,et al.Renal alpha-action-4:purification and puromycin am inonucleo side-binding property [J].Nephron Exp Nephol,2006,93(1):27-35.
[6] De Cavanagh EM,Ferder M,Lnserra F,et al.Angiotensin Ⅱ, mitochondria,cytoskeletal,and extracellular matrix connections:an integrating viewpoint[J].Am J Physiol Heart Circ Physiol,2009, 296(3):558-558.
[7] Jerms G,Allen TJ,Compbell DJ,et al.Long-term comparison between perimdopril and nifedipine in normotensive patients with type 1 diabetes and microalbuminuria[J].Am J Kidney Dis, 2006,37(5):890-899.
[8] Fu P,Lin F,Su S,et al.Signaling mechanism of renal fibrosis in unilateral ureteral obstructive kidney disease in rock 1 knock out mice [J].J Am Soc Nephrol , 2006,17(11);3105-3114.
[9] 邵曉珊,勒蓉,蔣新輝,等.轉化因子-β1和堿性成纖維生長因子與兒童原發性腎小球疾病的相關性研究[J].臨床兒科雜志,2008,26(9):788-791.
[10] 王峰,劉霞,楊連香,等.咖啡酸、阿魏酸鈉,新的非肽類皮質素拮抗劑[J].中國臨床藥理學與治療學雜志,1999,4(2):85-91.
[11] 程虹.內皮素-1與腎素-血管腎張素-醛固酮系統的相互作用[J].腎臟病與透析腎移植雜志,2003,12(4):371.

