HSP70在對乙酰氨基酚誘導的小鼠急性肝損傷組織中的表達
馬英劍,李三強
撲熱息痛又名醋氨酚、對乙酰氨基酚,小劑量不會引起肝損傷,大劑量使用時,在其代謝過程中產生的大量N-乙酰-對苯醌亞胺(NAPQI)超過了GSH的解毒能力,于是未被清除的NAPQI與生物大分子共價結合,導致蛋白質巰基被氧化和芳香基化而影響它們的功能,從而導致肝損傷[1]。熱休克蛋白(heat shock proteins, HSPs) 是一組廣泛存在于微生物和動、植物體內的生物進化中高度保守的多肽蛋白。其中HSP70是HSPs 中最保守、最重要的一族,在大多數生物中含量最多,在應激反應中最敏感,因而是HSPs 中最受關注、研究最深入的一種[2]。本實驗主要研究HSP70在對乙酰氨基酚誘導的小鼠急性肝損傷中的動態變化規律,進一步深入探討HSP70在急性肝損傷中的作用。
1 材料與方法
1.1材料健康清潔級昆明種雄性小鼠,體質量(22±2) g,由河南科技大學醫學院實驗動物中心提供;對乙酰氨基酚:廣州白云山制藥廠,用生理鹽水稀釋;HSP70鼠源性單克隆抗體和辣根過氧化物酶標記的羊抗鼠二抗均購自北京中杉金橋生物技術有限公司;ALT、AST檢測試劑盒購自中生北控生物科技股份有限公司。
1.2方法
1.2.1 動物分組和模型制備 健康雄性小鼠40只分別腹腔注射對乙酰氨基酚溶液(用生理鹽水稀釋,550 mg/kg),在注射對乙酰氨基酚后6,24,42,54 h分別眼球取血,分離血清測AST和ALT活性,同時取小鼠肝臟制備10%肝勻漿,每個時間點10只小鼠。同時取10只正常小鼠的血清和肝臟作為對照進行研究。
1.2.2 血清ALT、AST活性檢測 按試劑盒說明書操作,測定血清ALT、AST活性。
1.2.3 HSP70檢測室 利用考馬斯亮藍G250蛋白定量后取70 μg蛋白樣品經SDS PAGE電泳后,將蛋白轉移到硝酸纖維素膜上,用5%脫脂奶粉、0.1%Tween20、PBS(PBST)室溫封閉膜30 min,用一抗HSP70(1∶1000),37℃孵育1 h,PBST洗3次每次5 min,加入辣根過氧化物酶標記的羊抗鼠二抗(1∶1000)于37℃孵育1 h,DAB顯色,檢測陽性信號。
2 結果
2.1血清AST和ALT活性變化小鼠注射對乙酰氨基酚后,隨著時間的延長血清中AST和ALT酶活性逐漸升高,24 h達到高峰,54 h逐漸恢復到正常水平,見圖1。
2.2 HSP70檢測結果HSP70在注射對乙酰氨基酚后6 h,其表達量略有增高,在24 h表達量達到高峰,說明小鼠肝臟的應激反應達到了高峰,此后HSP70的表達量逐漸恢復到正常水平,見圖2。
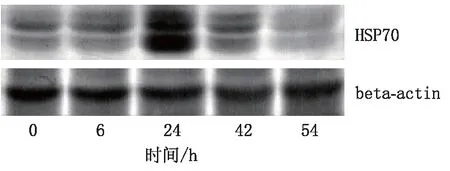
圖2 小鼠注射對乙酰氨基酚后肝臟HSP70表達的變化
3 討論
本實驗研究了在對乙酰氨基酚誘導的小鼠急性肝損傷過程HSP70的表達變化,并檢測了小鼠血清中AST和ALT活性的變化,初步闡明了HSP70在對乙酰氨基酚誘導的小鼠急性肝損傷中的作用。HSP70具有分子伴侶的作用,當蛋白質處于非正確的天然構象的時候,那些存在于球狀蛋白質內部的非疏水性氨基酸將會暴露出來,將與一些肽、核酸分子和一些大分子發生不良的相互作用。作為分子伴侶,HSP70將會解決這一問題。當新生的多肽一出現在核糖體中時,他們就結合到新生的多肽上,保護疏水的氨基酸殘基不進行一些無效的相互作用[3-4]。HSP70作為分子伴侶,不斷的和蛋白質結合或釋放,HSP70的構象在發生著不斷地變化,這種變化是在ATP的水解和交換的驅動下進行的[5]。對乙酰氨基酚誘導的小鼠急性肝損傷過程中,肝臟受到藥物的刺激,產生應激反應,HSP70的表達量增高以幫助錯誤折疊的蛋白進行修復,進而促進肝臟的修復和再生。總之,本研究為進一步闡明HSP70在急性肝損傷中的重要作用奠定了基礎。
參考文獻:
[1] 齊艷萍,李和平.急性肝損傷動物模型制備的概述[J].甘肅畜牧獸醫,2008,38 (2):37-39.
[2] 羅善明.熱休克蛋白70與肝細胞肝癌的研究進展[J].重慶醫學,2008,37(2):188-190.
[3] Young JC,Agashe VR,Siegers K,et a1.Pathways of chaperone-mediated protein folding in the cytosol [J].Nat Rev Mol Cell Biol,2004,5(10):781-791.
[4] Bukau B,Weissman J,Horwich A.Molecular chaperones and protein quality control [J]. Cell,2006,125(3):443-451.
[5] Meimaridou E,Gooljar SB,Chapple JP.From hatching to dispatching:the multiple cellular roles of the Hsp70 molecular chaperone machinery [J].J Mol Endocrinol,2009,42(1):1-9.

