蛋白質(zhì)表面模塊劃分及其在結(jié)合位點(diǎn)預(yù)測中的應(yīng)用
王攀文 龔新奇 李春華 陳慰祖 王存新
(1北京工業(yè)大學(xué)生命科學(xué)與生物工程學(xué)院,北京100124;2清華大學(xué)生命科學(xué)學(xué)院,北京100084)
蛋白質(zhì)表面模塊劃分及其在結(jié)合位點(diǎn)預(yù)測中的應(yīng)用
王攀文1,§龔新奇2,§李春華1,*陳慰祖1王存新1,*
(1北京工業(yè)大學(xué)生命科學(xué)與生物工程學(xué)院,北京100124;2清華大學(xué)生命科學(xué)學(xué)院,北京100084)
蛋白質(zhì)-蛋白質(zhì)復(fù)合物的結(jié)合位點(diǎn)預(yù)測是計(jì)算分子生物學(xué)的一個(gè)難題.本文對(duì)蛋白質(zhì)-蛋白質(zhì)復(fù)合物數(shù)據(jù)集Benchmark 3.0中的雙鏈蛋白質(zhì)復(fù)合物進(jìn)行了研究,計(jì)算了單體的殘基溶劑可接近表面積和殘基間的接觸面積,并據(jù)此提出了蛋白質(zhì)表面模塊劃分方法.發(fā)現(xiàn)模塊的溶劑可接近表面積與其內(nèi)部接觸面積的乘積(PSAIA)值能夠提供結(jié)合位點(diǎn)的信息.在78個(gè)雙鏈蛋白質(zhì)復(fù)合物中,有74個(gè)體系其受體或配體上具有最大或次大PSAIA值的模塊是界面模塊.將該方法獲得的結(jié)合位點(diǎn)信息應(yīng)用在CAPRI競賽Target 39的復(fù)合物結(jié)構(gòu)預(yù)測中取得了較好的結(jié)果.本文提出的基于模塊的蛋白質(zhì)結(jié)合位點(diǎn)預(yù)測方法不同于以殘基為基礎(chǔ)且僅考慮表面殘基的傳統(tǒng)預(yù)測方法,為蛋白質(zhì)-蛋白質(zhì)復(fù)合物結(jié)合位點(diǎn)預(yù)測提供了新思路.
蛋白質(zhì)結(jié)合位點(diǎn)預(yù)測;模塊劃分;溶劑可接近表面積;內(nèi)部接觸面積
1 引言
在后基因組時(shí)代,蛋白質(zhì)結(jié)構(gòu)-功能關(guān)系的研究已成為生命科學(xué)領(lǐng)域的研究熱點(diǎn).1-4隨著結(jié)構(gòu)基因組計(jì)劃的進(jìn)行和蛋白質(zhì)結(jié)構(gòu)解析技術(shù)的發(fā)展,已有大量蛋白質(zhì)三維結(jié)構(gòu)被測定.1但由于實(shí)驗(yàn)測定有關(guān)蛋白質(zhì)功能方面的信息仍存在諸多困難,發(fā)展用理論預(yù)測方法研究蛋白質(zhì)-蛋白質(zhì)相互作用是目前國際上十分關(guān)心的問題.4,5蛋白質(zhì)結(jié)合位點(diǎn)的成功預(yù)測將帶動(dòng)分子識(shí)別機(jī)理、復(fù)合物結(jié)構(gòu)預(yù)測、蛋白質(zhì)工程和藥物分子設(shè)計(jì)等相關(guān)領(lǐng)域研究的長足進(jìn)展.所以,蛋白質(zhì)復(fù)合物結(jié)合位點(diǎn)預(yù)測是蛋白質(zhì)計(jì)算領(lǐng)域最重要的問題之一.3,4,6-9為推動(dòng)蛋白質(zhì)結(jié)構(gòu)預(yù)測和蛋白質(zhì)-蛋白質(zhì)對(duì)接技術(shù)的發(fā)展,歐洲生物信息學(xué)研究所(European Bioinformatics Institute, EBI)于2001年開始舉辦蛋白質(zhì)復(fù)合物結(jié)構(gòu)預(yù)測競賽(Critical Assessment of Prediction of Interaction, CAPRI,網(wǎng)址:http://www.ebi.ac.uk/msd-srv/capri).在競賽中,競賽組委會(huì)選取尚未發(fā)表實(shí)驗(yàn)結(jié)構(gòu)數(shù)據(jù)的蛋白質(zhì)復(fù)合物為競賽內(nèi)容,要求參賽者在規(guī)定時(shí)間內(nèi),從蛋白質(zhì)單體結(jié)構(gòu)出發(fā),用分子對(duì)接方法對(duì)復(fù)合物結(jié)構(gòu)進(jìn)行預(yù)測,然后通過網(wǎng)絡(luò)提交10個(gè)預(yù)測結(jié)果.10
國際上提出的蛋白質(zhì)結(jié)合位點(diǎn)的預(yù)測方法主要包括四大類:基于序列的預(yù)測;11,12基于結(jié)構(gòu)的預(yù)測;13,14基于理化性質(zhì)的預(yù)測15,16和綜合考慮以上信息的預(yù)測.17,18基于序列的預(yù)測方法認(rèn)為,蛋白質(zhì)分子進(jìn)化重要的殘基(如結(jié)合位點(diǎn)殘基)往往具有較高的序列保守性.因此,這類方法常常通過多序列比對(duì)來獲得各位點(diǎn)氨基酸殘基的保守性,并據(jù)此預(yù)測蛋白質(zhì)結(jié)合位點(diǎn).基于結(jié)構(gòu)的預(yù)測方法認(rèn)為,蛋白質(zhì)某些局域的特定結(jié)構(gòu)是形成一定結(jié)合位點(diǎn)的基礎(chǔ),如蛋白質(zhì)結(jié)構(gòu)的疏水口袋區(qū)常常結(jié)合底物或抑制劑,由于α螺旋結(jié)構(gòu)的剛性較β折疊更強(qiáng),所以出現(xiàn)在結(jié)合位點(diǎn)的幾率較小;由于β轉(zhuǎn)角和無規(guī)卷曲結(jié)構(gòu)的高度可變性,它們出現(xiàn)在結(jié)合部位的可能性較大.基于理化性質(zhì)的預(yù)測方法表明,蛋白質(zhì)結(jié)合位點(diǎn)區(qū)域較其它表面在很多物理化學(xué)特性上(如疏水性和極性)都存在明顯的統(tǒng)計(jì)差異.這類預(yù)測常常通過機(jī)器學(xué)習(xí)方法對(duì)已知結(jié)合位點(diǎn)的蛋白質(zhì)數(shù)據(jù)庫進(jìn)行訓(xùn)練,得到一定規(guī)律后再進(jìn)行預(yù)測.
目前,大部分結(jié)合位點(diǎn)的預(yù)測方法是以殘基為基礎(chǔ),且僅僅考慮蛋白質(zhì)表面氨基酸殘基的性質(zhì),忽略了表面近鄰的內(nèi)部殘基的貢獻(xiàn).研究表明,蛋白質(zhì)分子是一個(gè)通過殘基間各種相互作用共同維系的復(fù)雜系統(tǒng),蛋白質(zhì)結(jié)合界面的殘基往往聚集成簇,19,20其堆積密度相對(duì)較高;21界面結(jié)構(gòu)是模塊化的,模塊內(nèi)殘基的內(nèi)聚性強(qiáng),模塊間的耦合作用不強(qiáng);22,23結(jié)合界面殘基與內(nèi)部殘基間的相互作用包含了界面區(qū)域的信息.10鑒于以上研究結(jié)果,我們認(rèn)為在蛋白質(zhì)-蛋白質(zhì)結(jié)合位點(diǎn)預(yù)測中,對(duì)表面進(jìn)行模塊劃分,且考慮內(nèi)部殘基的作用將能夠提高預(yù)測成功率.
本文通過對(duì)Benchmark 3.0數(shù)據(jù)庫22中的蛋白質(zhì)-蛋白質(zhì)復(fù)合物進(jìn)行分析研究,提出了一種能夠體現(xiàn)界面殘基間內(nèi)聚性的表面模塊劃分方法,發(fā)現(xiàn)模塊的溶劑可接近表面積與其內(nèi)部接觸面積的乘積可以提供蛋白質(zhì)結(jié)合位點(diǎn)的信息.應(yīng)用這一信息,在CAPRI Target 39復(fù)合物結(jié)構(gòu)預(yù)測中取得了好的結(jié)果.
2 研究體系和方法
2.1 數(shù)據(jù)集
Benchmark 3.0數(shù)據(jù)庫22中共有124個(gè)蛋白質(zhì)-蛋白質(zhì)復(fù)合物結(jié)構(gòu),在Benchmark 2.0的基礎(chǔ)上增加了40個(gè)復(fù)合物,包括新增的34個(gè)雙鏈復(fù)合物.我們以其中的78個(gè)雙鏈復(fù)合物(表1)為研究對(duì)象進(jìn)行統(tǒng)計(jì)分析.這些復(fù)合物包含了多種功能類型,如酶/抑制劑、抗原/抗體及其它類型.其單體的殘基數(shù)范圍為29-749.
2.2 蛋白質(zhì)表面模塊劃分及參數(shù)提取
2.2.1 蛋白質(zhì)表面模塊劃分
以蛋白質(zhì)三維結(jié)構(gòu)中的每個(gè)氨基酸殘基為中心,將與之有接觸的所有殘基(包括該中心殘基、蛋白質(zhì)內(nèi)部殘基以及表面殘基)劃分為一個(gè)模塊(patch).這里采用基于維里幾何的Qcontacts算法來判斷兩殘基是否接觸并計(jì)算它們之間的接觸面積.然后剔除所有的內(nèi)部模塊(不包含任何表面殘基的模塊),保留表面模塊(至少有一個(gè)表面殘基的模塊)作為最后表面模塊劃分的結(jié)果(圖1).表面殘基定義為相對(duì)溶劑可接近面積≥15%的殘基,溶劑可接近表面積的計(jì)算采用NACCESS(http://www.bioinf.manchester.ac.uk/naccess/)算法,水分子探針半徑取0.14 nm.另外,定義界面模塊為表面模塊中的一部分,且其中至少含有一個(gè)與伙伴分子(partner molecule)相互作用的界面殘基.界面殘基定義為與伙伴分子中至少一個(gè)殘基有接觸的殘基.
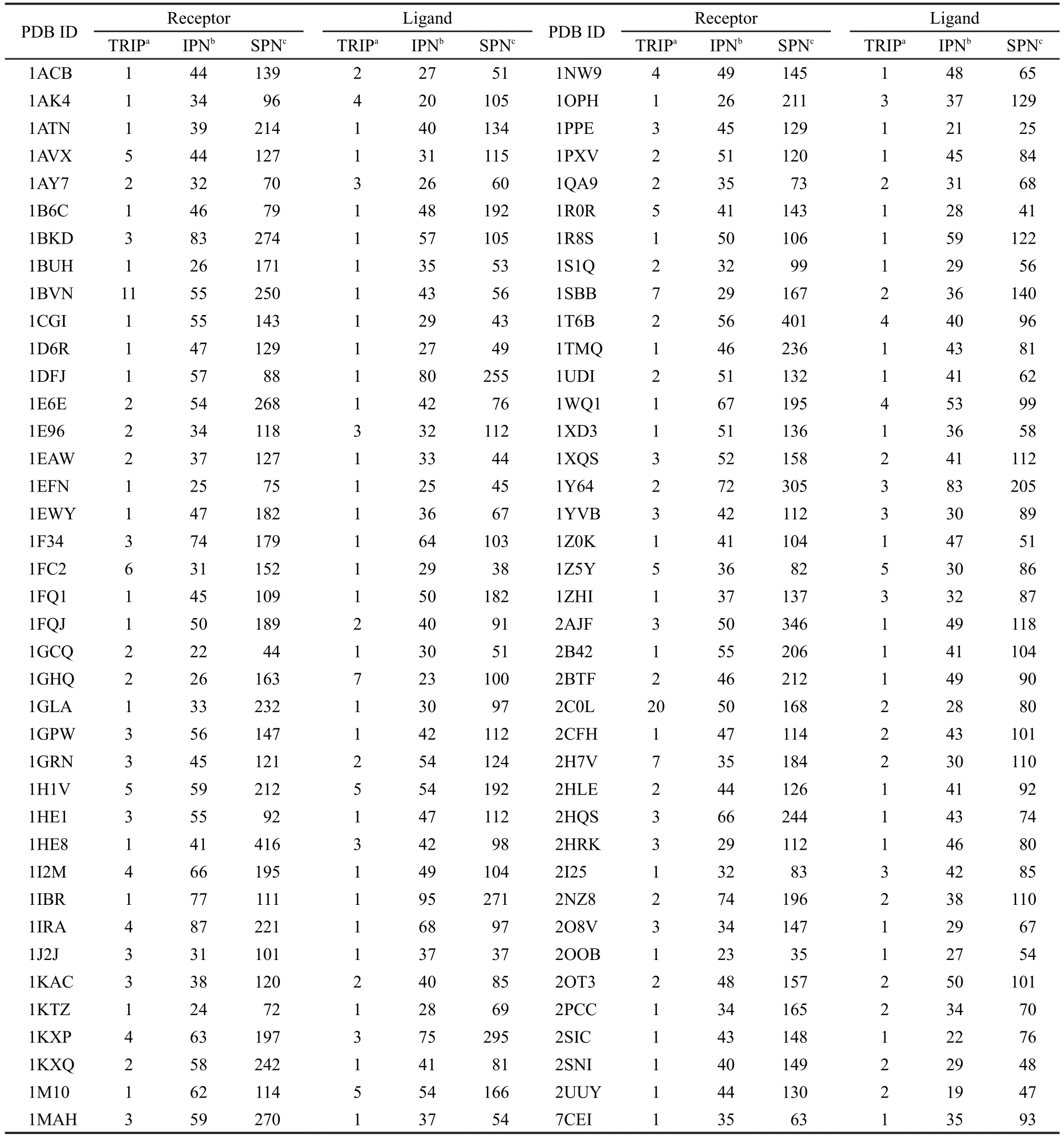
表1 78個(gè)蛋白質(zhì)-蛋白質(zhì)復(fù)合物中單體的模塊分析結(jié)果Table 1 Patch analysis results of the monomers from 78 protein-protein complexes
2.2.2 表面模塊參數(shù)的定義
引入兩個(gè)表面模塊參數(shù):溶劑可接近表面積A和內(nèi)部接觸面積C(圖1).模塊的溶劑可接近表面積A為模塊中所有殘基的溶劑可接近表面積之和

其中Ai是模塊中第i個(gè)殘基的溶劑可接近表面積.模塊的內(nèi)部接觸面積C為模塊內(nèi)所有殘基對(duì)的接觸面積之和

其中Cij是模塊中殘基i和殘基j之間的接觸面積.由以上兩個(gè)參數(shù)的乘積可得到模塊的PSAIA(溶劑可接近表面積與內(nèi)部接觸面積的乘積)值,即溶劑可接近表面積乘以內(nèi)部接觸面積
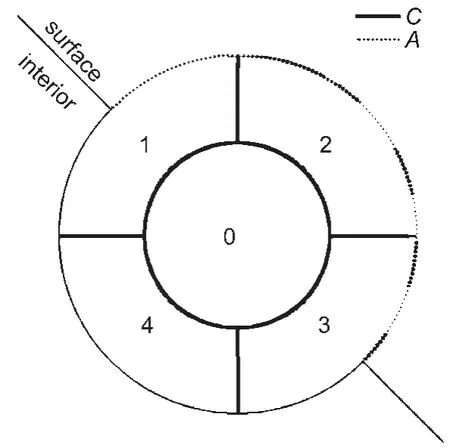
圖1 蛋白質(zhì)表面模塊的劃分Fig.1 Definition of protein surface patchesResidue 0,which contacts with residues 1,2,3,and 4,is the central residue of this surface patch.Residue 4 is considered as one part of this patch even though it is an internal residue.The dotted lineA stands for the solvent accessible surface area of this patch and the bold solid line C represents the interior contact area.

根據(jù)對(duì)78個(gè)雙鏈復(fù)合物中所有單體表面模塊PSAIA值的統(tǒng)計(jì)分析,確定具有最大或次最大PSAIA值的表面模塊為界面模塊.
2.3 CAPRI競賽中Target 39的復(fù)合物結(jié)構(gòu)預(yù)測
Target 39是CAPRI Round 17中提供的一個(gè)復(fù)合物結(jié)構(gòu)預(yù)測題目,其受體和配體結(jié)構(gòu)由加拿大多倫多大學(xué)PARK Hee-Won教授提供(http://www.ebi. ac.uk/msd-srv/capri/round17/round17.html).受體A鏈有357個(gè)氨基酸殘基,是蛋白質(zhì)centaurin-alpha 1,又稱3,4,5-三磷酸磷脂酰肌醇(PIP3)結(jié)合蛋白,是一種在神經(jīng)系統(tǒng)中高表達(dá)的ADP核糖基化因子(ARF)激活蛋白;B鏈有98個(gè)氨基酸殘基,為KIF13B蛋白的叉狀(FHA)結(jié)構(gòu)域,KIF13B屬于驅(qū)動(dòng)蛋白超家族(KIF).
采用課題組最近發(fā)展的HoDock集成分子對(duì)接方法24,25對(duì)Target 39進(jìn)行結(jié)構(gòu)預(yù)測,基本步驟如下:第一步預(yù)測受體和配體的界面模塊,用本文提出的預(yù)測方法給出蛋白質(zhì)單體中可能的結(jié)合位點(diǎn)區(qū)域;第二步采集初始復(fù)合物結(jié)構(gòu),在此過程中,一種方式是用蛋白質(zhì)可能的結(jié)合部位約束復(fù)合物模式采集的范圍,另一種方式是在全局采樣后,把結(jié)合位點(diǎn)信息與能量打分綜合起來排除錯(cuò)誤結(jié)構(gòu),通過這兩種方式挑出少數(shù)可能正確的復(fù)合物結(jié)構(gòu);第三步采集精細(xì)復(fù)合物結(jié)構(gòu),在上一步結(jié)果的基礎(chǔ)上做限制搜索范圍更加精細(xì)的局部對(duì)接,此時(shí)考慮結(jié)合界面上側(cè)鏈原子的柔性,同時(shí)對(duì)結(jié)構(gòu)進(jìn)行打分;第四步根據(jù)上面生成的復(fù)合物結(jié)構(gòu)之間的相似度,對(duì)它們進(jìn)行成簇聚類;最后綜合打分、成簇和結(jié)合位點(diǎn)信息挑出10個(gè)結(jié)構(gòu)作為最終結(jié)果提交給CAPRI競賽委員會(huì).
3 結(jié)果與討論
3.1 根據(jù)表面模塊的PSAIA值預(yù)測界面模塊
對(duì)Benchmark 3.0數(shù)據(jù)集中的78個(gè)雙鏈蛋白質(zhì)復(fù)合物中的全部單體進(jìn)行模塊劃分,剔除內(nèi)部模塊,僅保留表面模塊.計(jì)算表面模塊的PSAIA值,并將其從大到小排序.表1給出了這些體系的界面模塊在全部表面模塊中的最高排序、界面模塊數(shù)及表面模塊數(shù).從表1可以看出,對(duì)于整個(gè)數(shù)據(jù)集的蛋白質(zhì)單體,界面模塊數(shù)的范圍是19-95,表面模塊數(shù)的范圍為25-416,有150個(gè)單體的界面模塊在全部表面模塊中的最高排序在5以內(nèi)(包括5),占全部單體的96.15%;有60個(gè)復(fù)合物的受體或配體上具有最大PSAIA值的表面模塊是界面模塊,占整個(gè)數(shù)據(jù)集的76.92%;有74個(gè)復(fù)合物的受體或配體上具有最大或次大PSAIA值的表面模塊是界面模塊,占整個(gè)數(shù)據(jù)集的94.87%;20個(gè)復(fù)合物的受體和配體的具有最大PSAIA值的模塊都是界面模塊.以上結(jié)果說明蛋白質(zhì)單體中具有最大或次大PSAIA值的表面模塊傾向于參與蛋白質(zhì)-蛋白質(zhì)相互作用.換言之,即內(nèi)部接觸緊密且對(duì)外暴露充分的表面模塊(表現(xiàn)為模塊內(nèi)部接觸面積C與其溶劑可接近表面積A的乘積大)易出現(xiàn)在界面上,這在一定程度上體現(xiàn)了前人的觀點(diǎn):蛋白質(zhì)結(jié)合界面殘基往往聚集成簇,19,20堆積密度相對(duì)較高;21界面結(jié)構(gòu)是模塊化的,模塊內(nèi)殘基的內(nèi)聚性強(qiáng);22,23結(jié)合界面殘基與內(nèi)部殘基間的相互作用包含了界面區(qū)域的信息.10進(jìn)一步仔細(xì)分析發(fā)現(xiàn),這種傾向性對(duì)于受體和配體是有所不同的.在全部單體中,具有最大PSAIA值的表面模塊是界面模塊的受體數(shù)為33個(gè),而具有這種情況的配體數(shù)是47個(gè);具有最大或次大PSAIA值的模塊是界面模塊的受體數(shù)為50個(gè),而具有這種情況的配體數(shù)是62個(gè).這在一定程度上說明配體更傾向于擁有這種特性.這一點(diǎn)可作如下解釋:配體分子大多是較小的球形蛋白,受體分子大多是較大的不規(guī)則蛋白,結(jié)合界面常常呈凸形突出于表面,這樣與界面殘基接觸的內(nèi)部殘基數(shù)相對(duì)于與凹陷的非界面殘基接觸的內(nèi)部殘基數(shù)較少,導(dǎo)致界面模塊的內(nèi)部接觸面積C變小,其PSAIA值也隨之變小,結(jié)果界面模塊就不容易被排到最前面.根據(jù)以上分析,得出擁有最大或次大PSAIA值的表面模塊易出現(xiàn)在界面上,因此可以利用這一性質(zhì)來預(yù)測蛋白質(zhì)的界面區(qū)域.
3.2 具體實(shí)例分析
圖2(a)和2(b)顯示了兩個(gè)蛋白質(zhì)復(fù)合物1ATN和2C0L的單體上具有最大或次大PSAIA值的模塊在分子表面的位置.復(fù)合物1ATN由A鏈?zhǔn)荏w和D鏈配體組成,氨基酸殘基數(shù)分別是372和258;復(fù)合物2C0L由A鏈?zhǔn)荏w和B鏈配體組成,氨基酸殘基數(shù)分別是292和122.從圖2(a)看出,對(duì)于1ATN的兩個(gè)單體,其具有最大PSAIA值的模塊都是界面模塊.在該復(fù)合物中,受體和配體的形狀較為規(guī)則,特別是配體,更接近球形,界面模塊的預(yù)測相對(duì)容易.圖2(b)顯示,復(fù)合物2C0L的界面是由配體的一個(gè)柔性較大的無規(guī)卷曲結(jié)構(gòu)插入受體的由多個(gè)α螺旋組成的腔洞形成的.除無規(guī)卷曲結(jié)構(gòu)外,配體的整體形狀接近球形,具有次大PSAIA值的模塊在界面上.對(duì)于受體而言,它的結(jié)合部位包含了由多個(gè)α螺旋組成的腔洞,造成其內(nèi)部殘基的堆積比較松散,界面模塊的PSAIA值不高,使得界面模塊預(yù)測錯(cuò)誤.
3.3 CAPRI競賽中Target 39的結(jié)構(gòu)預(yù)測
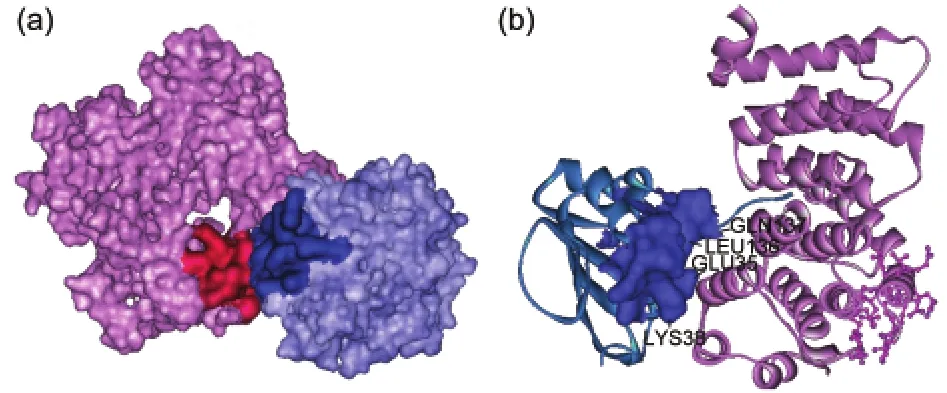
圖2 蛋白質(zhì)-蛋白質(zhì)復(fù)合物中單體上具有最大或次大PSAIA值的模塊所在的表面區(qū)域Fig.2 Surface areas of the patches with the first or second greatest product of the solvent accessible area and the interior contact area(PSAIA)value on monomers of protein-protein complexes(a)complex 1ATN.The pink monomer is the receptorAchain and the blue one is the ligand D chain.The deep pink and deep blue labeled surface areas are the interface patches with the first greatest PSAIAvalues.(b)complex 2C0L.The pink monomer is the receptor Achain and the blue one is the ligand B chain.The deep blue area of ligand is the interface patch with the second greatest PSAIAvalue, and the interface residues are labeled out.The receptor pink residues displayed by ball and stick compose the patch with the first greatest PSAIA,which is not an interface patch.
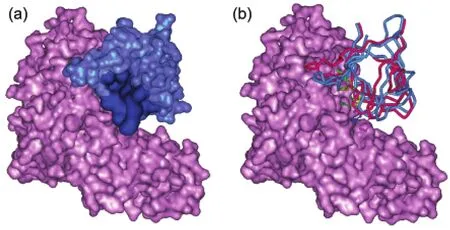
圖3 Target 39配體界面模塊預(yù)測和復(fù)合物結(jié)構(gòu)預(yù)測結(jié)果Fig.3 Results on interface patch prediction of ligand and the complex structure prediction for Target 39(a)interface patch prediction of ligand.The pink monomer is the receptorAchain and the blue one is the ligand B chain.The deep blue area is the predicted interface patch with the first greatest PSAIAvalue,which really interacts with the receptor. (b)Superposition of the predicted best structure and the corresponding X-ray complex structure.The ligand in X-ray structure is drawn in red tubes,and the docked ligand in blue tubes.The interface residues ASN452,MET486,LEU533,ASN536,ASN537,and PHE539 are marked by ball and stick and colored in green,pink,yellow, blue,deep green,and brown,respectively.
從以上分析可以看出,用蛋白質(zhì)表面模塊的PSAIA值來預(yù)測形狀較規(guī)則的球形蛋白的結(jié)合部位效果比較好.圖3顯示了CAPRI Target 39復(fù)合物結(jié)構(gòu)預(yù)測與配體界面模塊預(yù)測結(jié)果.由圖可見,配體接近球形,受體不規(guī)則.因此,為了避免結(jié)構(gòu)預(yù)測錯(cuò)誤,在分子對(duì)接中,僅考慮配體的界面模塊預(yù)測信息,而未考慮受體的預(yù)測結(jié)果(實(shí)際上受體具有最大PSAIA值的模塊不在結(jié)合界面上).在圖3(a)中,配體最大PSAIA值模塊的表面被標(biāo)記為深藍(lán)色.該模塊中的表面殘基有9個(gè):ASN452、CYS484、GLY485、MET486、LEU533、ASN536、ASN537、HIS538和PHE539,其中真正參與相互作用的界面殘基有6個(gè):ASN452、MET486、LEU533、ASN536、ASN537和PHE539.這說明我們提出的識(shí)別蛋白質(zhì)界面模塊的方法可比較準(zhǔn)確地預(yù)測配體的結(jié)合位點(diǎn).最后綜合打分、成簇和結(jié)合位點(diǎn)信息挑出10個(gè)結(jié)構(gòu)作為最終結(jié)果提交給CAPRI組委會(huì).國際上有37個(gè)小組參加了該復(fù)合物的結(jié)構(gòu)預(yù)測,共提交了366個(gè)結(jié)構(gòu),其中只有3個(gè)結(jié)構(gòu)達(dá)到了CAPRI組委會(huì)制定的“好結(jié)構(gòu)”的標(biāo)準(zhǔn).26我們提交的一個(gè)結(jié)構(gòu)為其中之一,其配體主鏈原子均方根偏差(L_rmsd)為0.25 nm(圖3(b)),被評(píng)為中等(Medium)好結(jié)構(gòu)(http://www.ebi.ac.uk/msd-srv/capri/round17/round17. html).HoDock分子對(duì)接方法以及配體結(jié)合位點(diǎn)正確信息的獲取為該結(jié)構(gòu)的成功預(yù)測提供了重要保障.
4 結(jié)論
通過對(duì)蛋白質(zhì)-蛋白質(zhì)復(fù)合物數(shù)據(jù)集Bench-mark 3.0中的雙鏈復(fù)合物分析研究,提出了蛋白質(zhì)表面模塊的劃分方法,并發(fā)現(xiàn)模塊的溶劑可接近表面積與其內(nèi)部接觸面積的乘積值PSAIA,能夠提供結(jié)合位點(diǎn)信息,從而建立了界面模塊預(yù)測方法.用該方法預(yù)測形狀較規(guī)則的球形蛋白的結(jié)合部位效果較好.將該方法獲得的結(jié)合位點(diǎn)信息應(yīng)用在CAPRI競賽Target 39的復(fù)合物結(jié)構(gòu)預(yù)測中取得了較好的結(jié)果.傳統(tǒng)的結(jié)合位點(diǎn)預(yù)測方法大都是以殘基為基礎(chǔ),且僅僅考慮表面殘基.本文提出的基于模塊的蛋白質(zhì)結(jié)合位點(diǎn)預(yù)測方法不同于傳統(tǒng)方法,不僅考慮了表面殘基,而且考慮了內(nèi)部殘基對(duì)的貢獻(xiàn),并以模塊為基礎(chǔ)來預(yù)測結(jié)合位點(diǎn),這為蛋白質(zhì)-蛋白質(zhì)相互作用中結(jié)合位點(diǎn)預(yù)測方法研究提供了新的思路.
(1) Teichmann,S.A.;Murzin,A.G.;Chothia,C.Curr.Opin.Struct. Biol.2001,11(3),354.doi:10.1016/S0959-440X(00)00215-3
(2) Baker,D.;Sali,A.Science 2001,294(5540),93.doi:10.1126/ science.1065659
(3) Stark,A.;Shkumatov,A.;Russell,R.B.Structure 2004,12(8), 1405.doi:10.1016/j.str.2004.05.012
(4) Jones,S.;Thornton,J.M.Curr.Opin.Chem.Biol.2004,8(1), 3.doi:10.1016/j.cbpa.2003.11.001
(5) Kinoshita,K.;Nakamura,H.Curr.Opin.Struct.Biol.2003,13 (3),396.doi:10.1016/S0959-440X(03)00074-5
(6)Tseng,Y.Y.;Li,W.H.Proc.Natl.Acad.Sci.U.S.A.2011,108 (13),5313.doi:10.1073/pnas.1102210108
(7)Amos-Binks,A.;Patulea,C.;Pitre,S.;Schoenrock,A.;Gui,Y.; Green,J.R.;Golshani,A.;Dehne,F.BMC Bioinformatics 2011, 12,225.doi:10.1186/1471-2105-12-225
(8) Xiong,Y.;Liu,J.;Wei,D.Q.Proteins 2011,79(2),509.doi: 10.1002/prot.v79.2
(9) He,X.;Chen,C.C.;Hong,F.;Fang,F.;Sinha,S.;Ng,H.H.; Zhong,S.PLoS One 2009,4(12),e8155.
(10) Lensink,M.F.;Mendez,R.;Wodak,S.J.Proteins 2007,69(4), 704.doi:10.1002/prot.21804
(11) Lichtarge,O.;Bourne,H.R.;Cohen,F.E.J.Mol.Biol.1996, 257(2),342.doi:10.1006/jmbi.1996.0167
(12) Ofran,Y.;Rost,B.FEBS Lett.2003,544(1-3),236.doi: 10.1016/S0014-5793(03)00456-3
(13)Laskowski,R.A.;Luscombe,N.M.;Swindells,M.B.; Thornton,J.M.Protein Sci.1996,5(12),2438.
(14) Torrance,J.W.;Bartlett,G.J.;Porter,C.T.;Thornton,J.M.J. Mol.Biol.2005,347(3),565.doi:10.1016/j.jmb.2005.01.044
(15) Gao,Y.;Wang,R.;Lai,L.J.Mol.Model.2004,10(1),44.doi: 10.1007/s00894-003-0168-3
(16) Innis,C.A.;Anand,A.P.;Sowdhamini,R.J.Mol.Biol.2004, 337(4),1053.doi:10.1016/j.jmb.2004.01.053
(17) de Vries,S.J.;Bonvin,A.M.Bioinformatics 2006,22(17), 2094.doi:10.1093/bioinformatics/btl275
(18) Madabushi,S.;Yao,H.;Marsh,M.;Kristensen,D.M.;Philippi, A.;Sowa,M.E.;Lichtarge,O.J.Mol.Biol.2002,316(1),139. doi:10.1006/jmbi.2001.5327
(19) Guharoy,M.;Chakrabarti,P.Proc.Natl Acad.Sci.U.S.A. 2005,102(43),15447.doi:10.1073/pnas.0505425102
(20) Li,X.;Keskin,O.;Ma,B.;Nussinov,R.;Liang,J.J.Mol.Biol. 2004,344(3),781.doi:10.1016/j.jmb.2004.09.051
(21) Hintze,A.;Adami,C.Plos Comput.Biol.2008,4(2),e23.
(22) Hwang,H.;Pierce,B.;Mintseris,J.;Janin,J.;Weng,Z.Proteins 2008,73(3),705.doi:10.1002/prot.22106
(23) Bai,H.J.;Lai,L.H.Acta Phys.-Chim.Sin.2010,26,1988. [白紅軍,來魯華.物理化學(xué)學(xué)報(bào),2010,26,1988.]doi:10.3866/ PKU.WHXB20100725
(24)Gong,X.Q.;Liu,B.;Chang,S.;Li,C.H.;Chen,W.Z.;Wang, C.X.Sci.China Life Sci.2010,53(9),1152.doi:10.1007/ s11427-010-4050-0
(25)Gong,X.Q.;Wang,P.W.;Yang,F.;Chang,S.;Liu,B.;He,H. Q.;Cao,L.B.;Xu,X.J.;Li,C.H.;Chen,W.Z.;Wang,C.X. Proteins 2010,78(15),3150.doi:10.1002/prot.v78:15
(26) Janin,J.;Henrick,K.;Moult,J.;Eyck,L.T.;Sternberg,M.J.; Vajda,S.;Vakser,I.;Wodak,S.J.Proteins 2003,52(1),2. doi:10.1002/(ISSN)1097-0134
May 25,2012;Revised:August 16,2012;Published on Web:August 16,2012.
Division of Protein Surface Patches and Its Application in Protein Binding Site Prediction
WANG Pan-Wen1,§GONG Xin-Qi2,§LI Chun-Hua1,*CHEN Wei-Zu1WANG Cun-Xin1,*
(1College of Life Science and Bioengineering,Beijing University of Technology,Beijing 100124,P.R.China;2School of Life Sciences,Tsinghua University,Beijing 100084,P.R.China)
Binding site prediction for protein-protein complexes is a challenging problem in the area of computational molecular biology.Using a set of double-chain complexes in Benchmark 3.0,we calculated the solvent accessible surface areas and inter-residue contact areas for each monomer and propose a division method of protein surface patches.We found that the products of the solvent accessible surface areas and internal contact areas of patches,the PSAIA values,could provide protein binding site information.In a dataset of 78 complexes,either receptors or ligands of 74 complexes had interface patches with the first or second greatest PSAIA values among all surface patches.A good docking result was achieved when the binding site information obtained with this method was applied in Target 39 of the CAPRI experiment.This patch-based protein binding site prediction method differs from traditional methods,which are based on single residue and consider only surface residues.This provides a new method for binding site prediction in protein-protein interactions.
Protein binding site prediction;Patch division;Solvent accessible surface area; Interior contact area
10.3866/PKU.WHXB201208162
?Corresponding authors.LI Chun-Hua,Email:chunhuali@bjut.edu.cn.WANG Cun-Xin,Email:cxwang@bjut.edu.cn;Tel:+86-10-67392724.
§These authors contribute equally to this work.The current address of WANG Pan-Wen is Department of Biochemistry,Li Ka Shing Faculty of Medicine,the University of Hong Kong,Hong Kong,P.R.China.
The project was supported by the National Natural Science Foundation of China(31171267,10974008),Beijing Natural Science Foundation,China (4102006),International Science&Technology Cooperation Program of China(2010DFA31710),and Fundamental Research Fund for the Beijing Municipal Education Commission Science and Technology Innovation Platform,China.
國家自然科學(xué)基金(31171267,10974008),北京市自然科學(xué)基金(4102006),科技部國際合作項(xiàng)目(2010DFA31710)和北京市教委科技創(chuàng)新平臺(tái)-自然基礎(chǔ)研究項(xiàng)目資助
O641