APPβ分泌酶切割位點特異性單鏈抗體的制備和鑒定
黃 巍,周麗榮,周 婷,孫紅霞,黃曉剛,劉 橋
(武漢市醫學科學研究所基礎醫學研究室,湖北武漢 430014)
阿爾采末病(Alzheimer’s disease,AD)發病機制復雜,其中 β-淀粉樣蛋白(amyloid β protein,Aβ)胞內外異常過量產生、聚集和沉積,是導致AD老年斑形成和神經元毒性的確切病理現象和重要誘因。Aβ由I型跨膜的淀粉樣前體蛋白(amyloid precursor protein,APP)經分泌酶水解代謝產生,按作用位點可分為α、β和γ 3種,α和β分泌酶(β-site APP-cleaving enzyme,BACE)先競爭性的水解 APP,然后γ分泌酶再水解剩下的APP片段產生各自代謝產物。Aβ由β和γ分泌酶依次水解APP產生[1],具有毒性;α和γ分泌酶依次水解APP,產生的可溶性sAPPα肽和P3肽段則具有神經營養等作用。若APP的α和β代謝失去平衡,產生過多的Aβ,就容易誘發AD。
APPβ分泌酶切割位點是Aβ產生的關鍵位點,容易受到周圍空間環境影響,如將Aβ抗體與APP結合,當抗體識別位點靠近Aβ的N端,即靠近APP的β切割位點,則Aβ的產生會受到干擾[2],抗體識別位點正好為APPβ分泌酶切割位點序列時則作用更直接[3-4],提示APPβ位點可以作為一個藥物設計的良好靶點。我們在研制抗人APPβ分泌酶水解位點的單克隆抗體(mAb)的基礎上[5],進一步研制特異性單鏈抗體(ScFv),ScFv相對mAb具有免疫原性弱,組織穿透力強,更容易通過血腦屏障等特點。APPβ分泌酶切割位點抗體與Aβ抗體在識別序列和減低Aβ機制上都有所不同,前者的目的是阻礙β分泌酶進入作用位點,切割APP產生Aβ,后者則是激活免疫系統,溶解清除已產生的Aβ,見Fig 1。
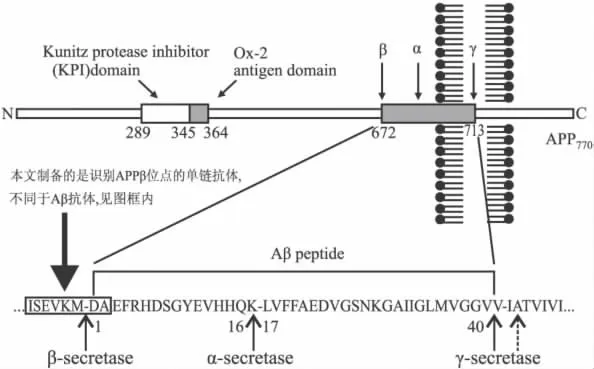
Fig 1 The delineation of APP degradation
1 材料與方法
1.1 材料 分泌抗人APPβ分泌酶水解位點單克隆抗體細胞株1A7和2H10[5],以及穩定轉染pEGFP-hAPP751(+4G)的 CHO細胞株(過表達人APP751和GFP融合蛋白)[6]由本室制備保存。限制性內切酶BamH I和EcoR I、pMD19-T克隆載體和逆轉錄酶M-MLV等為大連寶生物公司產品。引物合成與測序為上海英駿生物技術公司,高保真pfu酶和細胞裂解液購自碧云天生物技術研究所,鎳NTA Resin為上海博彩生物科技有限公司產品,增強型HRP-DAB底物顯色試劑盒為北京天根生化公司產品。APPβ位點序列多抗原短肽[ISEVKMDA]8由上海波泰生物科技公司合成,抗His的單克隆抗體為Santa Cruz公司產品,抗His的兔多克隆抗體和Aβ肽(1-42)為北京博奧森生物公司產品。
1.2 方法
1.2.1 引物合成 由于含linker序列的引物不利于擴增抗體的重鏈可變區VH和輕鏈可變區VL基因,故先設計不含linker序列的引物擴增抗體的VH和VL片段,再以此為模板用含linker序列的引物擴增VH和VL,引物分別為:VHF(重鏈VH上游引物):5'-ATAGGATCCCAGGTSMARCTGCAGSAGTCWGG-3'(含 BamH I位點;W=A/T,S=G/C,M=A/C,R=A/G);VHB1(重鏈 VH下游引物,不含 linker序列):5'-TGAGGAGACGGTGACCGTGGTCC-3';VHB(重鏈 VH下游引物,含 linker序列):5'-GCCAGAGCCACCTCCGCCTGAACCGCCTCCACCTGAGGAGACGGTGACCGTGGTCC-3';VLF1(輕鏈 VL上游引物,不含 linker序列):5'-GACATCGAGCTCACCCAGTCTC-3';VLF(輕鏈VL上游引物,含linker序列):5'-CAGGCGGAGGTGGCTCTGGCGGTGGCGGATCGGACATCGAGCTCACCCAGTCTC-3';VLB(輕鏈VL下游引物):5'-CGCGAATTCCCGTTTGATTTCCAGCTTGGTCCC-3'(含EcoR I位點)。引物VHB1和VLF1分別是VHB和 VLF中3'端序列的一部分,VHB和VLF中5'端部分為含有互補關系的linker序列,VHF和VLB分別含有BamH I和EcoR I酶切位點,便于拼接出來的ScFv構建載體。
1.2.2 VH和VL基因的克隆 分別提取1A7和2H10總 RNA,逆轉錄合成 cDNA。以 cDNA為模版,分別用VHF/VHB1和VLF1/VLB引物擴增出不帶linker的序列,命名為VH1和VL1,回收純化VH1和VL1片段,再以此為模板,用VHF/VHB和VLF/VLB引物,在高保真pfu酶作用下,分別擴增含linker序列的VH和VL片段。
1.2.3 ScFv的拼接 將VH和VL片段回收純化,通過重疊延伸PCR(splicing by overlapping extension PCR,SOE-PCR)技術連接起來,即為ScFv片段,其主要過程如下:取等量純化后的VH和VL片段與適量dNTP和Taq酶混勻,進行PCR反應,條件為:94℃ 1 min,60℃ 1 min,72℃1 min,共進行 7 個循環。然后,不必純化直接取適量SOE-PCR反應液作為模板,用VHF/VLB引物大量擴增 ScFv片段。將PCR的產物與 pMD19-T克隆載體連接,轉化DH5α,挑選陽性克隆測序。
1.2.4 ScFv表達載體的構建 以測序正確的ScFv克隆載體為模板,用VHF/VLB引物再次大量擴增ScFv片段,BamH I和EcoR I雙酶切,回收純化后與同樣雙酶切的pET-28a表達載體相連接,轉化感受態DH5α,通過PCR、BamH I和 EcoR I雙酶切和測序鑒定陽性克隆,命名為pET-ScFv(APPβ)。
1.2.5 ScFv的表達純化及鑒定 將鑒定正確的pET-ScFv(APPβ)質粒轉化表達菌株BL21(DE3),篩選陽性菌落進行IPTG誘導表達,超聲破碎離心收集上清和沉淀,進行12%SDS-PAGE電泳,考馬斯亮藍染色分析。結果表達產物以包涵體形式居多,目的蛋白帶有his標簽,通過鎳柱純化和復性,Western blot檢測,一抗為抗His的單克隆抗體,增強型HRP-DAB底物顯色試劑盒顯色。
1.2.6 可溶性ScFv生物活性的分析 通過ELISA分別檢測ScFv對人APPβ分泌酶位點序列短肽的結合能力和對Aβ的交叉反應:以APPβ位點序列多抗原短肽[ISEVKMDA]8或 Aβ(1-42)包被酶標板,5 mg·L-1,每孔 100 μl,4℃過夜。洗板后,加可溶性ScFv,然后依次加抗His的兔多克隆抗體、HRP標記抗兔二抗,TMB顯色并讀取A450值。通過Western blot檢測ScFv對人全長APP的結合能力:培養過表達人APP751和GFP融合蛋白的CHO細胞和過表達GFP的CHO細胞,裂解后行10%SDSPAGE電泳,濕轉至NC膜,5%脫脂奶粉37℃封閉2 h,可溶性ScFv 4℃孵育過夜,洗膜后加抗His的單克隆抗體37℃ 2 h,洗膜,再加HRP酶標二抗37℃2 h,試劑盒顯色。
2 結果
2.1 VH和 VL基因的克隆及 ScFv的拼接 從2H10中擴增出預期的約370 bp的VH1和330 bp的VL1條帶,回收純化后以各自為模板,分別擴增出含linker序列的大小分別約為410 bp和380 bp的VH和VL條帶。將VH和VL回收純化,經SOE-PCR拼接得到約750 bp的ScFv片段,見Fig 2。將2H10的ScFv與pMD19-T克隆載體連接,轉化DH5α,挑選陽性克隆測序,測序正確的序列用于ScFv表達載體的構建。從1A7中沒有擴增出預期的VH1,該株克隆中止。
2.2 表達載體pET-ScFv(APPβ)的構建和鑒定經篩選得到的陽性重組體命名為pET-ScFv(APPβ),通過PCR可以擴增出約750 bp的條帶,BamH I和EcoR I雙酶切顯示兩個片段,分別是約5.5 kb和750 bp,與預計結果相同,見Fig 3。測序分析表明ScFv序列全長744 bp,編碼248個氨基酸,輕重鏈基因序列符合小鼠抗體可變區的結構特點,表達載體閱讀框正確,見Fig 4。
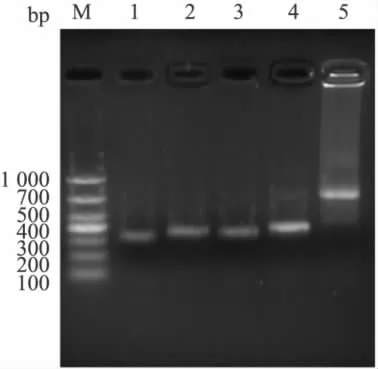
Fig 2 PCR product of VL1,VH1,VL,VHand ScFv gene from hybridoma 2H10
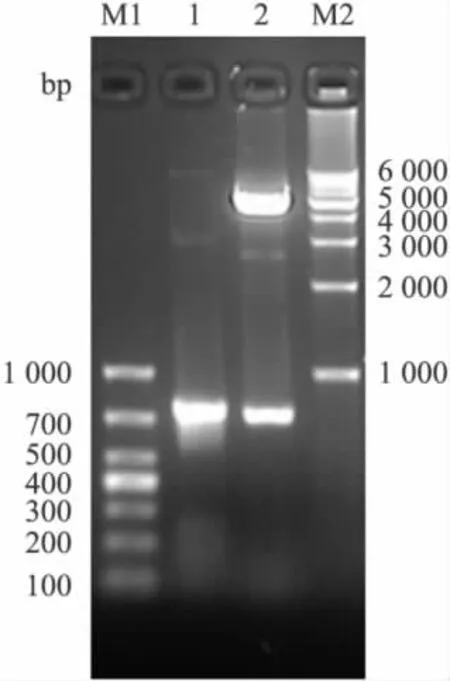
Fig 3 PCR product and the results of reconstruction vector pET-ScFv(APPβ)digested by BamH I and EcoR I
2.3 ScFv的表達純化和鑒定 誘導表達產物進行12%SDS-PAGE分析,在約29 ku位置處出現新增條帶。誘導表達菌經超聲破碎離心收集上清和沉淀,進行SDS-PAGE分析,結果表明表達產物主要為包涵體形式。通過鎳柱純化并復性后,可得到分子量約29 ku、純度在90%以上的條帶。目的蛋白通過his標簽進行Western
blot檢測,結果顯示在分子量大小為29 ku處有特異條帶,與預期ScFv蛋白情況相符,見Fig 5。
2.4 可溶性ScFv生物活性的分析 ELISA檢測結果表明,分別包被APPβ位點序列多抗原短肽[ISEVKMDA]8和Aβ,ScFv能夠與前者結合,與 Aβ 的結合反應則未能檢測到。過表達人APP751和GFP融合蛋白的CHO細胞和過表達GFP的CHO細胞,裂解后行10%SDS-PAGE電泳,濕轉至NC膜,封閉后,依次加可溶性ScFv、抗His單克隆抗體和酶標二抗孵育,增強型HRP-DAB顯色。結果過表達APP細胞在約156 ku的地方出現條帶,與預期的全長APP(約130 ku)+GFP標簽(約26 ku)分子量之和一致,而穩定轉染 GFP的細胞無任何條帶,排除ScFv與GFP結合的可能,表明ScFv是可以與全長APP結合的,見Fig 6。
3 討論
目前,有關阻斷或清除胞內外異常增多Aβ的研究主要集中在APPβ及γ分泌酶抑制劑或RNA干擾[7-9]、Aβ抗體或疫苗等方向,但存在一些問題,如APP分泌酶除APP外,還有其它在正常生理活動中發揮重要功能的底物,抑制分泌酶活性有可能帶來嚴重的副作用。APPβ分泌酶切割位點抗體為減少Aβ提供新的思路,當其與作用位點結合后,發揮空間位阻效應,阻礙β-分泌酶進入位點,致使Aβ無法產生,此方法通過阻礙水解酶進入特定位點而抑制其特定作用,由于不直接抑制水解酶的活性,特異性高副作用小,可為AD或其他新型藥物設計或疫苗研究提供借鑒。
Aβ的產生有兩大途徑——分泌途徑和內吞途徑,β-分泌酶和位于高爾基體、細胞表面和內吞體等處的APP均能相互作用,在APP的分泌過程和胞膜APP內吞體形成與循環過程中水解APP生成Aβ[10-11]。APPβ 分泌酶位點單克隆抗體主要在內吞體循環過程中抑制Aβ產生,抑制率約50%[12]。本文進一步研制APPβ分泌酶位點小分子的ScFv,期望以后通過基因轉染等方式將其導入胞內,還可在APP的分泌過程中抑制Aβ產生。本文制備的ScFv在抑制Aβ產生的同時還可能具有促進APPα代謝的潛能。雖然有報道指出APPβ位點單克隆抗體不能在阻斷BACE作用的同時使APP朝α代謝途徑發展[3],但小分子的單鏈抗體或胞內抗體則不然,不但不會影響α位點水解,還有利于APP與α酶結合使其向α分泌途徑發展。這是因為APP的α和β位點距離很近,α酶和β酶(或β位抗體)與相應位點結合時可能出現類似競爭性結合的情況。當β酶或β位單克隆抗體與β位點結合后,由于兩者分子較大都會阻礙α酶與α位點的結合,故影響APP的α代謝;而小分子抗體由于空間位阻小,與β位點結合后既阻礙β酶進入β位點又方便α酶與α位點的結合,從而有利于APP的α代謝。關于這一點,識別位點靠近β位的抗Aβ胞內抗體的研究提供了有力的證據[2],研究表明該Aβ抗體對α位點的水解有促進作用,因此,可以推斷距離α位點較該Aβ抗體更遠的β位點單鏈抗體或胞內抗體,對APPα分泌酶與α位點結合切割過程將會更有利。

Fig 4 The sequence of pET-ScFv(APPβ)
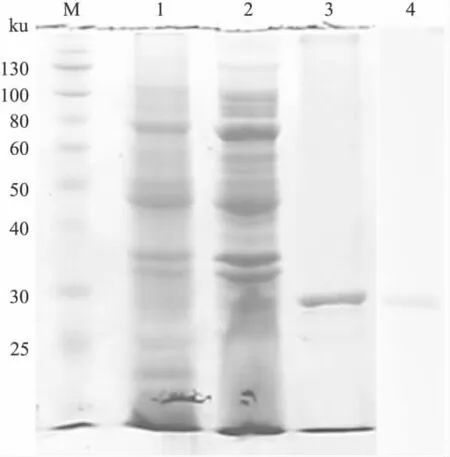
Fig 5 SDS-PAGE analysis and Western blot assay of pET-ScFv(APPβ)

Fig 6 Western blot analysis of the binding of soluble ScFv to the full length of hAPP
本文采用的是傳統克隆抗體可變區的方法,即用一組簡并引物進行擴增,結果兩株雜交瘤細胞中只有2H10可以擴增出VH和VL基因并成功拼接出ScFv序列,而1A7擴增不出預期大小的VH(簡并引物擴增VH時,有一條約700 bp的帶,資料未顯示),說明抗體可變區高度可變,簡并引物法不適用于某些抗體可變區序列的擴增,需要采用其他方法釣取抗體的可變區序列。在擴增VH和VL基因片段時,不宜直接使用含linker序列的引物VHB和VLF,否則由于引物太長導致二級結構復雜不利于片段擴增,導致擴增失敗或效率過低不利于回收。本文先用不含linker序列的短引物VHB1和VLF1與各自配對引物擴增出目的片段VH1和VL1,經純化后再各自為模板,用含linker序列的引物擴增相應的VH和VL片段,效果很好。用于擴增VH和VL的模板VH1和VL1必須要純化,否則不利于VH和VL的擴增;而SOEPCR產物應直接用于PCR擴增ScFv序列,可以擴增出很亮的ScFv帶,若純化后再擴增ScFv,則容易出現帶拖尾不集中等情況。ScFv與pET-28a表達載體相連接并在大腸桿菌中誘導表達,載體上His標簽與ScFv融合,方便ScFv通過鎳柱純化和復性。ELISA和Western blot檢測結果表明,可溶性ScFv與人APPβ分泌酶水解位點序列短肽和全長APP都有結合活性,對Aβ沒有交叉反應,可以推斷ScFv能夠與全長APP的β分泌酶切割位點結合,這為進一步研究ScFv干預分泌酶對APP的水解過程奠定了基礎。
[1]李守業,朱 妍,焦 悅,等.阿爾采末病APP分泌酶及其靶向干預研究進展[J].中國藥理學通報,2011,27(10):1349-53.
[1]Li S Y,Zhu Y,Jiao Y,et al.Progress of APP secretase and targeted intervention on Alzheimer’s disease[J].Chin Pharmacol Bull,2011,27(10):1349-53.
[2]Paganetti P,Calanca V,Galli C,et al.beta-site specific intrabodies to decrease and prevent generation of Alzheimer’s Abeta peptide[J].J Cell Biol,2005,168(6):863-8.
[3]Arbel M,Yacoby I,Solomon B.Inhibition of amyloid precursor protein processing by beta-secretase through site-directed antibodies[J].Proc Natl Acad Sci,2005,102(21):7718-23.
[4]Thomas R S,Liddell J E,Kidd E J.Anti-amyloid precursor protein immunoglobulins inhibit amyloid-β production by steric hindrance[J].FEBS J,2011,278(1):167-78.
[5]黃 巍,龐蓓蓓,周 婷,等.抗人APPβ水解位點單克隆抗體的制備及其初步鑒定[J].細胞與分子免疫學雜志,2010,26(12):1235-7.
[5]Huang W,Pang B B,Zhou T,et al.Preparation and characterization of monoclonal antibody against β-site of human APP[J].J Cell Mol Immunol,2010,26(12):1235-7.
[6]黃 巍,龐蓓蓓,熊 波,等.Kozak序列(+4G)對攜帶GFP標簽的人APP751表達的影響[J].生物技術通訊,2011,22(2):149-53,196.
[6]Huang W,Pang B B,Xiong B,et al.Effect of kozak sequnce+4G on the expression of hAPP751 and GFP fusion gene[J].Lett Biotechnol,2011,22(2):149-53,196.
[7]Elvang A B,Volbracht C,Pedersen L ?,et al.Differential effects of gamma-secretase and BACE1 inhibition on brain Abeta levelsin vitroandin vivo[J].J Neurochem,2009,110(5):1377-87.
[8]孫 琰,周文霞,張永祥.RNAi技術在阿爾采末病防治研究中的應用[J].中國藥理學通報,2009,25(11):1408-11.
[8]Sun Y,Zhou W X,Zhang Y X.Applications of RNAi technology in Alzheimer’s diseases[J].Chin Pharmacol Bull,2009,25(11):1408-11.
[9]張紅梅,張 雄,李 昱.姜黃素對阿爾采末病中APP淀粉樣酶切途徑的調控作用[J].中國藥理學通報,2009,25(3):361-6.
[9]Zhang H M,Zhang X,Li Y.The regulation of Curcumin on the amyloidogentic pathaway of APP in Alzheimer’s disease[J].Chin Pharmacol Bull,2009,25(3):361-6.
[10]Yan R,Han P,Miao H,et al.The transmembrane domain of the Alzheimer’s beta-secretase(BACE1)determines its late Golgi localization and access to beta-amyloid precursor protein(APP)substrate[J].J Biol Chem,2001,276(39):36788-96.
[11]Kinoshita A,Fukumoto H,Shah T,et al.Demonstration by FRET of BACE interaction with the amyloid precursor protein at the cell surface and in early endosomes[J].J Cell Sci,2003,116(Pt 16):3339-46.
[12]Thomas R S,Liddell J E,Murphy L S,et al.An antibody to the beta-secretase cleavage site on amyloid-beta-protein precursor inhibits amyloid-beta production[J].J Alzheimers Dis,2006,10(4):379-90.

