L-纈氨酸旋光異構的兩種光反應可能途徑
馬馳騁 蒲 敏,* 衛 敏 李軍男 李志宏
(1北京化工大學,化工資源有效利用國家重點實驗室,北京100029; 2中國科學院高能物理研究所同步輻射實驗室,北京100049)
L-纈氨酸旋光異構的兩種光反應可能途徑
馬馳騁1蒲 敏1,*衛 敏1李軍男1李志宏2
(1北京化工大學,化工資源有效利用國家重點實驗室,北京100029;2中國科學院高能物理研究所同步輻射實驗室,北京100049)
利用密度泛函理論(DFT)和從頭算分子軌道理論對L-纈氨酸的旋光異構光反應機理進行了研究.分別用B3LYP和MP2方法在6-311++G(d,p)基組級別上全優化得到了S0和T1態反應路徑上的反應物、產物、中間體以及過渡態結構的幾何構型,給出了反應能壘,利用含時密度泛函理論(TD-DFT)中的B3LYP/6-311++G(d, p)方法優化得到了S1態反應路徑上的平衡態幾何構型.通過分析反應途徑上各個駐點的幾何構型特征,確定了L-纈氨酸在激發態可能通過手性碳上的氫原子以羰基氧或氨基氮為中轉媒介發生質子遷移來完成旋光異構反應.進一步用自洽反應場理論中的極化連續模型(PCM)方法探討了溶劑化效應對旋光異構反應機理的影響.
纈氨酸;旋光異構;密度泛函理論;從頭算分子軌道理論;溶劑化效應
1 引言
氨基酸消旋現象的研究在化學及生命科學中是一個十分重要且復雜的課題,對確定化石年代、預測老齡化、治療疾病(如阿爾茨海默氏病)和生產光學純氨基酸都有著重要的作用.1-7纈氨酸是人體和其他許多生物所必需的8種氨基酸之一,如果缺乏會引起神經障礙、發育緩慢、消瘦和貧血等疾病.8-10D-纈氨酸是一種重要的有機手性源,廣泛應用于生物、醫學研究以及藥物合成中,11-13但在自然界中纈氨酸主要以L型存在,探討纈氨酸的旋光異構對控制L-纈氨酸的消旋現象和尋找D-纈氨酸的制備方法有重要的科學價值.
Dakin14在1910年提出的溶劑中氨基酸的消旋機理中指出,在最初的限速步驟中,L型氨基酸中α碳上的質子脫落,留下一個平面碳負離子后,圍繞在周圍的質子可以從兩個方向攻擊α碳,然后形成L型氨基酸或D型氨基酸.基于上述機理,Neuberger15推測,“高濃度的質子”更容易使游離的氨基酸消旋.這個機理表明兩個質子是從兩性離子的氨基上和次甲基碳上失去的.16按照Neuberger的方法, Smith和Sivakua17在1983年通過研究苯氨基乙酸消旋動力學證實了氨基酸的這種消旋機制.
對于單一的氣相氨基酸分子,Sullivan等18基于量子化學計算提出了一個不同的反應機理,在其中,氫原子從手性碳上脫落,越過能壘,最后連接在氨基基團上形成中間體,而氨基基團上的另外一個氫原子遷移回到手性碳原子上,反應的能壘約為300 kJ·mol-1,由于位壘過高,這樣的反應過程在溫度較低的情況下很難發生.Wei等19,20指出在紫外線或陽光照射條件下L型氨基酸的晶體(L-Tyr)通過旋光異構反應可以得到D型氨基酸,但是插入層狀雙金屬氫氧化物(水滑石)之間的L型氨基酸則不會出現這種現象,Sullivan等18提出的有關L型氨基酸發生旋光異構的理論模型無法解釋此實驗現象,而應用激發態理論則可以對涉及光反應的化學過程加以描述和解釋.
纈氨酸作為含有五個碳原子的支鏈非極性α氨基酸,相比于絕大多數手性氨基酸具有簡單的幾何構型,而其相對于具有最簡單的幾何構型的丙氨酸在-R基上可以提供較明顯的空間效應.因此本文利用量子化學方法對L-纈氨酸的旋光異構光反應機理進行了研究,并討論了溶劑化效應對反應機理的影響有著特殊的意義.
2 計算方法
利用密度泛函理論(DFT)和從頭算方法分別在B3LYP/6-311++G(d,p)以及MP2/6-311++G(d,p)水平上全優化基態(S0態)和第一激發三重態(T1態)的反應物(L-纈氨酸,即為L-VAL)、中間體(L-IM, D-IM)、產物(D-纈氨酸,即為D-VAL)以及過渡態(TS?、TSII、TSIII)的幾何構型,用含時密度泛函理論(TD-DFT)方法優化第一激發單重態(S1態)的反應物和產物的幾何構型.用極化連續模型(PCM)方法進行溶劑化效應計算.全部計算采用Gaussian 09量子化學計算程序.21
3 結果與討論
計算結果表明,L-VAL旋光異構反應包括兩條可能反應路徑,每一條途徑都有三個反應步驟(如圖1所示),即L-VAL首先由手性碳原子上的質子氫發生分子內遷移形成L-IM,然后L-IM通過單鍵旋轉形成D-IM,D-IM再通過質子氫的遷移形成最終的D-VAL.反應途徑以TSII為界具有對稱性,反應的最終步驟可看作初始步驟的逆反應,D-IM與L-IM, D-VAL與L-VAL是具有鏡面對稱性的旋光異構體,其鍵長鍵角完全一致,二面角絕對值相同,數值相反.反應的初始步驟主要在于接受質子的中轉媒介分別是羰基上的O和氨基上的N,下面將分別對其進行討論.

圖1 L-纈氨酸旋光異構反應路徑示意圖Fig.1 Schematic diagram of the paths of L-valine optical isomerization
3.1 纈氨酸和中間體幾何結構特征
L-VAL在S0、T1和S1態的結構模型如圖2所示.基態氣相纈氨酸分子的構象在文獻中已有較多討論,22本文計算得到的纈氨酸幾何構型參數和振動頻率與其結果基本一致,最顯著的特征是分子內-COOH的H與-NH2的N的氫鍵相互作用,H和N之間的距離只有0.188 nm.在進行幾何結構優化之前,曾反復設定L-VAL為兩性離子形式的不同初始構型,即H與N為成鍵模式,但優化結果仍得到的是氫鍵形式,這表明纈氨酸分子的氫鍵形式比兩性離子形式更穩定,這與Li等23在文獻中所報道的結果相符.在T1態,L-VAL的C(3)-C(1),O(5)-C(3)和H(4)—C(1)的鍵長相對S0態都有所增加,二面角N(2)C(1)C(3)O(5)和O(6)C(3)C(1)O(5)的改變更為明顯,尤其是后者從一個幾乎是筆直的角度(-178.28°)扭轉到-128.94°.在S1態,L-VAL的C(3)-C(1),O(5)-C(3)和H(4)-C(1)鍵長相對于S0態有所增加,但沒有T1態明顯,而二面角O(6)C(3)C(1)O(5)為-134.17°,也沒有T1態扭轉程度大.
用DFT方法在L-VAL旋光異構的兩條反應路徑上分別優化得到了S0和T1態的兩種中間體,即以羰基氧為中轉媒介反應路徑上的烯醇式中間體(L-IM-(O),D-IM-(O))和以氨基氮為中轉媒介反應路徑上的兩性離子中間體(L-IM-(N),D-IM-(N))(如圖3所示).曾嘗試用TD-DFT方法優化對應S1態的中間體的幾何構型,但優化結果始終不收斂,故未確定S1態中間體構型.
在S0態,L-IM-(O)的C(3)-C(1)距離為0.134 nm,O(5)-C(3)的鍵長為0.137 nm,近似于O(6)-C(3)的鍵長(0.138 nm),同樣H(4)-O(5)與H(7)-O(6)鍵長都約為0.096 nm,二面角N(2)C(1)C(3)O(5)幾乎是0°,這表明N(2)、C(1)、C(3)、C(10)、O(5)和O(6)在同一平面,C(1)已不再是手性C原子,并可以從兩個方向接受遷移的質子氫.在T1態,L-IM-(O)的幾何構型變化非常明顯,N(2)、C(1)、C(3)、C(10)、O(5)和O(6)原子已不在同一平面,C(1)-N(2)鍵幾乎垂直于C(3)、O(5)和O(6)所在的平面,二面角N(2)C(1)C(3)O(5)從基態的11.25°扭轉到69.79°.
在S0態,L-IM-(N)的C(3)-C(1)距離為0.139 nm,H(4)-N(2)的鍵長與H(8)-N(2),H(9)-N(2)的鍵長幾乎相同(0.103 nm),二面角C(3)C(1)N(2) H(4)為-118.44°,二面角C(3)C(1)N(2)C(10)幾乎是近似為180°,這意味著N(2)、C(1)、C(3)、C(10)在同一平面,C(1)已不再是手性C原子,并可以從兩個方向接受遷移的質子氫.在T1態,L-IM-(N)的幾何構型相對于基態的變化并不十分明顯.

圖2 L-纈氨酸在不同態的幾何結構模型Fig.2 Structural models of L-valine on different states (a)S0state;(b)T1state;(c)S1state

圖3 兩種中間體在不同態下的幾何結構模型Fig.3 Structural models of two kinds of intermediates on different states(a)L-IM-(O)on S0state;(b)L-IM-(O)on T1state;(c)L-IM-(N)on S0state;(d)L-IM-(N)on T1state
3.2 S0和T1態過渡態的結構特征
在L-VAL的旋光異構反應中,從L-VAL到L-IM是手性碳原子上的質子氫發生分子內遷移的過程,質子氫的遷移有兩條可能的路徑.下面對這兩條質子遷移路徑上的過渡態分別進行說明.
如圖4所示,第一條反應路徑上,在S0態,過渡態TSI-(O)的C(3)-C(1)鍵長從L-VAL的0.155 nm下降到0.144 nm,O(5)-C(3)的鍵長從0.120 nm增加到0.129 nm,最為顯著的變化是C(1)-H(4)的距離從0.110 nm變為0.158 nm,相應的O(5)-H(4)的距離從0.288 nm縮小到0.123 nm,角H(4)-C(1)-C(3)從104.76°減小到63.43°,另一個顯著的結構變化是二面角N(2)C(1)C(3)O(5)沿著C(1)-C(3)的方向的扭轉了約55°,使羧基O(5)位于一個有利的位置來接受遷移的質子.在T1態,TSI-(O)鍵長和二面角的變化與基態的變化趨勢一致,相對于基態鍵長O(5)-C(3),O(6)-C(3)和C(3)-C(1)分別有所增加,二面角N(2)C(1)C(3)O(5)則減小.第二條反應路徑上在S0態,過渡態TSI-(N)中的C(3)-C(1)的鍵長從反應物的0.155 nm下降到0.142 nm,N(2)-C(1)的鍵長從0.148 nm增加到0.159 nm,最為顯著的變化是C(1)-H(4)的距離從0.110 nm變為0.137 nm,相應的N(2)-H(4)的距離從0.207 nm縮小到0.117 nm,角H(4)-C(1)-N(2)從106.19°減小到45.81°,另一個顯著的結構變化是二面角C(3)C(1)N(2)H(8)沿著C(1)-N(2)的方向的扭轉了約75°,使氨基上的N(2)位于一個有利的位置來接受遷移的質子.在T1態,TSI-(N)鍵長和二面角的變化與基態的變化趨勢一致,結構性變化并不明顯.
旋光異構反應過程中若中轉媒介上的質子氫要從另一方向遷移回手性C(1)原子上,L-IM必先通過TSII轉變成D-IM.第一條路徑上過渡態TSII-(O)主要變化是二面角N(2)C(1)C(3)O(5)沿著C(1)-C(3)的方向扭轉,使得質子氫可以在接下來的反應中處于更有利的遷移位置.第二條路徑上過渡態TSII-(N)主要表現的是二面角C(3)C(1)N(2)H(8)沿著C(1)-N(2)的方向扭轉,使得質子H可以在接下來的反應中處于更有利的遷移位置.
D-IM通過TSIII最終轉變為D-VAL,其過程可看作是從L-VAL到L-IM反應的逆過程,中轉媒介上的質子氫發生分子內遷移向手性C原子靠近并最終與之形成C-H鍵.在計算的TSIII和TSI的結構參數中,鍵長與鍵角均對應相等,二面角絕對值相同,符號相反.
3.3 L-VAL的旋光異構光反應機理
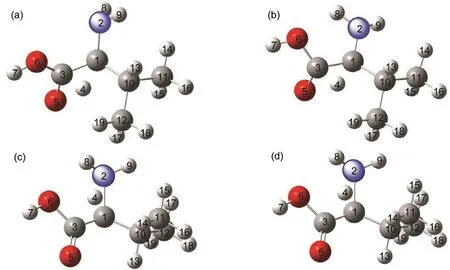
圖4 兩種過渡態(TSI)在不同態下的幾何結構模型Fig.4 Structural models of two kinds of transition state(TSI)on different states (a)TSI-(O)on S0state;(b)TSI-(O)on T1state;(c)TSI-(N)on S0state;(d)TSI-(N)on T1state

表1 利用不同方法和6-311++G(d,p)基組計算的包含零點能校正的S0態各物種相對能量Table 1 Relative energies including zero-point energy corrections computed by different methods and 6-311++G(d,p)basis set on S0state
根據反應過程中各物種的能量可以確定反應的能壘,為了直觀起見,表1給出了包含S0態零點能校正的以L-VAL能量為基準,分別用B3LYP/6-311++G(d,p)以及MP2/6-311++G(d,p)方法計算得到的各物種的相對能量.計算數據表明密度泛函和從頭算方法對反應能壘的影響相差較小,不超過10 kJ·mol-1,這表明B3LYP與MP2方法均適合于研究L-VAL旋光異構反應路徑上各物種的分子結構.由于L-VAL旋光異構光反應途徑為對稱途徑,反應途徑上L-VAL與D-VAL、L-IM與D-IM、TSI與TSIII的能量均對應相等.根據密度泛函方法計算得到的L-VAL旋光異構反應能量變化如圖5所示,在S0態下,沿著兩條氫遷移路徑,其中每條反應路徑上都需要跨過三個能壘,第一條路徑上的能壘分別為300.39、11.62和194.29 kJ·mol-1;第二條路徑上的能壘分別為253.50、11.03和107.83 kJ·mol-1.其中第一個和第三個能壘即反應通過TSI和TSIII時的能壘很高,因此纈氨酸在S0態發生旋光異構的可能性很小,尤其是纈氨酸形成中間體的第一個能壘達到300 kJ·mol-1以上,這正是氨基酸在常溫下很難發生消旋現象的原因.
通常光反應機理都極為復雜,結構性的變化決定了各態能量的變化,在T1態時反應過程的能壘下降十分明顯.如圖5所示,第一條路徑上L-VAL經過TSI-(O)到L-IM-(O),在基態時需要躍過300.39 kJ· mol-1的能壘,反應很難發生,因此,消旋現象的實驗研究都是在加熱或光照條件下進行的.19根據Frank-Condon原理以及計算結果可知,S0態L-VAL在紫外光照射下首先被垂直激發到S1態,然后弛豫到S1態的平衡態,能量為424.58 kJ·mol-1,由于S1態的反應位壘一般較低,L-VAL有可能通過S1態發生旋光異構反應,最后從S1態的D-VAL經過磷光過程回到S0態并完成最終的反應,但是S1態的壽命較短,在S1態進行的反應過程中極容易經過系間竄躍到達T1態,反應完全在S1態進行的可能性不大,由于未能優化出S1態上的L-IM、D-IM結構,所以在此不做深入的討論.另一種可能途徑是S1態L-VAL經過系間竄躍形成T1態L-VAL,然后在T1態克服55.83 kJ· mol-1的能壘經過TSI-(O)到L-IM-(O),此反應過程應該容易完成.L-IM-(O)有可能從T1態回落到S0態,雖然L-IM-(O)到D-IM-(O)只不過是經過了單鍵旋轉,反應能壘很低,反應極易進行,但是在S0態D-IM-(O)到D-VAL需要跨過194.29 kJ·mol-1的能壘,此過程并不十分容易發生,所以T1態L-IM-(O)也可能直接通過單鍵旋轉變成D-IM-(O)后躍過126.16 kJ·mol-1的能壘直接到達T1態的D-VAL,然后通過發射磷光落回到S0態完成最終的反應.以氨基N為中轉媒介的纈氨酸旋光異構反應途徑整體上與此相似.
3.4 溶劑化效應對該反應的影響

圖5 L-纈氨酸旋光異構反應在兩條反應途徑上的能量變化Fig.5 Energy variations of L-valine optical isomerization on two reaction paths (a,d)S0state;(b,e)T1state;(c,f)S1state

表2 在B3LYP/6-311++G(d,p)水平上得到的溶劑化效應對L-纈氨酸旋光異構反應各物種相對能量的影響Table 2 Influences of solvent effect on the relative energies of all species of L-valine optical isomerization at the level of B3LYP/6-311++G(d,p)
眾所周知,纈氨酸在水溶液中以電離的形式進行旋光異構反應,但是纈氨酸在非極性溶劑中或者蛋白質中的纈氨酸殘基在水溶液中是無法電離的,在這種情況下纈氨酸的旋光異構反應與氣態時的形式一樣,那么此時溶劑對此旋光異構反應就存在一定的影響.24-26因此對上述反應要進行更深一步的探討.考慮到極性與非極性以及無機溶劑與有機溶劑等因素對旋光異構反應的影響,選擇無機極性溶劑水(H2O)與有機非極性溶劑四氯化碳(CCl4)作為溶劑對該反應進行溶劑化效應計算.表2給出了在B3LYP/6-311++G(d,p)水平上計算得到的已包含零點能校正的溶劑化效應對L-纈氨酸旋光異構反應各物種相對能量的影響,觀察能量變化可知CCl4的溶劑化效應對L-VAL的旋光異構反應影響不大, H2O的溶劑化效應對第一條反應途徑的影響同樣很小,但對第二條反應途徑有明顯的影響,尤其是第三個反應能壘相差了約30 kJ·mol-1.這可能是由于L-IM-(N)是兩性離子,H2O中的質子H易與L-IM-(N)中的C負離子形成氫鍵,從而對分子內質子H遷移回手性C上形成阻礙,導致能壘偏高.溶劑化效應對旋光異構反應途徑上各物質能量都有降低趨勢的影響,無機極性溶劑(H2O)對能量影響相對有機非極性溶劑(CCl4)更大一些.對比基態與激發態反應途徑上各物質能量變化可知溶劑化效應對其影響同樣不大.
4 結論
利用B3LYP和MP2方法在6-311++G(d,p)的計算水平上對L-VAL旋光異構反應進行了研究,通過分析反應物、中間體和產物的結構變化發現了分別以羰基氧原子和氨基氮原子為中轉媒介的兩條可能的質子遷移反應路徑.
分析L-VAL在S0、T1和S1態反應過程中能量的變化,可以推測L-VAL的旋光異構光反應機理.由于S0態反應位壘較高,在基態發生旋光異構反應的可能性很小.在光反應條件下,紫外光首先使LVAL激發到S1態,并弛豫到局部穩定點.由于S1態的反應位壘一般較低,有可能通過S1態發生旋光異構反應,但通常S1態的壽命較短,反應完全在S1態進行的可能性不大.反應過程中隨時有可能從S1態經過系間竄躍到達T1態.在光激發后,S1態L-VAL也可以經過系間竄躍到達T1態L-VAL,然后發生手性碳質子氫的分子內遷移,躍過能壘,連接在中轉媒介羰基氧原子或氨基氮原子上形成T1態的L-IM,并通過單鍵旋轉轉變為T1態的D-IM.連接在中轉媒介上的質子氫再次進行分子內遷移,從另一側與手性碳相連,反應經過磷光過程,進入S0態并最終生成產物D-VAL.
通過溶劑化效應的計算可以看出,CCl4的溶劑化效應對L-VAL旋光異構反應的影響較小,H2O的溶劑化效應對第二條反應途徑有明顯的阻礙作用.溶劑化效應對旋光異構反應途徑上各物質能量都有降低趨勢的影響,對基態與激發態反應途徑上各物質能量變化影響不大,無機極性溶劑對能量的影響相對有機非極性溶劑更大一些.
(1)Minami,M.;Takeyama,M.;Mimura,K.;Nakamura,T.Nucl. Instrum.Methods Phys.Res.Sect.B 2007,259,547.doi: 10.1016/j.nimb.2007.01.201
(2)Amelung,W.;Zhang,X.;Flach,K.W.Geoderma 2006,130, 207.doi:10.1016/j.geoderma.2005.01.017
(3) Sajdok,J.;Kozak,A.;Zidkova,J.;Kotsba,P.;Pilin,A.;Kas,J. Chem.Listy 2001,95,98.
(4)Tomiyama,T.;Asano,S.;Furiya,Y.;Shirasawa,T.;Endo,N.; Mori,H.J.Biol.Chem.1994,269,10205.
(5) Friedman,M.J.Agric.Food Chem.1999,47,3457.doi: 10.1021/jf990080u
(6) Martineau,M.;Baux,G.;Mothet,J.P.J.Physiol.-Paris 2006, 99,103.doi:10.1016/j.jphysparis.2005.12.011
(7) Chu,Y.Q.;Pan,T.T.;Dai,Z.Y.;Yu,Z.W.;Zheng,S.B.;Ding, C.F.Acta Phys.-Chim.Sin.2008,24,1981. [儲艷秋,潘婷婷,戴兆云,俞卓偉,鄭松柏,丁傳凡.物理化學學報,2008,24, 1981.]doi:10.3866/PKU.WHXB20081108
(8) Qi,J.Studies on Configuration Transformation of L-Proline and L-Valine.M.S.Dissertation,Nanchang University,Jiangxi, 2006.[漆 劍.L-脯氨酸和L-纈氨酸構型轉換的研究[D].南昌:南昌大學,2006.]
(9) Mei,L.H.;Yao,S.J.;Guan,Y.X.;Lin,D.Q.Chinese Journal of Pharmaceuticals 1999,30(5),235.[梅樂和,姚善涇,關怡新,林東強.中國醫藥工業雜志,1999,30(5),235.]
(10)Chen,Y.;Wang,W.Q.;Du,W.M.Acta Phys.-Chim.Sin.2004, 20,540. [陳 渝,王文清,杜為民.物理化學學報,2004,20, 540.]doi:10.3866/PKU.WHXB20040519
(11) Frauli,M.;Ludwig,H.Arch.Gynecol.Obstet.1987,241,87. doi:10.1007/BF00931229
(12)Picciano,P.T.;Johnson,B.;Walenga,R.W.;Donovan,M.; Douglas,B.J.;Kreutzer,D.L.Exp.Cell Res.1984,51,134.
(13) Li,A.P.;Zhao,Q.;Cheng,X.C.;Xu,H.Q.Journal of Anhui Agricultural Sciences 2010,38(14),7208. [李愛平,趙 青,程曉春,徐海青.安徽農業科學,2010,38(14),7208.]
(14)Dakin,H.D.Am.Chem.J.1910,44,48.
(15) Neuberger,A.Adv.Protein Chem.1948,4,297.doi:10.1016/ S0065-3233(08)60009-1
(16) Ebbers,E.J.;Ariaans,G.J.A.;Houbiers,J.P.M.;Bruggink,A.; Zwanenburg,B.Tetrahedron 1997,53,9417.doi:10.1016/ S0040-4020(97)00324-4
(17) Smith,G.G.;Sivakua,T.J.Org.Chem.1983,48,627.
(18) Sullivan,R.;Pyda,M.;Pak,J.;Wunderlich,B.;Thompson,J. R.;Pagni,R.;Pan,H.;Barnes,C.;Schwerdtfeger,P.;Compton, R.J.Phys.Chem.A 2003,107,6674.doi:10.1021/jp0225673
(19)Wei,M.;Xu,X.Y.;He,J.;Yuan,Q.;Rao,G.Y.;Evans,D.G.; Pu,M.;Yang,L.J.Phys.Chem.Solids 2006,67,1469.doi: 10.1016/j.jpcs.2006.01.118
(20) Wei,M.;Pu,M.;Guo,J.;Han,J.B.;Li,F.;He,J.;Evans,D.G.; Duan,X.Chem.Mater.2008,20,5169.doi:10.1021/ cm800035k
(21) Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 09, RevisionA.01;Gaussian Inc.:Wallingford,CT,2009.
(22) Linder,R.;Nispel,M.;Haber,T.;Kleiermanns,K.Chem.Phys. Lett.2005,409,260.doi:10.1016/j.cplett.2005.04.109
(23) Li,J.;Brill,T.B.J.Phys.Chem.A 2003,107,5993.doi: 10.1021/jp022477y
(24) Gomzi,V.;Herak,J.J.Mol.Struct.-Theochem 2003,629,71.
(25) Ren,X.H.Theoretical Study of Interaction between Solvent andAminoAcids.M.S.Dissertation,Jiangnan University, Jiangsu,2008.[任曉慧.氨基酸分子與溶劑間相互作用的理論研究[D].無錫:江南大學,2008.]
(26)Yu,Y.;Huang,D.F.;Wang,D.X.Chin.J.Chem.Phys.2005, 18,336. [俞 英,黃東楓,王大喜.化學物理學報,2005,18, 336.]
March 27,2012;Revised:May 15,2012;Published on Web:May 16,2012.
Two Possible Photoreaction Pathways of L-Valine Optical Isomerization
MAChi-Cheng1PU Min1,*WEI Min1LI Jun-Nan1LI Zhi-Hong2
(1State Key Laboratory of Chemical Resource Engineering,Beijing University of Chemical Technology,Beijing 100029,P.R.China;2BeijingSynchrotronRadiationFacility,InstituteofHighEnergyPhysics,ChineseAcademyofSciences,Beijing100049,P.R.China)
The photoreaction mechanism of L-valine optical isomerization is studied by density functional theory(DFT)and ab initio molecular orbital theory.The geometric parameters of reactant,product, intermediates,and transition states,as well as the reaction energy barriers,on the reaction paths in S0and T1states are optimized at the B3LYP and MP2 levels using the 6-311++G(d,p)basis set.The equilibrium geometries of the S1state of valine are optimized using time dependent density functional theory(TD-DFT)at the B3LYP/6-311++G(d,p)level.From the analysis of each geometric stationary point on the reaction path, the photoreaction mechanism of L-valine optical isomerization is proposed.The reaction proceeds via hydrogen transfer with the help of carbonyl O or amino N atom in the excited state.Furthermore,the effect of solvent on the isomer reaction mechanism is discussed based on the polarizable continuum model (PCM)of self-consistent reaction field theory.
Valine;Optical isomerization;Density functional theory;Ab initio molecular orbital theory; Solvent effect
10.3866/PKU.WHXB201205162
O641
?Corresponding author.Email:pumin@mail.buct.edu.cn;Tel:+86-10-64443922.
The project was supported by the National Natural Science Foundation of China(21173019,11079041).
國家自然科學基金(21173019,11079041)資助項目