外源NO對不同作物種子萌發、幼苗生長及抗氧化酶活性的影響
張秀瑋,董元杰,邱現奎,王全輝,王艷華,胡國慶
(山東農業大學資源與環境學院,山東泰安271018)
一氧化氮(Nitric oxide,NO)是廣泛分布于生物體內的水溶性和脂溶性氣體小分子信號物質。近年發現NO在植物中參與了生長發育和對外界脅迫反應等多種生理過程[1-2]:NO 能夠促進種子萌發,縮短種子休眠期[3];調節植物的成熟和衰老[4];抑制植物開花[5]等。作為一種抗氧化劑和氧化劑,NO在植物細胞中具有雙重作用:適度的NO能夠促進植物的生長和發育,提高植物的抗逆性[6];過量的NO破壞光合作用和電子傳遞鏈,抑制植物的生長發育,造成DNA損傷和細胞死亡[7]。
NO作為生物體內的信號分子,在植物生長發育以及應答干旱、鹽、冷和病原菌侵染等逆境脅迫反應中起重要作用[8-9]。研究表明,NO對植物生長的作用具有雙重性,既可促進植物生長,又可起抑制作用,具體表現依其濃度、作用部位及生理條件不同而異[10-11]。Leshem[12]報道,1 μmol/L 外源 NO 即可明顯促進豌豆葉片生長,并抑制乙烯產生。用多種NO供體處理離體培養的玉米根,發現根尖的生長與藥品濃度成正相關,但可被亞甲基藍抑制[13]。硝普鈉(Sodium nitroprusside,SNP)常被作為NO的供體研究外源NO對植物生長的作用。
目前,關于外源NO調節種子萌發和幼苗生長的研究多以某一種作物作為研究對象,揭示NO在逆境脅迫條件下對作物生長的緩解效應。而有關正常生長條件下外源NO對作物生長調節的研究較少,且不同作物適宜其生長的外源NO濃度也是不同的。因此,本試驗選取了玉米、小麥、花生、小白菜、蘿卜、黃瓜這些具有代表性的作物為試驗材料。玉米和小麥是重要的糧食作物,花生是廣泛種植的油料作物,小白菜是重要的葉菜類蔬菜,蘿卜屬于根菜類蔬菜,黃瓜是果菜類蔬菜。本文研究了4種不同濃度的外源NO對以上幾種典型作物種子萌發、幼苗生長及抗氧化酶活性的影響,并討論了NO對作物生長發育的影響與作物不同種類的關系。一方面為探索NO調節植物生長的作用機理奠定基礎,另一方面以多種典型作物作為研究對象,明確了適合不同作物生長的適宜外源NO濃度,為推廣和促進NO在農業生產實踐上的應用提供理論依據。
1 材料與方法
1.1 供試材料
供試材料有糧食作物:玉米(Zea mays L.)“泰玉七號”、小麥(Triticum aestivum L.)“魯麥22”、花生(Arachis hypogaea L.)“小白沙”。蔬菜作物:小白菜(Brassica chinensis L.)“四月慢”、蘿卜(Raphanus sativus L.)“大青蘿卜三號”、黃瓜(Cucumis sativus L.)“津春四號”。
試驗在山東農業大學資環學院植物營養學實驗室進行。選取籽粒飽滿、大小均勻、無病蟲害的種子,用蒸餾水浸種30 min,然后培養在墊有三層濾紙的直徑為10 cm的培養皿內,進行常規發芽實驗。試驗設4個處理:1)CK,蒸餾水處理;2)0.01 mmol/L SNP;3)0.1 mmol/L SNP;4)1.0 mmol/L SNP,SNP溶液要現配現用,每個處理設三次重復,每個重復50粒種子。在培養箱內24℃黑暗條件下培養,發芽后再用SNP溶液作為培養基,在溫度為24℃,光強 100 μmol E/(m2·s),光照時間 12 h/d的培養箱中培養。花生種子由于發芽較慢,培養10 d,其它培養7 d。每天早9點,晚17點更換處理液,由于各種作物種子大小不同,花生、玉米種子每次澆15 mL處理液,小麥、黃瓜種子每次澆10 mL,小白菜種子每次澆5 mL。
1.2 測定項目及方法
1.2.1 發芽勢、發芽率的測定 未經SNP處理的種子發芽數達到一半時,統計各組發芽數,為發芽勢。長粒種子以芽長達到種子長度的1/2為發芽標準,圓粒種子以露白為發芽標準。發芽結束時,統計各組發芽數,為發芽率。
發芽勢(%)=對照發芽一半時正常幼苗數/供試種子粒數×100
發芽率(%)=第7 d(花生幼苗10 d)正常幼苗數/供試種子粒數×100
1.2.2 苗高、根長的測定 處理7 d后(花生幼苗10 d)從每組中選取10株幼苗用直尺直接測定其苗高、根長(直根系作物測主根長,須根系作物測最長根長)。
1.2.3 根系活力的測定 幼苗處理7 d后(花生幼苗10 d)采用 TTC 法[14]測定。
1.2.4 抗氧化酶活性、丙二醛(MDA)及可溶性蛋白含量的測定 SOD活性測定采用氮藍四唑(NBT)法[15];POD 活性測定采用愈創木酚法[16];CAT 活性測定采用紫外分光光度法[15];MDA含量測定采用硫代巴比妥酸法[15];可溶性蛋白含量測定采用考馬斯亮藍 G-250染色法[15]。
1.3 數據分析
采用DPS 7.05軟件對數據進行統計分析,采用最小顯著極差法(LSD)進行差異顯著性檢驗(P<0.05)。
2 結果與分析
2.1 外源NO對種子萌發的影響
與對照相比,0.01 mmol/L SNP處理玉米和小麥種子,發芽勢分別提高了21.7%和25.6%;0.1 mmol/L SNP處理,玉米、小麥、花生的發芽勢分別提高了 38.6%、38.9%、38.5%(圖 1);0.01 mmol/L SNP處理玉米種子發芽率提高了8.7%;0.1 mmol/L SNP處理小麥和花生種子發芽率分別提高了7.5%、6.1%(圖1),差異均達顯著水平,而1.0 mmol/L SNP處理對玉米和花生種子萌發均有顯著抑制作用。不同濃度SNP對小麥種子發芽勢的影響最為顯著。表明外源NO對種子萌發的影響表現為低濃度促進而高濃度抑制,適宜濃度的外源NO處理可加快種子萌芽速度,提高種子發芽率,且對不同作物種子影響的差異性與作物種類有關。
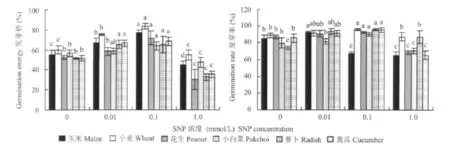
圖1 外源NO對不同作物種子萌發的影響Fig.1 Effects of NO on germination of different plant species seeds
SNP可顯著影響蔬菜種子的萌發。與對照相比,0.01 mmol/L SNP處理蘿卜、黃瓜種子發芽勢分別提高了27.3%、29.9%;0.1 mmol/L SNP處理小白菜、蘿卜、黃瓜種子發芽勢分別提高了12.9%、27.3%、33.8%,差異均達顯著水平;采用 1.0 mmol/L SNP處理發芽勢降低(圖1)。0.01 mmol/L SNP處理的蘿卜種子發芽率提高了26.1%;0.1 mmol/L SNP處理的小白菜、蘿卜、黃瓜種子發芽率分別提高了13.4%、28.8%、11.7%,差異均達顯著水平。1.0 mmol/L SNP處理的蘿卜種子發芽率提高了18.0%,小白菜和黃瓜種子萌發受抑制(圖1)。可見,外源NO對黃瓜種子發芽勢的影響最為顯著;0.01~1.0 mmol/L SNP處理均可不同程度地提高蘿卜種子的發芽率,0.1 mmol/L SNP處理的促進效果最顯著,說明外源NO對作物種子萌發的影響與不同的作物種類有關,濃度過高會抑制萌發。
2.2 外源NO對幼苗苗高、根長的影響
與對照相比,0.1 mmol/L SNP處理對玉米、小麥、花生幼苗地上部生長均有顯著的促進作用,對小麥促進效果最顯著;1.0 mmol/L SNP處理抑制了玉米和花生幼苗地上部生長,對小麥的促進效果比0.1 mmol/L SNP處理稍弱(圖2)。0.1 mmol/L SNP顯著促進了3種糧食作物幼苗根系的伸長;而1.0 mmol/L SNP處理抑制了根系的生長,花生受抑制程度最小。不同濃度的SNP對玉米幼苗根長的影響最顯著(圖2),說明外源NO對作物幼苗地上部生長和根系伸長的影響表現為低濃度促進,高濃度抑制,不同作物對外源NO的敏感程度不同。
與對照相比,0.01 mmol/L SNP處理顯著促進了黃瓜幼苗地上部生長;0.1 mmol/L SNP對3種蔬菜作物的生長均有顯著促進作用,對黃瓜促進效果最顯著;1.0 mmol/L SNP處理促進了小白菜和蘿卜幼苗地上部生長,而對黃瓜無明顯的促進作用(圖2)。0.01 mmol/L SNP處理顯著促進了小白菜根系的伸長;0.1 mmol/L SNP處理可明顯改變作物根系形態,對3種蔬菜幼苗根系的伸長均起到了顯著的促進作用,對蘿卜促進效果最顯著;1.0 mmol/L SNP處理顯著抑制了3種作物根系的伸長,蘿卜受抑制程度最大(圖2)。以上數據表明,外源NO對蔬菜幼苗苗高和根系伸長的影響可能與蔬菜作物不同種類有關。
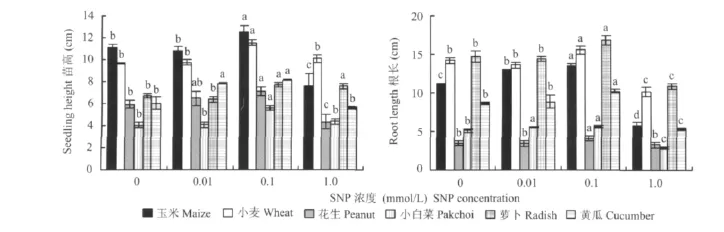
圖2 外源NO對不同作物幼苗苗高和根長的影響Fig.2 Effects of NO on the seedling height and root length of different plant species
2.3 外源NO對幼苗根系活力的影響
根系活力可反映植物根系的整體發育狀況。不同濃度SNP對糧食作物幼苗根系活力影響不同(表1)。0.01 mmol/L SNP處理顯著提高了玉米、小麥幼苗的根系活力;0.1 mmol/L SNP處理顯著提高了小麥、花生幼苗的根系活力;SNP濃度超過0.1 mmol/L時玉米的根系活力受到顯著抑制,且抑制程度隨濃度的增大而增大。說明適宜濃度的外源NO可提高作物根系活力,不同作物的根系對外源NO的敏感程度不同。
與對照相比,0.01 mmol/L SNP處理顯著提高了蘿卜、黃瓜的根系活力,其中蘿卜提高程度最顯著;3種蔬菜幼苗的根系活力在0.1 mmol/L SNP處理后均得到顯著提高;1.0 mmol/L SNP處理顯著降低了小白菜幼苗的根系活力,但又提高了蘿卜、黃瓜的根系活力;對黃瓜幼苗根系活力的提高幅度隨SNP濃度的增大而減小。不同濃度的SNP均可不同程度地提高蘿卜的根系活力,濃度超過0.1 mmol/L時對根系活力的提高程度下降,且隨濃度的升高下降幅度增大。說明外源NO可提高作物的根系活力,而過高濃度的NO可降低其根系活力。
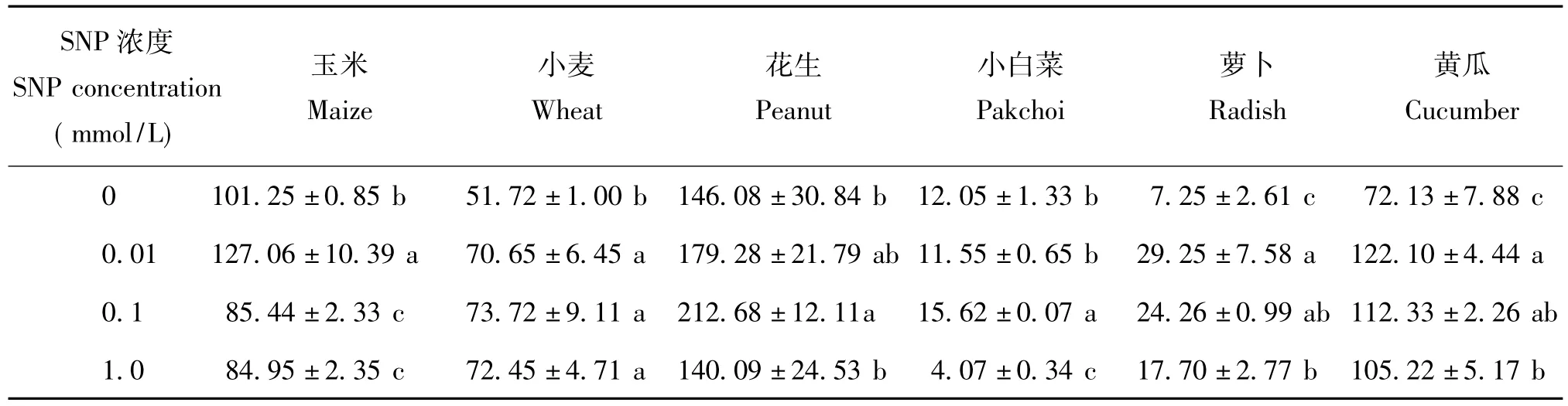
表1 外源NO對不同作物幼苗根系活力的影響[μg/(g·h),FW]Table 1 Effects of NO on seedling root activity of different plant species
2.4 外源NO對幼苗抗氧化酶活性的影響
不同濃度的SNP處理7 d后(花生幼苗10 d),0.1 mmol/L SNP處理的玉米、小麥、花生幼苗的POD活性均顯著高于對照,分別提高了38.4%、29.7%、36.1%(圖3);玉米、小麥SOD活性分別提高了22.0%、33.3%,花生不顯著(圖3);小麥、花生的CAT活性分別提高了82.6%、9.9%,玉米不顯著(圖3);0.01 mmol/L SNP處理的玉米CAT活性提高了21.4%,小麥CAT活性提高了62.3%,SOD活性提高了7.9%,差異顯著,其它均未達到顯著水平;1.0 mmol/L SNP處理小麥、花生CAT活性分別提高了36.1%、59.4%,差異顯著,而玉米的CAT活性比對照有所降低,玉米、小麥的POD活性比對照有所降低,其中小麥 POD活性降低了13.9%,差異顯著。玉米在0.01 mmol/L SNP條件下CAT活性提高程度最顯著,隨濃度升高提高程度降低,達到1.0 mmol/L時其活性受到抑制;玉米、小麥的POD活性在0.01~0.1 mmol/L的濃度范圍內隨濃度的升高而增加,達到1.0 mmol/L時活性降低。表明外源NO可以在一定程度上提高幼苗的抗氧化酶活性,濃度過高反而會降低其活性,且不同作物對外源NO的敏感程度不同。
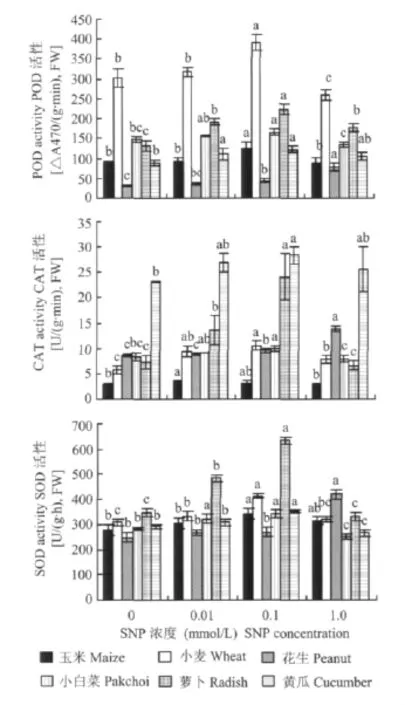
圖3 外源NO處理對不同作物幼苗抗氧化酶活性的影響Fig.3 Effects of NO on CAT,POD and SOD activities of different plant species
0.1 mmol/L SNP處理的小白菜、蘿卜、黃瓜的CAT、POD、SOD活性與對照相比均有顯著提高,CAT活性分別提高了19.0%、225.0%、22.6%,POD活性分別提高了12.2%、70.5%、37.9%,SOD活性分別提高了20.5%、82.0%、20.7%;0.01 mmol/L SNP處理的蘿卜、黃瓜的POD活性與對照相比分別提高了46.2%、23.9%,小白菜、蘿卜的SOD活性分別提高了13.7%、38.6%,差異顯著;1.0 mmol/L處理的蘿卜的POD活性與對照相比提高了35.3%,差異顯著,而小白菜、黃瓜的SOD活性與對照相比分別降低了12.3%、8.8%,差異顯著,其它不顯著。在0.01~0.1 mmol/L的濃度范圍內小白菜、蘿卜的CAT活性隨濃度的升高而增大,達到1.0 mmol/L時,活性降低,小白菜、蘿卜、黃瓜的SOD活性也表現出與CAT相近的趨勢(圖3)。
2.5 外源NO對幼苗MDA和可溶性蛋白含量的影響
表2表明,與對照相比,采用0.1 mmol/L SNP處理,玉米、小麥、花生、小白菜、蘿卜、黃瓜的MDA含量分別降低了20.8%、31.3%、27.9%、22.6%、20.9%、22.8%,差異顯著;0.01 mmol/L SNP處理小麥的MDA含量降低了21.2%,差異顯著,其它均不顯著;1.0 mmol/L SNP處理玉米MDA含量增加了 17.4%,差異顯著。在 0.01~0.1 mmol/LSNP濃度范圍內玉米、小麥、花生、小白菜、蘿卜、黃瓜的MDA含量呈現隨濃度的增大而降低的趨勢,濃度達到1.0 mmol/L時,MDA含量升高。
采用SNP處理,在0.01~0.1 mmol/L濃度范圍內玉米、小麥、花生、小白菜、蘿卜、黃瓜的可溶性蛋白含量均隨濃度的增大而升高,0.1 mmol/L SNP處理的小麥、花生、小白菜、蘿卜、黃瓜的可溶性蛋白含量與對照相比分別提高了30.5%、47.5%、57.6%、48.7%、10.1%,差異顯著;1.0 mmol/L SNP處理的玉米、小麥、花生、小白菜、蘿卜、黃瓜的可溶性蛋白含量均降低,與對照相比差異不顯著(表3)。這說明采用一定濃度的外源NO處理可降低作物MDA含量,提高可溶性蛋白含量,緩解膜的過氧化程度,而濃度過高則會導致MDA含量升高,可溶性蛋白含量降低,這是由于NO對植物體的作用具有雙重性,低濃度NO可作為抗氧化劑對ROS具有清除作用,緩解氧化損傷,但較高濃度的NO則可引發自由基鏈式反應,從而導致細胞損傷[10]。
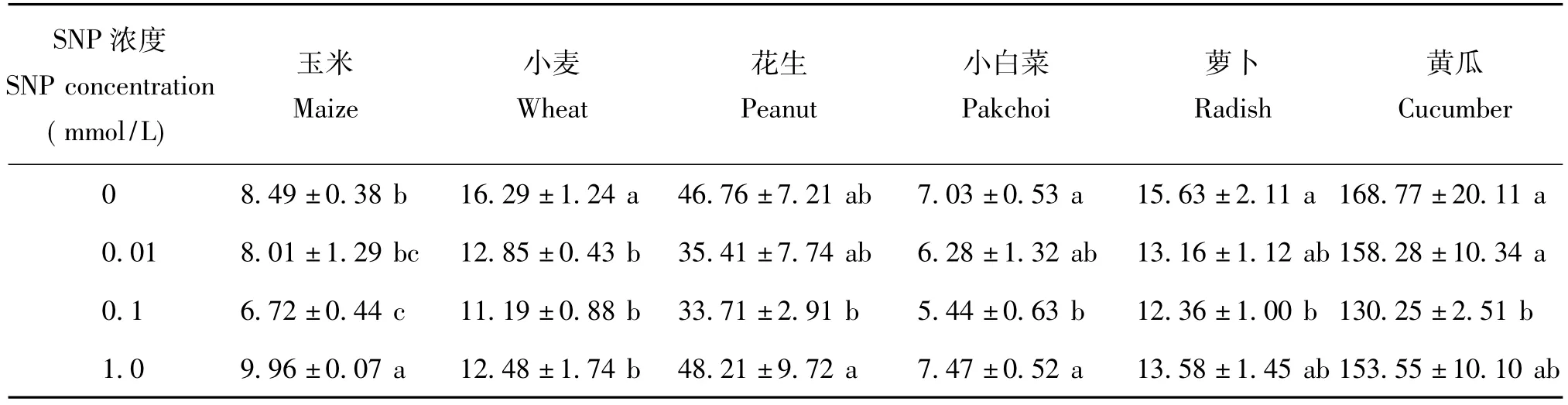
表2 外源NO對不同作物幼苗MDA含量的影響(nmol/g,FW)Table 2 Effects of NO on MDA contents of different plant species
3 討論
NO是一種無色、透明、結構簡單,同時具有脂溶性和水溶性的小分子生物自由基,可自由通過生物膜,在植物體內發揮生理作用。SNP是NO的一種供體,Delledonne等[1]報道0.5 mmol/L 的 SNP 約能釋 放 2.0 μmol/L NO。Bethke 等[17]和 Zhang等[18]的研究發現,NO可能作為一種信號分子參與打破種子休眠的過程。此外,外源NO供體SNP在逆境和正常條件下均能夠明顯促進植物種子的萌發,并可誘導β-淀粉酶的活性[19]。已有研究發現,低濃度(50~100 μmol/L)SNP可提高黑麥草種子的萌發率和發芽指數,100 μmol/LSNP處理其發芽率和發芽指數最高[20];用0.15、0.6 mmol/L SNP處理水稻種子均可提高種子發芽率,0.6 mmol/L SNP處理發芽率略高[21];羽扇豆(Lupinus luteus L.cv.Ventus)種子的萌發率與0.1~800 μm濃度范圍的SNP劑量成正比,而且在種子受到重金屬和鹽脅迫時仍具有促進作用[22];Beligni等[23]使用 NO供體硝普鈉(SNP)和 N-亞硝基 -乙酰青霉胺(SNAP)促使萵筍種子在黑暗條件下萌發,且種子的萌發率與SNP和SNAP的劑量成正比。本試驗用0、0.01、0.1、1.0 mmol/L SNP處理種子,發現在0.01~0.1 mmol/L濃度范圍內,SNP對種子萌發表現為促進作用,1.0 mmol/L SNP處理對多數種子表現為抑制作用,且對不同作物種子萌發的影響程度不同(圖1),這是由于NO信號在種子萌發過程中起著重要的作用[24-25],這與前人的研究成果是一致的。說明NO對種子萌芽表現為低濃度促進,高濃度抑制,對不同作物種子萌發的影響與作物種類有關。
已有研究發現,NO可代替生長素作用,促進側根及不定根生長發育[26-27]。劉建新等[20]用不同濃度的 SNP處理黑麥草,發現低濃度(50~100 μmol/L)SNP可提高黑麥草幼苗的苗高和根長,100 μmol/L SNP促進效果最顯著。凌騰芳等[21]發現0.15、0.60 mmol/L的SNP處理還能顯著促進鹽脅迫5 d期間的水稻幼苗地上部的生長,明顯提高幼苗的芽長和根長。聞玉等[28]用50 μmol/L SNP處理小麥幼苗,發現NO不僅能促進小麥側根的發育,增加側根的數目,而且也能促進小麥主根生長以增加主根長度,提高水分脅迫下根系活力。本試驗用不同濃度的SNP處理幾種糧食和蔬菜作物幼苗,發現在0.01~0.1 mmol/L濃度范圍內,SNP可促進作物幼苗的生長,0.1 mmol/L對作物幼苗苗高和根長的促進效果最顯著,通過檢測不同濃度SNP對作物根系活力的影響,發現對于玉米、蘿卜、黃瓜幼苗,0.01 mmol/L SNP對根系活力的提高作用最顯著,而對于小麥、花生、小白菜0.1 mmol/L提高效果最顯著(圖2),這與前人研究成果一致,說明適宜濃度的NO可促進作物幼苗的生長和根系活力的提高,且對不同作物的影響與作物種類有關。
SOD是清除生物體內超氧陰離子自由基的唯一酶類,POD和CAT是植物體內H2O2的清除酶,根據超氧化學說原理,SOD活性下降和MDA的存在表明細胞膜透性受到影響,從而影響了植物的正常生理代謝活動[29]。同時,植物可通過可溶性蛋白的積累來保護細胞膜表面。張遠兵等[30]發現,單獨用0.1 mmol/L的 SNP處理黑麥草,可提高黑麥草SOD、POD和CAT等保護酶活性,產生的超氧陰離子自由基下降,膜脂過氧化反應減弱,積累的MDA和質膜透性也低于對照。姜義寶等[31]發現0.1 mmol/L SNP減緩干旱脅迫下苜蓿幼苗細胞膜透性的增加,使CAT先升后降,SOD和POD活性持續升高。本試驗用0.1 mmol/L SNP處理玉米、小麥、花生、小白菜、蘿卜、黃瓜幼苗,各種作物幼苗的POD活性均顯著高于對照,玉米、小麥、小白菜、蘿卜、黃瓜SOD活性以及小麥、花生、小白菜、蘿卜、黃瓜的CAT活性均得到顯著提高(圖3)。同時外施0.1 mmol/L SNP,玉米、小麥、花生、小白菜、蘿卜、黃瓜的MDA含量與對照相比顯著降低。在0.01~0.1 mmol/L的濃度范圍內玉米、小麥、花生的可溶性蛋白含量均隨濃度的增大而升高。高濃度(1.0 mmol/L)的SNP處理則會抑制某些作物的抗氧化酶活性,導致作物MDA含量升高,可溶性蛋白含量降低(表2、表3)。說明適宜濃度的NO可以減輕作物幼苗細胞膜的膜質過氧化,維持了膜結構的完整性,有利于酶系統發揮正常功能,且NO對不同作物酶系統的保護作用與作物種類有關。
4 結論
外源NO供體SNP對多數種子萌發表現為低濃度(0.01~0.1 mmol/L)促進,高濃度(1.0 mmol/L)抑制,其中0.1 mmol/L SNP處理,蘿卜種子發芽率提高了28.8%,效果最顯著;低濃度SNP可有效促進植物幼苗地上部的生長以及根系的伸長,其中對小麥、黃瓜地上部的促進效果最顯著,而對蘿卜根系的促進效果最顯著;0.1 mmol/L SNP的處理對地上及根系生長的促進效果最顯著;0.1 mmol/L SNP對多數植物的根系活力促進效果最顯著,其中對蘿卜的促進效果最明顯;SNP對不同植物幼苗生長影響的差異性與作物種類有關。適宜濃度的SNP可以增加作物抗氧化酶活性,降低MDA含量,提高可溶性蛋白含量,不同作物SNP的適宜濃度不同。因此,在實際生產過程中,針對不同作物種類,可以選用適宜濃度的外源NO來促進作物種子萌發,并對作物幼苗的生長和生理生化特性進行調控。
[1]Delledonne M,Xia Y,Dixon R A et al.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394:585-588.
[2]Durner J,Wendehenne D,Klessig D F.Defense gene in duction in tobacco by nitric oxide,cyclic GMP,and cyclic ADP-ribose[J].Proc.Natl.Acad.Sci.USA,1998,95(17):10328 -10333.
[3]Bethke P C,Libourel I G L,Jones R L.Nitric oxide reduces seed dormancy in Arabidopsis[J].J.Exp.Bot.,2006,57(3):517 -526.
[4]Guo F Q,Crawford N M.Arabidopsis nitric oxide synthase1 is targeted to mitochondria and protects against oxidative damage and dark-induced senescence[J].Plant Cell,2005,17(12):3436 -3450.
[5]He Y K,Tang R H,Yi H et al.Nitric oxide represses the Arabidopsis floral transition[J].Science,2004,305:1968 -1971.
[6]Beligni M V,Lamattina L.Nitric oxide in plants:the history is just beginning[J].Plant,Cell Environ.,2001,24(3):267 -278.
[7]Gould K S,Klinguer A,Pugin A et al.Nitric oxide production in tobacco leaf cells:a generalized stress response[J].Plant,Cell Environ.,2003,26(11):1851-1862.
[8]Crawford N M,Guo F Q.New insights into nitric oxide metabolism and regulatory functions[J].Trends Plant Sci.,2005,10:195 -200.
[9]Besson-Bard A,Pugin A,Wendehenne D.New insights into nitric oxide signaling in plants[J].Annu.Rev.plant Biol.,2008,59:21-39.
[10]Beligni M V,Lamattina L.Is nitric oxide toxic or protective?[J].Trends Plant Sci.,1999,4:229 -300.
[11]Zhao M G,Tian Q Y,Zhang W H.Nitric oxide synthase-de-pendent nitric oxide production is associated with salt tolerance in Arabidopsis[J].Plant Physiol.,2007,144:206 -217.
[12]Leshem Y Y.Nitric oxide in biological system[J].Plant Growth Reg.,1996,18(3):155-159.
[13]Gouva C M,Souza J F,Magalhes C et al.NO--releasing substance that induce growth elongation in maize root segments[J].Plant Growth Reg.,1997,21:183-187.
[14]張志良,翟偉菁.植物生理學實驗指導[M].北京:高等教育出版社,2003.39-41.Zhang Z L,Zhai W J.Laboratory guild for plant physiology[M].Beijing:Higher Education Press.2003,39-41.
[15]趙世杰,史國安,董新純.植物生理學實驗指導[M].北京:中國農業科學技術出版社,2002.47-48 Zhao S J,Shi G A,Dong X C.Laboratory guild for plant physiology[M].Beijing:China Agricultural Scientech Press,2002.47-48.
[16]Gong H J,Zhu X Y,Chen K M et al.Silicon alleviates oxidative damage of wheat plants in pots under drought[J].Plant Sci.,2005,169:313-321.
[17]Bethke P C,Badger M R,Jonew R L.Apoplastic synthesis of nitric oxide by plant tissues[J].Plant Cell,2004,16:332.
[18]Zhang H,Shen W B,Xu L L.Effects of nitric oxide on the germination of wheat seeds and its reactive oxygen species metabolism under osmotic stress[J].Acta Bot.Sin.,2003,45:901 -905.
[19]Zhang H,Shen W B,Zhang W,Xu L L.A rapid response of β-amylase to nitric oxide but not gibberellin in wheat seeds during the early stage of germination[J].Planta,2005,220:708 -716.
[20]劉建新,王鑫,雷蕊霞.外源一氧化氮供體SNP對黑麥草種子萌發和幼苗生長的影響[J].生態學雜志,2007,26(3):393-398.Liu J X,Wang X,Lei R X.Effects of exogenous nitric oxide donor SNP on seed germination and seedling growth of Lolium multiflorum[J].Chin.J.Ecol.,2007,26(3):393 -398.
[21]凌騰芳,宣偉,樊穎瑞,等.外源葡萄糖、果糖和NO供體(SNP)對鹽脅迫下水稻種子萌發的影響[J].植物生理與分子生物學學報,2005,31(2):205-212.Ling T F,Xuan W,Fang Y R et al.The effect of exogenous glucose,fructose and NO donor sodium nitroprusside(SNP)on rice seed germination under salt stress[J].J.Plant Physiol.Mol.Biol.,2005,31(2):205 -212.
[22]Kopyra M,Gwóz'dz'E A.Nitric oxide stimulates seed germination and counteracts the inhibitory effect of heavy metals and salinity on root growth of Lupinus luteus[J].Plant Physiol.Biochem.,2003,41:1011-1017.
[23]Beligni M V,Lamattina L.Nitric oxide stimulates seed germination and de-etiolation,and inhibits hypocotyls elongation,three light-inducible responses in plants[J].Planta,2000,210:215-221.
[24]Bethke P C,Gubler F,Jacobsen J V.Dormancy of Arabidopsis seeds and barley grains can be broken by nitric oxide[J].Planta,2004,219:847-855.
[25]Bethke P C,Libourel I G L,Jones R L.Nitric oxide reduces seed dormancy in Arabidopsis[J].J.Exp.Bot.,2005,57:517-526.
[26]Pagnussat G C,Simontacchi M,Puntarulo S,Lamattina L.Nitric oxide is required for root organogenesis[J].Plant Physiol.,2002,129:954 -956.
[27]Correa-Aragunde N,Graziano M,Lamattina L.Nitric oxide plays a central role in determining lateral root development in tomato[J].Planta,2004,218:900-905.
[28]聞玉,趙翔,張驍.水分脅迫下一氧化氮對小麥幼苗根系生長和吸收的影響[J].作物學報.2008,34(2):344-348.Wen Y,Zhao X,Zhang X.Effects of nitric oxide on root growth and absorption in wheat seedlings in response to water stress[J].Acta Agron.Sin.2008,34(2):344-348.
[29]Foyer C H,Noctor G.Oxygen processing in photosynthesis regulation and signaling[J].New Phytol.,2000,146:359 -388.
[30]張遠兵,劉愛榮,方蓉.外源一氧化氮對鎘脅迫下黑麥草生長和抗氧化酶活性的影響[J].草業學報.2008,17(4):57-64.Zhang Y B,Liu A R,Fang R.Effect of exogenous nitric oxide on the growth and antioxidant enzyme activities of Lolium perenne under Cd stress[J].Acta Pratac.Sin.2008,17(4):57 -64.
[31]姜義寶,楊玉榮,鄭秋紅.外源一氧化氮對干旱脅迫下苜蓿幼苗抗氧化酶活性和葉綠素熒光特性的影響[J].干旱地區農業研究,2008,26(2):65-68.Jiang Y B,Yang Y R,Zheng Q H.Effects of exogenous nitric oxide on antioxidase and chlorophyll fluorescence of seedling of alfalfa under drought stress[J].Agric.Res.Arid Areas.,2008,26(2):65-68.

