黃銅表面鑭轉化膜在模擬雨水中的腐蝕行為
范洪強,李淑英,趙宗昌,林樂圣,張琳
(大連理工大學化工與環境生命學部,遼寧 大連 116012)
【腐蝕防護】
黃銅表面鑭轉化膜在模擬雨水中的腐蝕行為
范洪強,李淑英*,趙宗昌,林樂圣,張琳
(大連理工大學化工與環境生命學部,遼寧 大連 116012)
采用化學浸泡法在黃銅表面制得鑭轉化膜,轉化液組成與工藝條件為:硝酸鑭3.5 ~ 5.5 g/L,苯并三氮唑8.0 ~ 12.0 g/L,磺基水楊酸8.0 ~ 12.0 g/L,檸檬酸15.0 g/L,溫度60 °C,pH 4,時間3 min。采用原子吸收光譜和電化學法研究了黃銅/鑭轉化膜在模擬雨水中的腐蝕行為。在相同的浸泡時間內,黃銅/鑭轉化膜在模擬雨水中溶解的銅離子質量濃度低于黃銅基體。在酸性范圍內,模擬雨水的pH越高,黃銅/鑭轉化膜越不容易被腐蝕。鑭轉化膜對溶解于雨水中的和Cl?較敏感,Cl?含量的增加使黃銅/鑭轉化膜的點蝕增強,含量的增加使膜層整體發生嚴重腐蝕;NO?3含量則對其腐蝕行為的影響不大。黃銅/鑭轉化膜在pH = 3.29的模擬雨水中的腐蝕經歷3個階段。
黃銅;轉化膜;鑭;雨水;腐蝕
1 前言
黃銅作為金屬材料被廣泛應用在眾多領域,隨酸雨現象日益嚴重,研究黃銅表面處理技術以提高其耐蝕性能具有重要的意義。稀土對銅及銅合金的緩蝕、轉化作用的研究始于20世紀90年代,R. N. Singh等[1]的研究表明,在鹽酸溶液中添加 La、Ce、Nd鹽,可有效減少701B鋁青銅的腐蝕。A. J. Aidykiewicz等[2]采用旋轉圓盤電極技術研究銅表面鈰轉化膜的形成過程,指出O2的還原反應受溶液pH、電極電勢及最初形成的鈰轉化膜形態的影響。韓寶軍等[3]研究了稀土鈰鹽在紫銅緩蝕劑中的應用,進一步證實了稀土鹽對銅的緩蝕作用,但過多鈰鹽的加入不利于鈍化膜的性能。近期的研究表明,將硝酸鑭和有機緩蝕劑苯并三氮唑(BTA)復配使用,可使黃銅表面膜層在大氣、海水和弱酸環境中的耐腐蝕性提高[4-8]。
黃銅在含氧和Cl?的水溶液中常發生電化學腐蝕,生成的腐蝕產物在黃銅表面逐漸沉積,使黃銅表面發生腐蝕產物與無腐蝕產物間的電偶腐蝕(其中,腐蝕產物區為陰極區,無腐蝕產物區為陽極區),從而促進黃銅的溶解[9-11]。D. K. Y. Wong[12]研究了銅在硫酸溶液中溶解的動力學模型。Y. Feng[13-14]等研究了銅在不同pH水溶液中的腐蝕產物、腐蝕機制和黃銅在中性飲水中的腐蝕行為。然而對黃銅及表面稀土轉化膜在雨水中的腐蝕行為仍缺乏深刻認識。
本文主要采用電化學方法、原子吸收光譜和掃描電鏡研究黃銅表面鑭轉化膜在模擬上海雨水中的腐蝕行為。
2 實驗
2. 1 試驗材料
以40 mm × 20 mm × 2 mm的黃銅為基體,其化學成分(以質量分數表示)為:Cu 63.5% ~ 68.0%,Fe 0.10%,Pb 0.03%,Sb 0.005%,Bi 0.002%,P 0.01%,Zn余量。所用化學試劑均為分析純。
2. 2 稀土鑭轉化
采用化學浸泡法對基體進行轉化處理,工藝流程為:打磨─機械拋光─化學除油─熱水清洗─化學拋光─清洗─稀土轉化膜工藝─清洗─氮氣吹干。
轉化液配方與工藝為:

2. 3 模擬雨水組成
根據上海實際降雨組分分析結果[15],用二次蒸餾水和分析純試劑配制模擬雨水,具體組成見表1。用7 mol/L的HNO3調節模擬雨水的pH。改變模擬雨水中、Cl?的含量,可研究模擬雨水中主要陰離子對黃銅表面鑭轉化膜腐蝕行為的影響[16]。以表1的模擬雨水為空白液,分別往其中添加 1 μmol/L的Na2SO4、NaCl和NaNO3。

表1 模擬上海雨水的組成Table 1 Composition of artificial rainwater of Shanghai
2. 4 性能測試
采用上海辰華儀器有限公司生產的CHI660B型電化學工作站測試開路電位–時間曲線,以鉑片作輔助電極,飽和甘汞電極(SCE)為參比電極,成膜或未成膜的黃銅試片(1 cm × 1 cm)為工作電極。采用美國PRINCETON公司生產的Potentiostat/Galvanostat Model 273電化學系統測定黃銅/鑭轉化膜(1 cm × 1 cm)的電化學阻抗譜(EIS),pH = 3.29,頻率范圍為0.01 Hz ~100 kHz,交流干擾幅值為10 mV。電化學測試均以模擬雨水為介質。利用CN63M/CAAM-2001原子吸收光譜儀(北京中西遠大科技有限公司)測定試樣在模擬雨水中的溶解率。用JSM-5600LV掃描電鏡(日本JEOL公司)觀察黃銅/鑭轉化膜在模擬雨水中浸泡30 d后的腐蝕形貌。
3 結果與討論
3. 1 在模擬雨水中的溶解率
黃銅成膜前后溶解于pH = 3.29的模擬雨水中的銅離子質量濃度由CN63M/CAAM-2001原子吸收光譜儀(北京中西遠大科技有限公司)測定,結果見表2。

表2 不同試樣在模擬雨水中溶解的銅離子質量濃度Table 2 Mass concentration of copper ions dissolved from different samples in artificial rainwater
隨浸泡時間的延長,溶解于模擬雨水中的黃銅基體增多,浸泡30 h后模擬雨水中的銅離子質量濃度明顯比浸泡3 h時大,變化幅度高達1 mg/L。黃銅/鑭轉化膜在模擬雨水中的溶解也隨浸泡時間的延長而增多,但變化趨勢較平緩,且其溶解的量比黃銅基體少,說明鑭轉化膜有良好的耐蝕性,在一定程度上阻止了銅基體的溶解。
3. 2 pH的影響
圖1為黃銅/鑭轉化膜在不同pH的模擬雨水中的開路電位–時間曲線。

圖1 黃銅/鑭轉化膜在不同pH模擬雨水中的開路電位–時間曲線Figure 1 Open-circuit potential vs. time curves for brass/lanthanum conversion coating in artificial rainwater with different pHs
模擬雨水的pH不同,則試樣的腐蝕電位變化也趨勢不同。pH = 7時,電位先正移后趨于平穩;pH = 5.65時,曲線變化有2個階段:浸泡初期,電位逐漸正移隨后下降,4 h后進入第2階段,電位保持在?0.02 V左右,出現平臺且持續時間較長;pH = 3.29時,電位曲線變化較大,即使浸泡15 h也未出現平臺。另外,浸泡2 h后,黃銅/鑭轉化膜的腐蝕電位隨pH升高而正移,且更穩定。上述結果表明,黃銅/鑭轉化膜在模擬雨水中的腐蝕與pH有關,在酸性范圍內,溶液pH越高,黃銅/轉化膜越不容易被腐蝕。
3. 3 主要侵蝕性陰離子的影響
以pH = 3.29的模擬雨水為空白液,分別加入1 μmol/L的Na2SO4、NaCl、NaNO3,浸泡30 d后試樣的腐蝕形貌如圖2所示。

圖2 試樣在模擬雨水中浸泡30 d后的腐蝕形貌Figure 2 Corrosion morphology of sample after immersion in artificial rainwater for 30 days
從圖2可知,試樣在4種模擬雨水中都有一定程度的點蝕。其中,浸于添加了Cl?的模擬雨水中的試樣點蝕密度和強度高于浸于空白溶液中的試樣;試樣在添加溶液中的腐蝕最嚴重,試樣表面膜層遭到嚴重破壞,除發生一定程度的點蝕外,更接近全面腐蝕;轉化膜在加的溶液中的點蝕現象最弱。通常,活性陰離子在銅合金表面的競爭吸附,陰離子與氧化膜和金屬基體間的反應較大程度地影響銅合金的腐蝕[17]。、Cl?等對金屬材料在雨水中的腐蝕行為主要受其與溶液中O2或OH?的競爭吸附過程及形成的腐蝕產物性質的影響[18]。較多的陰離子吸附在電極表面缺陷部位,由于吸附的陰離子和銅合金的化學反應性質及腐蝕產物性質不同,對銅合金腐蝕過程的影響也就不同。黃銅/鑭轉化膜對溶解于雨水中的和Cl?較敏感,是因為和Cl?能夠納入轉化膜而增加了額外的電荷載體,或直接參與金屬基體的溶解反應[19-20]。因而,溶液中或Cl?含量的增加使黃銅/鑭轉化膜的腐蝕增強。
3. 4 腐蝕過程
圖3為黃銅/鑭轉化膜試樣在pH = 3.29的模擬雨水中的電化學阻抗譜。根據阻抗譜特征的變化,黃銅表面鑭轉化膜試樣浸泡的電化學過程可分成初期、中期和后期3個階段。
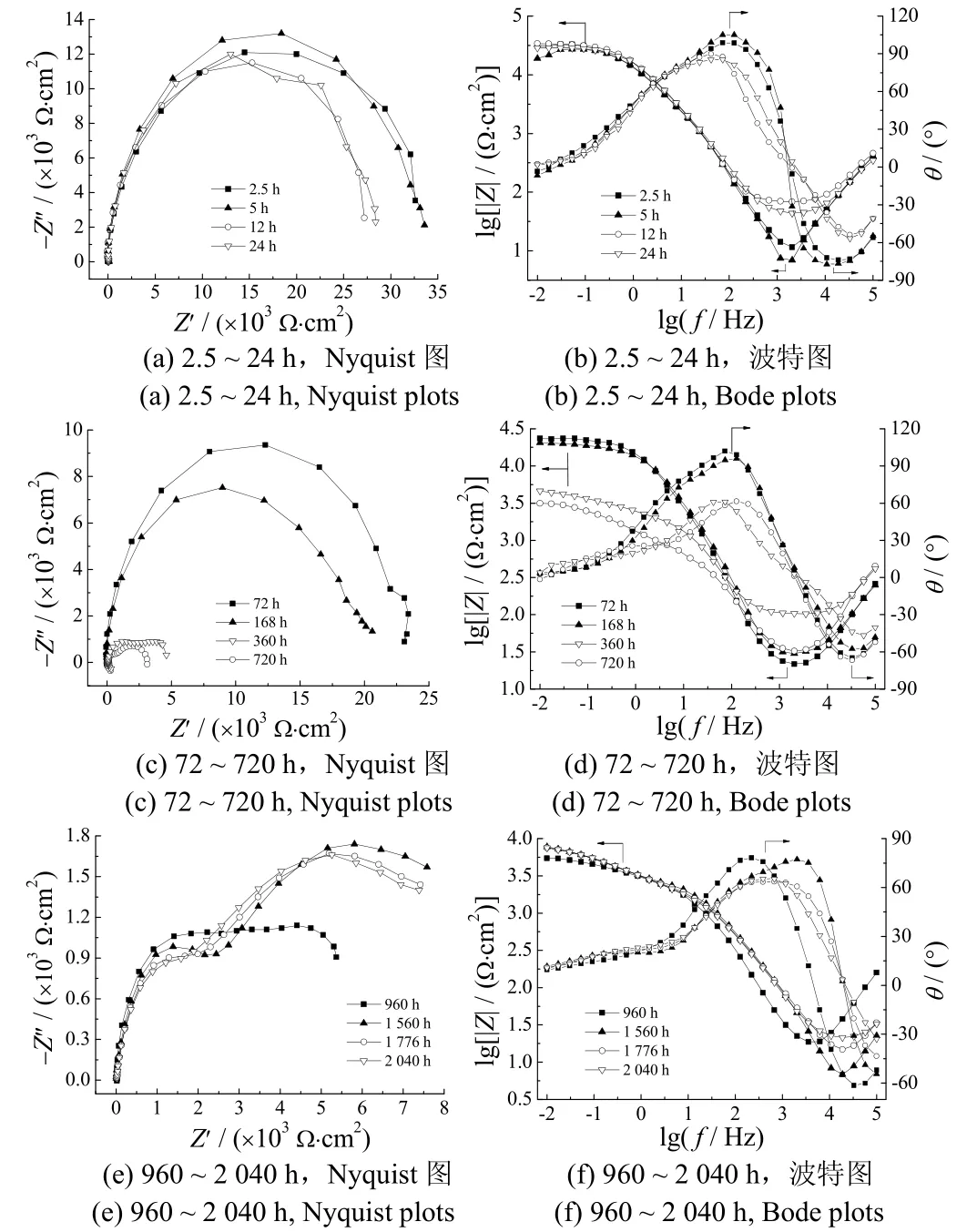
圖3 黃銅/鑭轉化膜在pH = 3.29的模擬雨水中浸泡不同時間的電化學阻抗譜Figure 3 EIS diagrams of brass/lanthanum conversion coating immersed in artificial rainwater for different time
從圖3a和3b可知,浸泡前期(2.5 ~ 24 h),Nyquist圖顯示為一段圓弧,表現出明顯的電容特征,具有很高的阻抗值,說明轉化膜完好,對基體起到屏蔽保護作用。這是因為一方面轉化膜的機械阻礙作用阻擋了活性離子的侵蝕,耐點蝕能力大為提高;另一方面,轉化膜阻礙了氧和電子的自由傳輸,抑制了基體銅合金的腐蝕反應,腐蝕電流密度較小。在該浸泡階段,阻抗譜的圓弧半徑變化不大,表明膜層的電阻值基本相同,阻抗值較大說明稀土轉化膜層起的電阻作用較強,腐蝕液很難侵入,有效地保護了基體銅。
從圖3c和3d可知,浸泡中期(72 ~ 720 h)阻抗圖譜發生明顯變化,出現2段圓弧,即有2個時間常數,其高頻區域的容抗弧對應轉化膜的阻抗,而低頻區對應電化學反應的阻抗。這說明此時模擬雨水中的侵蝕性介質已滲入膜層并逐漸到達基體表面,稀土鑭轉化膜逐漸被破壞,性能開始下降。值得注意的是,在浸泡168 ~ 360 h時,阻抗譜的圓弧半徑明顯減小,膜層低頻阻抗值(Zlf)約降低 1個數量級。這說明在 168 ~360 h時,膜層性能下降得最快,即在模擬雨水中,稀土鑭轉化膜層有效保護時間小于360 h。
從圖3e和3f可知,浸泡后期(960 ~ 2 040 h)阻抗譜上出現了3個時間常數,Nyquist圖比原來多了1個低頻感抗弧,其對應鑭轉化膜被破壞后黃銅基體發生的氧化還原反應。
4 結論
(1) 在模擬雨水中,成膜后的黃銅溶解量變化較為平緩,均比成膜前的黃銅少,說明鑭轉化膜有良好的耐蝕效果,在一定程度上阻止了黃銅的陽極溶解。
(2) 黃銅/鑭轉化膜的腐蝕行為與模擬雨水的 pH有關,在酸性范圍內,溶液的pH越高,越不容易發生腐蝕。
(4) 黃銅/鑭轉化膜在pH = 3.29的模擬雨水中的腐蝕過程有3個階段:浸泡初期,具有很高的阻抗值,轉化膜完好,對基體起到屏蔽保護作用;浸泡中期,出現了2個時間常數,模擬雨水中的侵蝕性介質滲入膜層并逐漸到達基體試樣表面;浸泡后期,阻抗譜上出現3個時間常數,黃銅基體發生氧化還原反應。
[1] SINGH R N, TIWARI S K, SINGH W R. Effects of Ta, La and Nd additions on the corrosion behavior of aluminum bronze in mineral acids [J]. Journal of Applied Electrochemistry, 1992, 22 (12): 1175-1179.
[2] ALDYKIEWICZ A J, DAVENPORT A J, ISAACS H S. Studies of the formation of cerium-rich protective films using X-ray absorption near-edge spectroscopy and rotating disk electrode methods [J]. Journal of the Electrochemical Society, 1996, 143 (1): 147-154.
[3] 韓寶軍, 徐洲. 稀土 Ce在紫銅緩蝕劑中的應用研究[J]. 表面技術, 2005, 34 (4): 18-20.
[4] 章江洪, 張英杰, 閆宇星. 稀土轉化膜在金屬材料表面改性中的研究進展[J]. 稀土, 2009 (5): 84-89, 94.
[5] FAN H Q, LI S Y, SHI Z C, et al. Studies of the conversion coatings formed by combined use of lanthanum salt and benzotriazole on commercial brass [J]. Advanced Materials Research, 2011, 239/242: 214-218.
[6] 甘樹坤, 呂雪飛. 銅合金表面硝酸鑭稀土鈍化膜的性能研究[J]. 材料保護, 2008, 41 (8): 35-37.
[7] 呂雪飛, 李淑英. 環保型銅及其合金化學拋光與鈍化新工藝[J]. 材料保護, 2006, 39 (9): 25-27.
[8] 李鋒, 劉俊, 陳顥. 銅及其合金表面鈍化新工藝的研究[J]. 電鍍與涂飾, 2005, 24 (2): 15-17.
[9] SCENDO M. The effect of purine on the corrosion of copper in chloride solutions [J]. Corrosion Science, 2007, 49 (2): 373-390.
[10] KOSEC T, MILO?EV I, PIHLAR B. Benzotriazole as an inhibitor of brass corrosion in chloride solution [J]. Applied Surface Science, 2007, 253 (22): 8863-8873.
[11] RAMJI K, CAIRNS D R, RAJESWARI S. Synergistic inhibition effect of 2-mercaptobenzothiazole and Tween-80 on the corrosion of brass in NaCl solution [J]. Applied Surface Science, 2008, 254 (15): 4483-4493.
[12] WONG D K Y, COLLER B A W, MACFARLANE D R. A kinetic model for the dissolution mechanism of copper in acidic sulfate solutions [J]. Electrochimica Acta, 1993, 38 (14): 2121-2127.
[13] FENG Y, TEO W K, SIOW K S, et al. The corrosion behaviour of copper in neutral tap water. Part I: Corrosion mechanisms [J]. Corrosion Science, 1996, 38 (3): 369-385.
[14] FENG Y, TEO W K, SIOW K S, et al. The corrosion behaviour of copper in neutral tap water. Part II: Determination of corrosion rates [J]. Corrosion Science, 1996, 38 (3): 387-395.
[15] 沙晨燕, 何文珊, 童春富, 等. 上海近期酸雨變化特征及其化學組分分析[J]. 環境科學研究, 2007, 20 (5): 31-34.
[16] 安百剛. 酸雨/雨水環境中典型金屬材料的腐蝕行為研究[D]. 天津:天津大學, 2003: 50.
[17] FOLEY R T. The localized corrosion of aluminum alloys—a review [J]. Corrosion, 1986, 42 (5): 277-288.
[18] PYUN S I, HONG M H. The repassivation kinetics of pure nickel in a Na2SO4solution using abrading electrode technique [J]. Electrochimica Acta, 1992, 37 (13): 2437-2442.
[19] AMBAT R, DWARAKADASA E S. Studies on the influence of chloride ion and pH on the electrochemical behavior of aluminum alloys 8090 and 2014 [J]. Journal of Applied Electrochemistry, 1994, 24 (9): 911-916.
[20] PYUN S I, LEE E J. Effect of halide ion and applied potential on repassivation behavior of Al–1 wt.%Si–0.5 wt.%Cu alloy [J]. Electrochimica Acta, 1995, 40 (12): 1963-1970.
Corrosion behavior of lanthanum conversion coating on brass substrate in artificial rainwater //
FAN Hongqiang, LI Shu-ying*, ZHAO Zong-chang, LIN Le-sheng, ZHANG Lin
Lanthanum conversion coating was prepared on brass substrate by chemical immersion. The conversion bath composition and process conditions are as followers: lanthanum nitrate 3.5-5.5 g/L, benzotriazole 8.0-12.0 g/L, sulfosalicylic acid 8.0-12.0 g/L, citric acid 15.0 g/L, temperature 60 °C, pH 4, and time 3 min. The corrosion behavior of brass/lanthanum conversion coating in artificial rainwater was studied by atomic absorption spectroscopy and electrochemical methods. The mass concentration of copper ions dissolved from the brass/lanthanum conversion coating in artificial rainwater is lower than that from brass substrate during the same immersion time. The higher the pH of artificial rainwater under acid condition, the more difficult the corrosion of brass/lanthanum conversion coating will be. Lanthanum conversion coating is sensitive tond Cl?in rainwater. The corrosive pitting of brass/lanthanum conversion coating becomes more serious as the Cl?concentration increases, nearly the whole brass/lanthanum conversion coating corrodes seriously when the
concentration increases, whileconcentration has little effect on the corrosion behavior of brass/lanthanum conversion coating. The corrosion of brass/lanthanum conversion coating in artificial rainwater with a pH of 3.29 proceeds through 3 stages.
brass; conversion coating; lanthanum; rainwater; corrosion
Faculty of Chemical, Environmental and Biological Science and Technology, Dalian University of Technology, Dalian 116012, China
TG174.41
A
1004 – 227X (2012) 01 – 0043 – 04
2011–07–21
2011–09–02
范洪強(1982–),男,福建建甌人,博士,研究方向為金屬材料表面涂裝及改性。
李淑英,教授,(E-mail) dllishuying@126.com。
[ 編輯:周新莉 ]

