熱休克蛋白在結腸炎和胰腺炎時的表達特點及大麻類物質WIN和O-1602的影響*
余良英, 李永渝, 李 琨, 馮佳燕, 林旭紅, 馮雅靜, 曹明華, 徐 菁
(同濟大學醫學院病理生理教研室,同濟大學消化系疾病研究所,上海 200092)
1000-4718(2012)04-0664-05
2011-12-02
2012-02-29
國家自然科學基金資助項目(No.30971168;No.81141050)
△通訊作者 Tel:021-65981021;E-mail:liyongyu@tongji.edu.cn
熱休克蛋白在結腸炎和胰腺炎時的表達特點及大麻類物質WIN和O-1602的影響*
余良英, 李永渝△, 李 琨, 馮佳燕, 林旭紅, 馮雅靜, 曹明華, 徐 菁
(同濟大學醫學院病理生理教研室,同濟大學消化系疾病研究所,上海 200092)
目的觀察幾種熱休克蛋白(heat-shock proteins, HSPs)在實驗性結腸炎和實驗性急性胰腺炎炎癥組織中表達的變化,同時研究大麻經典受體1和受體2激動劑WIN55和212-2(WIN),以及新型受體GPR55激動劑O-1602對HSPs表達的影響及可能的意義。方法用C57/BL小鼠,通過連續飲用7 d 4%葡聚糖硫酸鈉(dextran sulfate sodium, DSS)復制結腸炎模型;通過腹腔注射雨蛙肽(cerulein,50 μg/kg,每小時1次,連續 6次)復制急性胰腺炎模型。同時設各模型組及WIN、O-1602治療組,檢測不同處理組小鼠結腸和胰腺組織形態學改變、血漿促炎細胞因子包括白細胞介素-6(IL-6)及細胞因子誘導的中性粒細胞化學趨化因子-1(cytokine-induced neutrophil chemoattractant-1,CINC-1) 的水平和淀粉酶活性,同時用免疫組化方法檢測結腸和胰腺組織HSPs(HSP27、HSP60、和HSP70)的表達特點。結果在DSS誘導的小鼠結腸炎及 cerulein 誘導的小鼠胰腺炎模型,其結腸和胰腺組織分別出現典型的炎癥及損傷,血漿促炎因子水平升高(P<0.05),在胰腺炎小鼠還有血漿胰淀粉酶活性的升高。在結腸炎癥組織,HSP27表達明顯升高,HSP60和HSP70表達降低;WIN具有一定的抗炎作用,并能顯著提高結腸炎結腸組織HSP27和HSP70的表達(P<0.05)。在急性胰腺炎的胰腺組織,HSP27和HSP70表達升高,HSP60表達有所降低; O-1602有一定的抗炎作用,也能提高HSP70的表達,但總體來看,對這3種HSPs的影響均不太明顯(P>0.05)。結論DSS和cerulein分別誘導小鼠結腸炎和急性胰腺炎的發生;在這2種模型的炎癥組織中HSPs的表達變化不一。大麻類物質WIN和O-1602均有一定的抗炎作用,也在一定程度上提高部分HSPs的表達。HSPs的高表達是否與大麻類物質的抗炎作用有關值得進一步的研究。
熱休克蛋白質類; 急性胰腺炎; 結腸炎; 大麻酚類
熱休克蛋白(heat-shock proteins, HSPs)是一類熱應激蛋白,根據分子量的大小分為HSP100、HSP90、HSP70、HSP60、HSP40和小分子HSP[1]。這些蛋白分子存在于幾乎所有的細胞器內,包括胞漿、胞核、線粒體和內質網[2]。熱休克蛋白合成是應激狀態下細胞生存的一種保護機制,除了高熱等生理刺激外,各種病理狀態如組織損傷、炎癥、感染等也能誘導熱休克蛋白的合成[3]。研究顯示,熱休克蛋白與結腸炎、胰腺炎等炎癥性疾病的關系密切[4-5],雖然對其作用還存在爭議,然而大多數結果認為HSPs的高表達可抵抗損傷刺激[6]。大麻類物質具有抗炎作用,它們對HSPs的表達是否具有影響目前尚不得知。本研究主要探討在不同消化系統炎癥疾病(小鼠結腸炎和小鼠急性胰腺炎模型)中HSPs的表達特點,并探討新型大麻類物質WIN55、212-2(WIN)(大麻經典受體1和受體2的激動劑)以及O-1602(新型大麻受體GPR55的激動劑)的抗炎作用及可能的機制,探討它們的作用是否與影響HSPs的表達有關。
材 料 和 方 法
1動物及分組
結腸炎造模及取材:體重18~22 g的成年C57/BL小鼠24只,雌雄各半,購自第二軍醫大學實驗動物中心。小鼠實驗前禁食不禁水16 h后隨機均分為3大組,即正常對照(control)組、葡聚糖硫酸鈉(dextran sulfate sodium, DSS)組、 DSS+WIN組。結腸炎模型根據Schicho等[7]介紹的方法復制,即用4%的DSS替代飲水連續喂動物7 d,DSS+WIN治療組在飲用DSS 7 d的過程中每天接受1次WIN腹腔注射(5 mg/kg),對照組和DSS組接受等容量的生理鹽水腹腔注射(10 mL/kg)。7 d后七氟醚吸入麻醉小鼠,斷頭取血,1%肝素抗凝處理,收集血漿標本-80 ℃保存,同時分離取出結腸組織,迅速置于4%多聚甲醛,用于相關指標檢測。
胰腺炎造模及取材:用體重18~22 g的成年C57/BL小鼠24只,雌雄各半(來源同上),隨機分為3組,即正常對照(control)組、急性胰腺炎(acute pancreatitis, AP)組、 AP+O-1602組。參照Ding等[8]的方法復制AP模型,即小鼠腹腔注射雨蛙肽(cerulein, 50 μg/kg,每小時1次,共6次)。對照組用生理鹽水代替雨蛙肽處理; AP+O-1602組在AP造模前0.5 h及造模過程5 h給O-1602腹腔注射(10 mg/kg),對照組和AP組接受等容量的生理鹽水腹腔注射(10 mL/kg體重)。最后一次注射后3 h七氟醚吸入麻醉斷頭處死動物,同上取血液及胰腺組織標本待用。
2主要藥品和試劑
DSS和雨蛙肽(Sigma),WIN55和212-2 (Tocris Bio),O-1602(Biotrend GmbH),鼠抗小鼠HSP27、HSP60和HSP70單克隆抗體(Stressgen),辣根過氧化物酶(HRP)標記的山羊抗小鼠IgG Ⅱ抗試劑盒(ZYMED),血漿淀粉酶檢測試劑盒(南京建成生物科技有限公司),白細胞介素-6(interleukin-6,IL-6)及細胞因子誘導的中性粒細胞化學趨化因子-1(cytokine-induced neutrophil chemoattractant-1,CINC-1)ELISA試劑盒(R&D)。
3各項指標的檢測
3.1組織形態學檢測 將置于4%多聚甲醛中的組織進行石蠟包埋,切片,蘇木素-伊紅(HE)染色。光學顯微鏡下觀察組織病理改變。
3.2血漿指標檢測 血漿淀粉酶活性按相關生化試劑盒說明書操作檢測,血漿IL-6以及CINC-1水平按相關ELISA試劑盒說明書進行檢測,按ng/L表示其濃度。
3.3結腸和胰腺組織中HSPs的表達 HSP27、HSP60和HSP70的表達用免疫組化法,即組織石蠟切片脫蠟水化,經微波加熱修復抗原;山羊血清封閉非特異抗原后,分別加入抗HSP27、HSP60或HSP 70 Ⅰ抗(1∶200), 4 ℃孵育過夜;加入辣根過氧化物酶標記的Ⅱ抗,37 ℃孵育15 min,DAB顯色。PBS代替Ⅰ抗作陰性對照。用Motic Med 6.0圖像分析系統觀測并采集圖片,并采用Image-Pro Plus 6.0 軟件對其平均光密度進行半定量分析。對照組數據作為100%,其余組的數據表示為對照組的百分比(% of control), 以比較各組間的變化。
4統計學處理
結 果
1組織病理改變
1.1結腸組織 光鏡下觀察發現,DSS誘導的小鼠結腸炎,結腸組織呈現黏膜壞死、脫落,累及固有層和黏膜下肌層,黏膜下水腫明顯,大量炎癥細胞浸潤,見圖1B。在DSS+WIN治療組,結腸組織粘膜壞死、脫落,黏膜下水腫及炎癥程度減輕,雖然仍可見組織炎癥細胞浸潤,但程度減輕,見圖1C。

Figure 1. Effect of WIN on the morphology of colonic tissues in mice with DSS-induced colitis(HE staining,×100). A: control; B: DSS; C:DSS +WIN.
圖1結腸炎小鼠結腸組織形態學的改變及WIN的影響
1.2胰腺組織 如圖2所示,AP組胰腺組織呈現水腫及炎癥表現,包括胰腺細胞腫脹,有空泡形成,炎癥細胞浸潤,血管擴張、充血等。在AP+O-1602組,胰腺水腫及炎癥程度減輕,間隙輕度增寬。

Figure 2. Effect of O-1602 on the morphology of pancreatic tissues in mice with cerulein-induced acute pancreatitis (AP) (HE staining,×100). A: control; B: AP; C: AP+O-1602.
圖2急性胰腺炎小鼠胰腺組織形態學的變化及O-1602的影響
2血漿生化指標的變化
2.1結腸炎小鼠血漿 IL-6和CINC-1水平的改變 與正常對照組比較,結腸炎小鼠血漿 IL-6和CINC-1水平均顯著升高(P<0.01), WIN可一定程度降低結腸炎小鼠血漿IL-6(P<0.05)和CINC-1(P>0.05)的水平,見圖3。
2.2AP小鼠血漿淀粉酶活性及IL-6水平的改變 AP小鼠血漿淀粉酶活性明顯升高,為對照組的4倍左右(P<0.05),IL-6水平也較對照組增高1.5倍(P<0.05);O-1602處理可一定程度降低雨蛙肽誘導的AP血漿淀粉酶活性及 IL-6水平的增高,降低程度分別為25%(淀粉酶)和30%(IL-6)(P<0.05)。
3結腸及胰腺炎癥組織中HSPs表達的變化
3.1結腸組織HSPs表達的變化 在正常小鼠結腸組織,HSP27、HSP60和HSP70均表達于結腸黏膜層腺細胞胞漿內,呈棕黃色染色。半定量分析表明,與正常小鼠比較,結腸炎時小鼠結腸組織HSP27表達明顯升高(P<0.05),而HSP60和HSP70表達均有降低趨勢,且HSP70與對照組比有顯著差異(P<0.05)。WIN對DSS誘導的小鼠結腸炎組織中HSP27和HSP60的表達均無明顯影響,但顯著上調結腸組織HSP70的表達(P<0.05),見圖4。


圖3結腸炎小鼠血漿IL-6及CINC-1水平的改變及WIN的影響


圖4WIN對結腸炎小鼠結腸組織HSPs表達的影響
3.2胰腺組織HSPs表達的變化 在正常小鼠胰腺腺泡細胞內,HSP27、HSP60和HSP70均有表達,主要在其胞漿內,呈棕黃色。半定量分析顯示,與正常對照組比較,胰腺炎時胰腺組織HSP27和HSP70表達明顯升高 (P<0.05),而HSP60無明顯改變。O-1602對cerulein誘導的小鼠胰腺炎組織中HSP27、HSP60和HSP70的表達均無明顯影響,見圖5。
討 論
細胞內的熱休克蛋白有充當分子伴侶、抗凋亡、參與炎癥反應等一系列的作用[4]。有研究報道,HSPs與腸道炎癥有密切的關系, HSPs的高表達促進結腸炎的發展,例如Rodolico等[6]發現,炎癥性腸病患者結腸黏膜HSP60的表達顯著升高。然而也有人認為,作為細胞內的保護劑,HSPs可以使結腸黏膜上皮細胞免受刺激損傷,例如高熱誘導的HSP70高表達減輕2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)誘導的結腸組織損傷和炎癥介質產生,也能保護結腸黏膜免受乙酸誘導的黏膜損傷[9]。直腸內給鋅衍生物誘導的HSPs高表達也能通過NF-κB失活而表現出對結腸黏膜的保護作用[9]。另外,短鏈脂肪酸、白細胞介素-11或LPS特異性誘導的HSP27高表達可保護結腸黏膜免受氧化應激損傷[10-12]。因此結腸炎的發生發展很可能與HSPs的功能紊亂或表達下降有關。本實驗結果顯示結腸炎時結腸組織HSP60和HSP70的表達比對照組的明顯降低,而HSP27的表達有顯著升高。

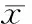
圖5O-1602對急性胰腺炎小鼠胰腺組織HSPs表達的影響
熱休克蛋白和急性胰腺炎也有密切的關系,高熱誘導HSP70高表達能阻止胰腺內的胰蛋白酶原激活,從而抵抗雨蛙肽誘導的胰腺炎[13]。有報道稱,先前用冷水浸漬法誘導HSP60的高表達通過阻止胰腺細胞中酶的異常積累和激活,可顯著改善雨蛙肽誘導的小鼠急性胰腺炎的嚴重性[14]。最近我們課題組也發現,用RNA干擾技術抑制HSP60基因表達后,胰腺更易受到損傷因子的破壞[4]。這些結果表明熱休克蛋白的高表達能保護動物模型免受或減輕急性胰腺炎誘導因子的損傷。我們先前的實驗發現,急性胰腺炎時胰腺組織HSP60的表達(基因水平和蛋白水平)降低,尤其在重型胰腺炎時[14-15]。本實驗用雨蛙肽腹腔注射復制AP模型,從病理結果證實是水腫型,仍見到HSP60表達降低,然而HSP27和HSP70的表達比正常對照組明顯升高,表明AP時各種HSP表達的變化不一。
大麻素系統主要包括機體內源性大麻素系統(ECS)和外源性大麻類物質。ECS包括大麻素受體、該受體的內源性配體以及相關的合成和降解酶類,它們在疼痛、炎癥、細胞生長死亡以及各種胃腸功能的生理和病理過程中起有重要的調節作用[16]。大麻類物質能作用于靶組織中特定受體發揮效用。目前已知的大麻受體主要有經典的CB1、CB2受體和新型大麻受體GPR55。WIN與O-1602均是大麻受體激動劑,前者主要通過CB1和CB2受體而發揮作用,O-1602能特異激活GPR55,對CB1和CB2受體無作用。大量的研究證實, WIN有抗炎、鎮痛的作用。Berdyshev等[17]研究顯示WIN在脂多糖誘導的小鼠支氣管炎模型中有抗炎作用。 Farquhar-Smith等[18]的研究也證實了WIN在調節細胞因子及抗炎方面的功效。我們前期的研究也發現O-1602可一定程度下調促炎癥細胞因子的產生,控制AP的發生發展[14]。有趣的是,大麻素與HSPs之間也有密切的關系。本實驗結果顯示, 無論WIN或O-1602均可一定程度改善炎癥組織的病理變化,下調促炎細胞因子水平,提高組織HSPs的表達, 如WIN提高結腸組織HSP27和HSP70的表達,O-1602提高胰腺組織HSP70的表達。然而,大麻類物質的抗炎作用是否與它們對HSPs的調節有關,其作用的環節及其機制如何,這些問題仍需進一步研究闡明。
[1] Pockley AG, Muthana M, Calderwood SK. The dual immunoregulatory roles of stress proteins[J].Trends Biochem Sci, 2008,33(2):71-79.
[2] Murshid A, Gong J, Calderwood SK. Heat-shock proteins in cancer vaccines: agents of antigen cross-presentation[J].Expert Rev Vaccines, 2008,7(8):1019-1030.
[3] van Puijvelde GH, van Es T, van Wanrooij EJ,et al. Induction of oral tolerance to HSP60 or an HSP60-peptide activates T cell regulation and reduces atherosclerosis[J].Arterioscler Thromb Vasc Biol, 2007, 27(12): 2677-2683.
[4] Li YY, Lu S, Li K. Down-regulation of HSP60 expression by RNAi increases lipopolysaccharide- and cerulein-induced damages on isolated rat pancreatic tissues[J].Cell Stress Chaperones, 2010,15(6):965-975.
[5] Devlin SM, Panaccione R. Evolving inflammatory bowel disease treatment paradigms: top-down versus step-up[J]. Med Clin North Am, 2010, 94(1):1-18.
[6] Rodolico V, Tomasello G, Zerilli M . Hsp60 and Hsp10 increase in colon mucosa of Crohn’s disease and ulcerative colitis[J]. Cell Stress Chaperones, 2010,15(6):877-884.
[7] Schicho R, Bashashati M, Bawa M, et al. The atypical cannabinoid O-1602 protects against experimental colitis and inhibits neutrophil recruitment[J]. Inflamm Bowel Dis, 2010, 17(8): 1651-1664.
[8] Ding SP,Li JC,Jin C. A mouse model of severe acute pancreatitis induced with cerulein and lipopolysaccharide[J].World J Gastroenterol,2003,9(3):584-589.
[9] Otaka M,Odashima M, Watanabe S. Role of heat shock proteins (molecular chaperones) in intestinal mucosal protection[J]. Biochem Biophys Res Commun, 2006,348(1):1-5.
[10]Ren H, Musch MW, Chang EB. Short-chain fatty acids induce intestinal epithelial heat shock protein 25 expression in rats and IEC 18 cells[J].Gastroenterology, 2001,121(3):631-639.
[11]Ropeleski MJ, Tang J, Chang EB. Interleukin-11-induced heat shock protein 25 confers intestinal epithelial-specific cytoprotection from oxidant stress[J].Gastroenterology, 2003,124(3):1358-1368.
[12]Kojima K, Musch MW, Chang EB.EscherichiacoliLPS induces heat shock protein 25 in intestinal epithelial cells through MAP kinase activation[J]. Am J Physiol Gastrointest Live Physiol, 2004,286(4):G645-G652.
[13]Bhagat L, Singh VP, Hietaranta AJ. Heat shock protein 70 prevents secretagogue-induced cell injury in the pancreas by preventing intracellular trypsinogen activation[J]. J Clin Invest, 2000,106(1):81-89.
[14]馮佳燕,李 琨,林旭紅. 新型大麻制劑O-1602 和CBD 減輕小鼠實驗性急性胰腺炎的機制研究[J]. 中國病理生理雜志,2011,27(3):539-544.
[15]李 琨,李永渝,李學晉.伴侶因子60在實驗性急性胰腺炎肝胰組織中的表達及意義[J].中國病理生理雜志,2008,24(9):1804-1810.
[16]Lin XH, Yuece B, Li YY. A novel CB receptor GPR55 and its ligands are involved in regulation of gut movement in rodents[J]. Neurogastroenterol Motil, 2011,23(9):862-e342.
[17]Berdyshev EV. Cannabinoid receptors and the regulation of immune response[J]. Chem Phys Lipids, 2000,108(1-2):169-190.
[18]Farquhar-Smith WP, EgertovM, Bradbury EJ. Cannabinoid CB1receptor expression in rat spinal cord[J]. Mol Cel Neurosci, 2000,15(6):510-521.
EffectsofcannabinoidsWINandO-1602onexpressionofHSPsinmicewithcolitisoracutepancreatitis
YU Liang-ying, LI Yong-yu, LI Kun, FENG Jia-yan, LIN Xu-hong, FENG Ya-jing, CAO Ming-hua, XU Jing
(DepartmentofPathophysiology,InstituteofDigestiveDisease,TongjiUniversitySchoolofMedicine,Shanghai200092,China.E-mail:liyongyu@tongji.edu.cn)
AIM: To investigate the effects of cannabinoids WIN55, 212-2 (WIN) and O-1602 on the expression of heat-shock proteins (HSPs), such as HSP27, HSP60 and HSP70, in the inflammatory tissues of mice with experimental colitis or acute pancreatitis (AP).METHODSMouse colitis was induced by feeding the C57/BL with 4% dextran sulfate sodium (DSS) for 7 d, and AP was induced by intraperitoneal injection of ceruline in the mice (50 μg/kg hourly, with a total of 6 times). The mice were intraperitoneally administered with WIN or O-1602 for the therapeutic evaluation by observing the following parameters: pathological changes of the tissues, plasma activity of amylase, plasma levels of IL-6 and cytokine-induced neutrophil chemoattractant-1 (CINC-1), and HSP expression in the colonic and pancreatic tissues.RESULTSCompared with normal control mice, the colonic tissues from colitis mice and the pancreatic tissues from AP mice appeared obvious signs of inflammation and injury. The plasma levels of IL-6 and CINC-1 significantly increased in colitis mice and AP mice. In DSS group of colitis mice, HSP27 expression increased, but HSP60 and HSP70 were reduced in the colonic tissues. WIN showed anti-inflammatory effects on the pathological changes of colonic tissues and the plasma cytokine levels. WIN also improved the expression of HSP70 (P<0.05). In AP group, the expression of HSP27 and HSP70 in pancreatic tissues increased, and HSP60 decreased. O-1602 also showed some anti-inflammatory effects on the changes of the pathological tissues and the plasma parameters, but had no obvious effects on the HSP expression (P>0.05).CONCLUSIONThe experimental colitis and acute pancreatitis in mice were induced by feeding DSS and injection of cerulein, respectively. The changes of HSP expression were different in the inflammatory tissues. WIN and O-1602 show anti-inflammatory effects and increase the expression of several HSPs to some extent.
Heat-shock proteins; Acute pancreatitis; Colitis; Cannabinoids
R363.2
A
10.3969/j.issn.1000-4718.2012.04.015

