頜骨骨髓基質細胞與牙周膜細胞的生物學特性比較
王 欣,房 明,劉敏杰,董廣英,王新文,劉玲俠,王勤濤
(第四軍醫大學口腔醫學院,陜西西安 710032)
組織工程是牙周組織缺損較理想的再生性修復方法,合理選擇種子細胞是其成功的關鍵[1]。牙周膜細胞是牙周組織的主要功能細胞,在牙周組織再生中起重要作用,是目前公認的牙周組織再生最佳來源細胞[2]。有動物實驗表明,通過牙周膜干細胞可以構建功能性牙周膜[3-4],但其原代培養成活率低,來源有限。骨髓間充質干細胞也是一種很重要的種子細胞,目前研究較多的是來源于骨髓的間充質干細胞(Bone marrow mesenchymal stem cells,BMSCs)。但因其在骨髓中的含量非常低,所占比例為0.001% ~0.01%[5],而且取材又存在有創性,用其“自體回植”來治療牙周病中的骨吸收,要承受二次創傷,病人接受率較低。Akintoye等[6](2006)研究提示骨髓來源的骨髓基質細胞存在部位差異性,頜骨來源的骨髓基質細胞具有更強的成骨能力,且取材簡便、創傷小,便于自體回植,易被病人接受。本研究旨在對頜骨來源的骨髓基質細胞與牙周膜細胞的生物學特性進行了初步比較,為臨床研究提供參考。
1 材料和方法
1.1 主要試劑和儀器
α-MEM培養液(Hyclone公司,美國);I型膠原酶(Gibco,美國);胰蛋白酶、胎牛血清(杭州四季青生物科技有限公司);β-甘油磷酸鈉(Merck,德國);抗壞血酸、地塞米松、吲哚美辛、IBMX、胰島素、油紅O(Sigma,美國);茜素紅(天津科密歐化學試劑有限公司);CO2孵箱(Shellab,美國);SW-CJ-2D型超凈工作臺(蘇州凈化設備公司);XDS-1 B型倒置相差顯微鏡(重慶光電設備廠);照相系統(SONY,日本);堿性磷酸酶試劑盒、細胞總蛋白試劑盒(中生北控生物科技股份有限公司);小鼠抗人 STRO-1抗體(Santa Cruz,美國);FITC標記的山羊抗小鼠IgG(北京中杉金橋生物技術有限公司)。
1.2 細胞原代培養
1.2.1 牙周膜細胞的分離、培養
選擇12~25歲志愿者因正畸需要拔除的牙周健康、無齲的前磨牙,刮取根中1/3牙周膜組織,移入離心管內,加入3 mg/mL的I型膠原酶消化1 h(37℃,50mL/L CO2),加入培養液(含100 mL/L胎牛血清、200 U/mL慶大霉素、100 U/mL青霉素的α-MEM,簡稱1號培養液)中止消化、離心棄上清,加入培養液3 mL吹懸后接種25 cm2培養瓶,37℃ 、50 mL/L CO2孵箱中進行培養,3 d后更換培養液并棄去未貼壁的細胞,相同條件下繼續培養,2~3 d換液1次,倒置顯微鏡觀察細胞形態。
1.2.2 頜骨骨髓基質細胞的分離、培養
在牙周手術中鉆取頜骨骨松質,PBS反復吹洗3~4次,加入3 mL 1號培養液,接種于25 cm2培養瓶,37℃ 、50 mL/L CO2孵箱中培養,3 d后更換培養液并棄去未貼壁的細胞,相同條件下繼續培養,2~3 d換液1次,倒置顯微鏡觀察細胞形態。
1.3 兩種細胞克隆形成率
分別取對數期生長期的牙周膜細胞和骨髓基質細胞,以1×103/皿接種于直徑60 mm培養皿,靜置培養10 d,每3 d換液1次,鏡下觀察培養板中細胞集落形成情況。10 d終止培養,棄原液,PBS洗3遍,以40 g/L多聚甲醛固定15 min,PBS洗3遍,加適量甲苯胺藍染色液染色15 min,PBS洗去染色液,空氣干燥后,進行細胞克隆計數。以≥50個細胞的集落為1個克隆。并按下列公式計算克隆形成率。

1.4 兩種細胞生長曲線
分別取牙周膜細胞及骨髓基質細胞,以2×103/孔接種于96孔板,加入1號培養液200 μL,37℃、50 mL/L CO2孵箱中培養。連續培養6 d,每天取兩種細胞各3孔(單純加有200 μL培養基為空白對照),每孔加20 μL CCK-8液,常規孵育4 h后用酶標儀檢測各孔450 nm OD值,以時間為橫軸、OD值為縱軸繪制生長曲線。
1.5 間充質干細胞標志STRO-1表達的鑒定
分別取骨髓基質細胞及牙周膜細胞,以1×104/孔接種于96孔板,加入1號培養液200 μL,37℃、50 mL/L CO2孵箱中培養,待細胞單層鋪滿底壁時棄去原液,0.01 mol/L PBS清洗5 min×3次;40 g/L多聚甲醛固定15 min,PBS清洗5 min×3次;3 g/L TritonX-100處理 15 min,PBS振洗5 min×3次。正常羊血清封閉。滴加1∶50稀釋的小鼠抗人 STRO-1抗體(一抗),4℃濕盒過夜,37℃復溫1 h,PBS振洗5 min×3次;滴加1∶200稀釋的FITC標記的羊抗小鼠二抗,37℃孵育1 h,PBS振洗5 min×2次,蒸餾水振洗1次,DAPI復染5 min,陰性對照用PBS代替一抗,其余步驟不變。倒置熒光顯微鏡觀察、照相。
1.6 成脂誘導及油紅O染色
分別取骨髓基質細胞及牙周膜細胞以2×105/瓶,加入3 mL 1號培養液,接種于25 cm2培養瓶,37℃ 、50 mL/L CO2孵箱中培養,待細胞伸展至70%匯合后,換成成脂誘導液(含1 mmol/L地塞米松、0.5 mmol/L IBMX、100 mg/L 消炎痛、10 mg/L胰島素、100 mL/L胎牛血清的α-MEM)繼續培養,每3 d換液1次,誘導培養14 d后,油紅O染色,倒置相差顯微鏡觀察,照相。
1.7 成骨誘導
1.7.1 堿性磷酸酶活性檢測
分別取牙周膜細胞和骨髓基質細胞,以2×104接種于24孔板,每孔加入1號培養液1 mL,37℃、50 mL/L CO2孵箱中培養。待細胞生長至60% ~70%匯合時,兩種細胞各隨機分為兩組,實驗組更換礦化誘導液(含0.01 mol/L β-甘油磷酸鈉、50 μg/mL維生素 C、0.01 mmol/L 地塞米松、100 mL/L FBS的αMEM)對照組使用1號培養液繼續培養。分別于成骨誘導7、9、11、14 d各時間點,實驗組取5孔,對照組取3孔,棄去原培養液,PBS洗3~4次,加入 3 g/L TritonX-100處理15 min,加入蒸餾水,分別以-80℃和37℃反復凍融3次后,提取細胞裂解液,離心取上清加于96孔板,以蒸餾水調零,參考堿性磷酸酶試劑盒說明書用酶標儀檢測405 nm OD值。然后,再取同一孔細胞裂解上清液加于96孔板,以蒸餾水調零,參考細胞總蛋白試劑盒說明書用酶標儀測546 nm OD值。堿性磷酸酶結果用細胞總蛋白標準化(堿性磷酸酶OD值/細胞總蛋白的OD值)。
1.7.2 RT-PCR檢測成骨誘導7 d OCN基因表達
分別取礦化誘導7 d的骨髓基質細胞和牙周膜細胞,按RNAsimple Total RNA Kit說明書提取細胞中總RNA,用SuperScriptTM Kit從提取的 RNA反轉錄合成 cDNA第1鏈,設計合成下述引物(表1),3 -磷酸甘油醛脫氫酶(glycer-aldehyde-3 phosphate dehydrogenase,GAPDH)為內參進行RT-PCR檢測,產物經15 g/L瓊脂糖凝膠電泳鑒定,通過灰度值進行半定量分析成骨相關基因骨鈣蛋白(osteocalcin,OCN)mRNA表達情況。

表1 OCN引物序列
1.8 統計學分析
用SPSS 13.0統計軟件,對所有數據進行單因素方差分析,兩兩比較用t檢驗,檢驗水準α=0.05。
2 結果
2.1 細胞形態學觀察
倒置相差顯微鏡觀察,頜骨來源骨髓基質細胞與牙周膜細胞在體外分離培養條件下,均呈成纖維樣貼壁生長(圖1)。

圖1 兩種細胞形態學比較(×50)
2.2 兩種細胞克隆形成率比較
培養10 d有細胞克隆形成,鏡下觀細胞呈集落狀生長,細胞形態呈梭形,體積較小,排列緊密。骨髓基質細胞獲得克隆株65株,克隆形成率為6.5%;牙周膜細胞獲得克隆集落38株,克隆形成率為 3.8%。
2.3 兩種細胞生長曲線
骨髓基質細胞與牙周膜細胞的生長曲線均呈“S”型,在接種后的第1天細胞數量均稍有減少,此后開始上升。兩種細胞在1~4 d生長狀態相近,此后牙周膜細胞仍保持緩慢上升趨勢,而骨髓基質細胞則進入平臺期(圖2)。

圖2 骨髓基質細胞與牙周膜細胞生長曲線比較
2.4 STRO-1 表達情況
倒置熒光顯微鏡觀察顯示,頜骨骨髓基質細胞及牙周膜細胞STRO-1表達陽性(圖3)。
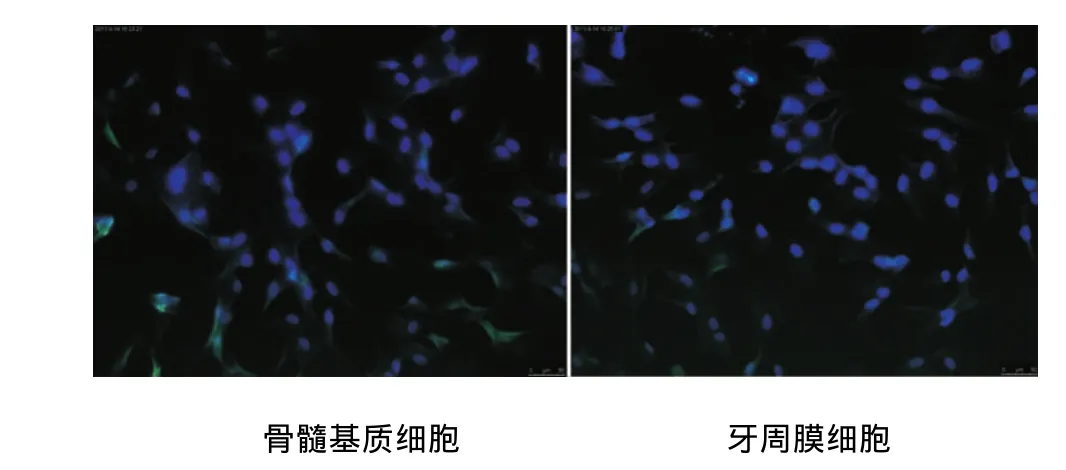
圖3 兩種細胞STRO-1表達情況比較(×20)
2.5 兩種細胞成脂誘導能力比較
成脂誘導14 d油紅O染色,骨髓基質細胞及牙周膜細胞均可見脂滴形成(圖4)。

圖4 兩種細胞成脂誘導14 d油紅O染色(×400)
2.6 兩種細胞成骨能力比較
2.6.1 堿性磷酸酶活性
成骨誘導后經堿性磷酸酶活性的定量檢測顯示,兩種細胞實驗組在7 d時即有堿性磷酸酶的分泌,前者較高,之后快速上升9 d時達高峰,然后逐漸下降,而牙周膜細胞實驗組在9 d開始一直保持緩慢上升趨勢;相對比較來看,骨髓基質細胞對照組,7~9 d堿性磷酸酶活性較弱,此后開始出現上升,與牙周膜細胞實驗組趨勢相近,而牙周膜細胞對照組一直保持較低水平(圖5)。

圖5 成骨誘導不同時間點堿性磷酸酶的OD值
2.6.2 成骨相關基因OCN表達情況
成骨誘導7 d時,RT-PCR檢測BMSCs細胞有OCN的明顯表達,PDLCs未表達;14 d時,PDLCs略有表達,而BMSCs的0CN基因表達更強,各時間點相比,兩者差異均具有顯著性(P<0.05)(圖6)。

圖6 成骨誘導7、14 d時,OCN基因的表達情況
3 討論
本研究借鑒Akintoye等[6]的取材及原代培養方式,鉆取頜骨骨松質,組織塊培養法進行頜骨骨髓基質細胞的培養。與牙周膜細胞比較,其取材及原代培養方式比較簡單、成活率高。
克隆化生長是干細胞的基本特性之一。本實驗通過克隆平皿實驗法,將一定數量的兩種細胞的單細胞懸液均勻接種培養,一定時間后計數單細胞形成的克隆情況,所得結果與文獻中報道的上、下頜骨、髂骨來源骨髓基質細胞(54、17、37/100000)[6]、牙周膜干細胞(40 ~ 45/5000)[7]等存在差異,這可能與培養環境、方法、條件及細胞自身的克隆形成能力有關,但至少能在一定程度上說明兩種細胞具有克隆形成能力,可以自我更新。
STRO-1是間充質細胞的表面標志物,成體干細胞生存在特殊的微環境中,信號分子調控干細胞維持在正常功能狀態,STRO-1陽性為來源于前血管微環境中干細胞的特征性標志[8-10],常被用來鑒定骨髓基質干細胞、牙周膜干細胞和牙髓干細胞。本實驗中,培養的骨髓基質細胞及牙周膜細胞經免疫細胞熒光染色,細胞表面標志物STRO-1陽性表達,說明兩種細胞均有一定的干細胞潛質。
堿性磷酸酶(ALP)是成骨分化早期的標志物,即使在骨細胞的形成期表達依然很強,因此ALP活性測定是成骨檢測較為常用的方法。本實驗中測定了成骨誘導后7、9、11、14 d等ALP活性變化趨勢。骨髓基質細胞實驗組與牙周膜細胞實驗組比較,能在早期即顯示較高的ALP活性,在9 d時達高峰,說明在誘導條件下,前者更容易向成骨方向分化;而骨髓基質細胞對照組雖然ALP活性不及實驗組,但與牙周膜細胞對照組比較,其在9 d后仍表現出明顯上升趨勢,這可能與骨髓基質細胞在非誘導條件下即可向成骨方向自分化有關。
ALP基因是成骨細胞分化的早期標志物,OCN基因則是成骨細胞分化的成熟期或晚期標志物。通過檢測ALP和骨鈣素這兩種成骨活性的典型標志可以用來基本判定成骨性能[11]。本實驗中成骨誘導7 d時,骨髓基質細胞已經有ALP的分泌,基因水平有OCN的表達,9~14 d時ALP的活性逐漸呈下降趨勢,OCN基因的表達升高,這可能與細胞逐漸進入礦化期有關;而牙周膜細胞的ALP分泌在觀察期內,一直呈緩慢上升趨勢,至成骨誘導14 d時,OCN基因仍無明顯表達,一定程度上可以說明細胞還未進入礦化期。
本實驗借鑒談珺等[12]關于牙周炎性組織中干(祖)細胞的初步鑒定方法,從形態學、克隆形成率、間充質干細胞特異的STRO-1表達和橫向誘導分化等方面對其進行了體外初步鑒定,進一步說明頜骨來源的骨髓基質細胞存在具有干細胞特性的細胞,如要證明其為干細胞,還需要進一步的研究。通過比較初步可以認為頜骨來源的骨髓基質細胞具有很強的增殖能力,在誘導及非誘導條件下,均能表現出成骨分化特性;但兩種細胞作為種子細胞,運用于牙周組織再生中的差異,尚需要大量的體內實驗進一步研究。
[1]Bartold PM,Shi S,Gronthos S.Stem cells and periodontal re-generation[J].Periodontol,2000,2006,40:164 -172.
[2]Lekic PC,Rajshankar D,Chen H,et al.Transplantation of labeled periodontal ligament cells promotes regeneration of alveolar bone[J].Anat Rec,2001,262(2):193 -202.
[3]Gronthos S,Mrozik K ,Sbi S,et al.Ovine periodontal ligaraentstem cells:isolation,characterization,and differentiation potential[J].Calcif Tissue Int,2006,79(5):310 -317.
[4]Sonoyarna W ,Liu Y ,Fang D,et al.Mesenchymal stem cell mediated functional tooth regeneration in swine[J].Plos One,2006,1:e79.
[5]Pittenger MF,Mackay AM,Beck SC,et al.Muhilineage potential of adult human mesenchymal stem cells[J].Science,1999.284(5411):143-147.
[6]Akintoye SO,Lam T,Shi S,et al.Skeletal site-specific characterization of orofacial and iliaccrest human bone marrow stromal cells in same individuals[J].Bone,2006,38(6):758 -768.
[7]Singhatanadgit W,Donos N,Olsen I.Isolation and characterization of stem cell clones from adult human ligament[J].Tissue Eng Part A,2009,15(9):2625 -2636.
[8]Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625 -13630.
[9]Shi S,Gronthos S.Perivascular niche of postnatal mesenchymal stem cells in human bone marrow and dental pulp[J].J Bone Miner Res,2003,18(4):696 -704.
[10]Gronthos S,Brahim J,LI KW,et al.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81(8):531 -535.
[11]Shimizu K.Ito A,Honda H.Mag-seeding of rat bone marrow stromal cells into porous hydroxyapatite scaffolds for bone tissue engineering[J].J Biosci Bioeng,2007,104(3):l71 - 177.
[12]談珺,周麗華,周揚,等.人牙周炎癥組織中干(祖)細胞的分離培養及初步鑒定[J].牙體牙髓牙周病學雜志,2011,21(3):130-133.

