多酚氧化酶交聯β-酪蛋白的抗原性變化初步研究
程 偉,高金燕,李 欣,劉法輝,陳紅兵
(1.南昌大學食品科學與技術國家重點實驗室,江西南昌330047; 2.南昌大學中德聯合研究院,江西南昌330047; 3.南昌大學環境與化學工程學院,江西南昌330047; 4.南昌大學生命科學與食品工程學院,江西南昌330047)
多酚氧化酶交聯β-酪蛋白的抗原性變化初步研究
程 偉1,2,3,高金燕1,4,李 欣1,4,劉法輝1,4,陳紅兵1,2,*
(1.南昌大學食品科學與技術國家重點實驗室,江西南昌330047; 2.南昌大學中德聯合研究院,江西南昌330047; 3.南昌大學環境與化學工程學院,江西南昌330047; 4.南昌大學生命科學與食品工程學院,江西南昌330047)
利用多酚氧化酶催化牛乳β-酪蛋白交聯,并通過ELISA方法檢測交聯前后β-酪蛋白抗原性的變化。SDS-PAGE結果顯示,多酚氧化酶可以有效地催化β-酪蛋白交聯。同時,間接競爭ELISA檢測的β-酪蛋白交聯后的半抑制濃度(IC50值)由2.63μg/mL變為4.07μg/mL,表明交聯后β-酪蛋白抗原性明顯降低。本研究工作為通過多酚氧化酶交聯制備低致敏性乳制品提供了部分理論依據。
多酚氧化酶,酶交聯,β-酪蛋白,牛奶過敏
酶交聯蛋白技術是食品非熱加工中的一種新方法,它是利用酶催化蛋白質發生交聯反應,使蛋白質內部多肽鏈之間(分子內交聯)或蛋白質之間(分子間交聯)形成共價鍵,改變其原有的空間結構,從而改善蛋白質的乳化性、起泡性等一系列功能特性[1]。已報道用于催化蛋白質交聯的酶有轉谷酰胺酶、過氧化物酶、多酚氧化酶等[2]。其中,多酚氧化酶(Polyphenol oxidase,PPO;EC 1.14.18.1),通常也稱為酪氨酸酶,是由核編碼的含銅金屬酶,廣泛存在于各種動物、植物和微生物中,是果蔬等農產品發生酶促褐變的主要原因[3],這也是人們早期對其功能的認識。新近的一些研究表明,多酚氧化酶也能夠催化乳蛋白發生交聯反應[4]。目前,酶交聯乳蛋白的研究主要集中于改善其乳化性、起泡性等功能性[5],而對交聯后乳蛋白的抗原性變化研究報道較少,且國內未見關于PPO交聯牛乳蛋白后其抗原性變化的相關報道。本研究采用雙孢蘑菇多酚氧化酶催化牛乳中主要過敏原β-酪蛋白(β-Casein,β-CN)進行交聯,并分析交聯后β-酪蛋白抗原性的變化,旨在利用交聯技術降低牛乳過敏原蛋白質的抗原性,為利用酶交聯技術制備低致敏性乳制品提供理論依據。
1 材料與方法
1.1 材料與設備
雙孢蘑菇 市售;β-酪蛋白 實驗室自制;咖啡酸、羊抗兔IgG:HRP酶標二抗、OPD底物 美國Sigma公司;96孔可拆酶標板 深圳金燦華實業有限公司;鄰苯二酚、丙酮、磷酸氫二鈉、磷酸二氫鈉等常規試劑 均為國產分析純。
Allegra 64R高速冷凍離心機 美國Beckman公司;Model 860酶聯免疫檢測儀、BIO-RAD凝膠成像系統 美國Bio-Rad公司;TU-1901雙光束紫外可見分光光度計 北京普析通用儀器有限責任公司。
1.2 實驗方法
1.2.1 PPO酶液制備 取市售的新鮮雙孢蘑菇去皮、切碎,放入研缽中,加入液氮,迅速用研缽研磨至無明顯顆粒的粉末狀。加入預冷丙酮(-20℃),用布氏漏斗進行抽濾,將得到的粉末經真空冷凍干燥后,即得多酚氧化酶粗酶粉,-20℃保存備用。取多酚氧化酶丙酮粉2.5g,加入4℃預冷的50mL磷酸鹽緩沖液(0.05mol/L、pH 7.0),磁力攪拌30min,4000×g離心20min,取上清液即為多酚氧化酶酶液[6]。
1.2.2 PPO酶活測定 參照Gawlik-Dziki[7]等的方法,用磷酸鹽緩沖液(0.05mol/L、pH 7.0)配制0.04mol/L鄰苯二酚溶液。測酶活時,取2.8mL鄰苯二酚溶液作為反應底物,加入0.2mL粗酶液,混勻后在420nm波長處比色,從酶液加入后開始計時,每30s記錄1次OD420nm值,以最初直線段的斜率計算酶比活力。一個酶活力單位定義為在測定條件下,每分鐘引起光密度值改變0.001所需的酶量。
1.2.3 抗β-酪蛋白多克隆抗體的制備 按照常規免疫方法[8],利用本實驗室分離得到的β-酪蛋白免疫日本大耳兔,制備抗β-酪蛋白多克隆抗體。選取2只 8周齡大的雄性日本大白耳兔(體重 1.8~2.0kg),編號為A、B,所選日本大白耳兔喂養的食物中確保不含牛乳蛋白。喂養一周無異常后,開始免疫。免疫前,耳靜脈采血作為陰性血清。
β-酪蛋白與弗氏完全佐劑1∶1混勻乳化后皮下多點注射日本長耳大白兔,免疫劑量為1mg/只。等量的抗原與弗氏不完全佐劑乳化后每隔兩周加強免疫,并用間接ELISA法檢測兔血清的效價,當抗體效價升高并平穩后即動脈取血獲得多克隆抗體。
1.2.4 PPO酶促交聯β-酪蛋白方案 β-酪蛋白用磷酸鹽緩沖液(0.05mol/L、pH 7.0)稀釋至1.0mg/mL,加入100mmol/L咖啡酸并使其終濃度為1mmol/L,然后繼續加入PPO粗酶液,并使反應體系中多酚氧化酶濃度達到1.000U/mL,最后補充蒸餾水使β-酪蛋白溶液終質量濃度為0.5mg/mL,混勻,30℃反應6h后,放入-20℃保存。同時設空白組和對照組,空白組為0.5mg/mL的β-酪蛋白,對照組為用滅活的酶(滅活條件:90℃,10min)代替反應體系中的多酚氧化酶。
實驗得到的交聯產物,按照Laemmli[9]的方法,進行SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE),根據蛋白條帶的變化分析并觀察β-酪蛋白的交聯情況。
1.2.5 競爭ELISA法檢測交聯前后β-酪蛋白的抗原性 采用間接競爭抑制ELISA方法[10-11],檢測PPO交聯β-酪蛋白后的抗原性變化。實驗步驟如下。
1.2.5.1 抗原包被 用包被液稀釋β-酪蛋白至濃度為6.25μg/mL,100μL/孔加入酶標板A中,4℃過夜。
1.2.5.2 洗滌 次日傾去孔內的液體,用250μL/孔PBST(含0.05%吐溫-20的磷酸鹽緩沖液,10mmol/L,pH 7.4)溶液洗板3次,甩干。
1.2.5.3 封阻 酶標板A中加入3%的明膠進行封阻,每孔250μL,37℃放置1h。
1.2.5.4 板外競爭 另取一塊新的酶標板B,先用3%的明膠封阻1h后,洗滌,然后分別加入不同稀釋濃度的競爭蛋白(β-酪蛋白和交聯蛋白),再加入等體積的一抗,37℃孵育1h。
1.2.5.5 加樣 酶標板A封阻結束后,從酶標板B孔中吸取競爭蛋白與一抗的混合物以100μL/孔的量對應加入酶標板A孔內,于37℃孵育1h。
1.2.5.6 加酶標二抗 用PBS將羊抗兔IgG:HRP酶標二抗稀釋,加入100μL/孔,37℃孵育1h。
1.2.5.7 顯色 加新鮮配制的OPD底物溶液100μL/孔,37℃暗處反應15min。
1.2.5.8 終止反應 加 50μL/孔終止液(2mol/L H2SO4)中止反應。
1.2.5.9 比色 用酶聯免疫檢測儀在490nm下測定各孔的吸光值。
根據得到的OD值,將各濃度的2種競爭蛋白(β-CN和β-CN交聯蛋白)對應的OD值轉換成結合率(B/B0)的%值,無競爭蛋白時的OD值為B0,各濃度的競爭蛋白對應的 OD值為 B。然后,以(B/B0)的%值為縱坐標,以相對應的競爭蛋白濃度的對數值—lg[競爭蛋白]為橫坐標,繪制競爭ELISA標準曲線,并計算出IC50值,比較β-CN和β-CN交聯蛋白的IC50值,并確定其抗原性變化。
2 結果與分析
2.1 多酚氧化酶性狀
實驗制備得到的多酚氧化酶酶液成透亮的棕色液體,測得酶活為6300U/mL。
2.2 抗牛乳β-酪蛋白兔血清效價
用間接ELISA法測得兔血清效價,結果如圖1所示,至免疫第9周,兔血清效價不再升高,即動脈取血獲得多克隆抗體。最終測定A兔血清效價為1∶240000,B兔為1∶150000。選用A兔血清用于后續抗原性評價實驗。
2.3 交聯蛋白的SDS-PAGE圖譜分析
β-酪蛋白交聯后的 SDS-PAGE圖譜如圖2所示。
根據圖2可以看出,多酚氧化酶催化交聯β-酪蛋白后,原有低分子量β-酪蛋白幾乎完全消失,轉而生成了大量高分子量的交聯蛋白。可見,在本實驗條件下,多酚氧化酶主要催化β-酪蛋白分子間的交聯反應,β-酪蛋白通過分子間交聯生成了多聚體,隨著β-酪蛋白多聚物的形成,其蛋白質化學結構會有所改變,可以推測它的抗原性也會隨之受到影響。
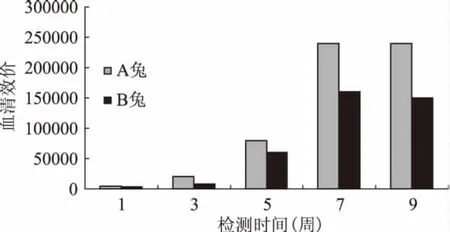
圖1 兔對牛乳β-酪蛋白的免疫應答(抗血清效價的變化)Fig.1 Immune response of the rabbits against β-casein(Antiserum change defined by ELISA)
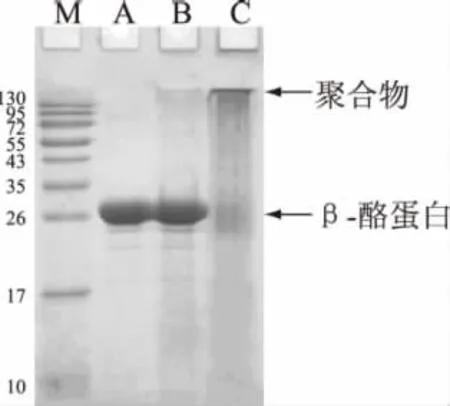
圖2 PPO對β-酪蛋白的交聯效果Fig.2 Effect of PPO on the cross linking of β-casein
2.4 多酚氧化酶交聯β-酪蛋白后的抗原性變化
間接競爭ELISA法檢測β-酪蛋白交聯前后的抗原性結果如表1所示。
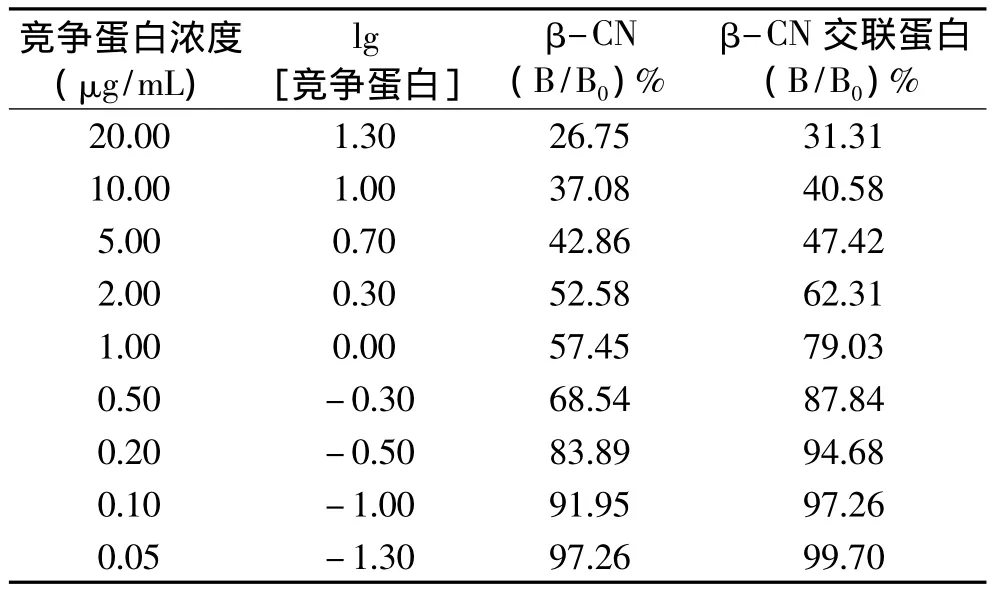
表1 β-CN與β-CN交聯蛋白間接競爭ELISA結果Table 1 Results of indirect competitive ELISA for β-CN and β-CN cross-linked protein
根據間接競爭ELISA結果繪制標準曲線如圖3所示。

圖3 間接競爭ELISA法標準曲線Fig.3 Standard curve by indirect competitive ELISA
在間接競爭 ELISA標準曲線中,當結合率(B/B0)%為50%時,則其抑制率也為50%,此時所對應的競爭抗原的濃度就為半抑制濃度,也稱IC50值。在抗原抗體反應中,IC50的數值越大,表明達到半抑制率所需的競爭抗原量越多,也就是競爭抗原與特異性IgG的結合能力越弱,即抗原性越弱。從本實驗得到標準曲線可以得出,β-CN的IC50值為2.63μg/ mL,β-CN交聯蛋白的IC50值為4.07μg/mL。由此可見,β-CN交聯后的IC50值明顯升高,即β-酪蛋白經過多酚氧化酶催化交聯后,交聯蛋白與特異性IgG的結合能力減弱,其抗原性明顯降低。
3 討論
酶交聯蛋白技術作為一種可以有效改善食品蛋白質功能特性的手段,已經成功地運用于許多食物蛋白的結構與功能的改性中,但由于交聯位點以及空間位阻等原因,常用的轉谷氨酰胺酶不適于直接催化天然狀態的乳清蛋白交聯,除非加入二硫蘇糖醇等還原劑,這限制了轉谷氨酰胺酶在乳蛋白交聯中的發展。多酚氧化酶作為一種新興的催化蛋白交聯的酶類,受到越來越多的關注。本實驗中研究利用雙孢蘑菇中提取的多酚氧化酶催化牛乳β-酪蛋白交聯,證明其可以有效地催化β-酪蛋白交聯,并生成多聚體形態的交聯蛋白,這進一步驗證和顯示了多酚氧化酶在乳蛋白交聯中的應用潛力。
最近,Leszczyńska等研究發現,用轉谷氨酰胺酶處理的面粉,可以使其過敏原性降低30%[12],同時Garcia等發現,過氧化物酶也可以降低蘋果中過敏原Mal d1的特異性IgE結合能力[13]。這一系列研究報道,預示了酶交聯技術可能成為一種降低食物過敏原性的新方法,值得深入探索。本研究結果顯示,利用多酚氧化酶催化交聯β-酪蛋白,交聯反應生成的β-酪蛋白交聯蛋白與自然狀態的β-酪蛋白相比,其抗原性明顯降低。這可能是由于多酚氧化酶催化β-酪蛋白交聯而形成多聚體,使部分原來暴露在蛋白質表面的過敏原表位被包裹進蛋白質內部,掩蓋了原有的一些過敏原表位,因而降低β-酪蛋白的抗原性。
牛乳及乳制品因其豐富的營養而深受人們的喜愛,但同時,牛乳及乳制品又是一類常見的食物過敏原,流行病學研究資料顯示,2%~2.5%的嬰幼兒會對牛乳產生過敏反應[14-15],牛乳過敏的潛在性、廣泛性和長期性使其成為乳制品行業發展的一大難題。目前,低致敏牛乳的生產主要依據酶水解技術,利用多種蛋白酶對牛乳進行限制性水解而減少其過敏原表位,達到降低過敏原性的目的,但在水解過程中不可避免的會產生苦味肽,這大大影響了牛乳的風味。本研究結果進一步表明,酶交聯蛋白技術可以明顯降低牛乳的抗原性,為利用多酚氧化酶交聯制備低致敏性乳制品提供了部分理論依據,具有廣闊的應用前景。
[1]Anuradha S,Prakash V.Altering functional attributes of proteins through cross linking by transglutaminase-A case study with whey and seed proteins[J].Food research international,2009,42(9):1259-1265.
[2]程偉,陳紅兵,高金燕,等.酶改性對食物蛋白質過敏原性的影響[J].食品科學,2010,31(23):391-394.
[3]代麗,宮長榮,史霖,等.植物多酚氧化酶研究綜述[J].中國農學通報,2007,23(6):322-326.
[4]Buchert J,Ercili Cura D,Ma H,et al.Crosslinking food proteins for improved functionality[J].Annual Review of Food Science and Technology,2010(1):113-138.
[5]Hiller B,Lorenzen PC.Functional properties of milk proteins as affected by enzymatic oligomerisation[J].Food Research International,2009,42:899-908.
[6]吳進菊,高金燕,劉瀟,等.雙孢蘑菇多酚氧化酶交聯作用對酪蛋白乳化性及其穩定性的影響[J].食品科學,2010,31 (15):117-120.
[7]Gawlik-Dziki U,Zlotek U,Swieca M.Characterization of polyphenol oxidase from butter lettuce(Lactuca sativa var.capitata L.)[J].Food Chemistry,2008,107(1):129-135.
[8]楊苗,侯先志,楊銀芬,等.牛-β-酪蛋白多克隆抗體的制備及鑒定[J].中國獸醫科學,2010,40(11):1180-1183.
[9]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227: 680-685.
[10]WroblewskaB,KaramacM,AmarowiczR,etal. Immunoreactive properties of peptide fractions of cow whey milk proteins after enzymatic hydrolysis[J].International Journal of Food Science and Technology,2004,39:839-850.
[11]布冠好,鄭喆,鄭海,等.牛乳過敏原β-乳球蛋白間接競爭ELISA檢測方法的建立[J].中國農業大學學報,2008,13 (6):71-76.
[12]LeszczyńskaJ,LckaA,BryszewskaM.Theuseof transglutaminase in the reduction of immunoreactivity of wheat flour[J].Food and Agricultural Immunology,2006,17(2): 105-113.
[13]Garcia A,Wichers J H,Wichers H J.Decrease of the IgE-binding by Mal d1,the major apple allergen,by means of polyphenol oxidase and peroxidase treatments[J].Food Chemistry,2007,103(1):94-100.
[14]Selo I,Clement G,Bernard H,et al.Allergy to bovine betalactoglobulin:specificity of human IgE to tryptic peptides[J].Clin Exp Allergy,1999,29(8):1055-1063.
[15]Heinzmann A,Blattmann S,Spuergin P,et al.The recognition pattern of sequential B cell epitopes of beta-lactoglobulin does not vary with the clinical manifestations of cow’s milk allergy[J]. International Archives of Allergy and Immunology,2000,120(4): 280-286.
Antigenicity changes of enzymatically crosslinked β-casein by polyphenol oxidase
CHENG Wei1,2,3,GAO Jin-yan1,4,LI Xin1,4,LIU Fa-hui1,4,CHEN Hong-bing1,2,*
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China; 2.Sino-German Joint Research Institute,Nanchang University,Nanchang 330047,China; 3.School of Environmental and Chemical Engineering,Nanchang University,Nanchang 330047,China; 4.School of Life Sciences and Food Engineering,Nanchang University,Nanchang 330047,China)
The study focused on the antigenicity changes of cross-linked β-casein catalyzed by polyphenol oxidase using indirect competitive ELISA method.The SDS-PAGE profile showed that the polyphenol oxidase could catalyze the cross-linked β-casein effectively.Meanwhile,according to the results of indirect competitive ELISA,the half inhibitory concentration(IC50values)of β-casein after crosslinked changed from 2.63μg/mL into 4.07μg/mL,indicating the antigenicity of crosslinked β-casein decreased significantly.It might provide some theoretical basis for developing hypoallergenic dairy through protein crosslinking by polyphenol oxidase.
polyphenol oxidase;enzymatic cross-linking;β-casein;milk allergy
TS201.2+5
A
1002-0306(2012)08-0219-04
2011-05-23 *通訊聯系人
程偉(1986-),男,碩士研究生,研究方向:生物加工工程。
國家自然科學基金(30860220,31171716);教育部新世紀優秀人才支持計劃(NCET-08-0704);國家科技支撐計劃項目(2011BAK10B03);南昌大學食品科學與技術國家重點實驗室項目(SKLF-MB-201002,SKLF-TS-201109);南昌大學研究生創新專項資金項目。

