反相高效液相色譜法測定5種藏羌五加菜中金絲桃苷的含量
李艷丹,黃艷菲,丁 玲,左 旭,劉 圓*
(西南民族大學民族醫藥研究院,四川 成都 610041)
反相高效液相色譜法測定5種藏羌五加菜中金絲桃苷的含量
李艷丹,黃艷菲,丁 玲,左 旭,劉 圓*
(西南民族大學民族醫藥研究院,四川 成都 610041)
目的:建立5種藏羌五加菜中金絲桃苷的反相高效液相色譜法含量測定方法,并比較其金絲桃苷的含量差異。方法:采用液相色譜-質譜定性鑒別紅毛五加、糙葉藤五加和蜀五加中金絲桃苷。金絲桃苷提取物通過60%乙醇溶液回流提取105min制得;Kromasil C18柱(4.6mm×250mm,5μm)、柱溫30℃,流動相甲醇(A)-0.5%磷酸溶液(B),梯度洗脫;檢測波長355nm,流速1mL/min。結果:金絲桃苷在0.17~2.55mg范圍內峰面積與進樣量具有良好的線性關系,回歸方程Y=2×106X+1.94883×106(r=0.9990,n=6)。平均回收率100.31%,RSD為0.95%(n=9)。結論:本法簡便、準確、重復性好,可用于五加菜質量的控制方法研究。四川阿壩藏族羌族自治州、四川甘孜藏族自治州的五加屬植物中金絲桃苷含量:老葉遠低于嫩葉;糙葉藤五加嫩葉(低溫烘干品)≈蜀五加嫩葉(低溫烘干品)>紅毛五加嫩葉(低溫烘干品)>無梗五加嫩葉(低溫烘干品);糙葉藤五加的不同加工工藝:陰干>茶葉>烘干>熱燙≈微波干燥≈曬干>>鹽漬>凍藏1個月≈熱燙后凍藏1個月。
藏羌五加菜;金絲桃苷;反相高效液相色譜;液相色譜-質譜;含量
在四川藏、羌族地區民間廣泛食用一類在當地稱為五加菜的嫩葉,認為具有驅風除濕、強壯筋骨的作用。當地藏、羌族牧民一般將其直接炒食或煮湯或熱燙后涼拌食用或熱燙后家用冰箱冷凍保藏一年慢慢食用等。經鑒定該類嫩葉為五加科五加屬植物紅毛五加Acanthopanax giraldii Harms、糙葉藤五加A. leucorrhigus var. fulvescens Harms & Rehd和蜀五加A. setchuenensis Harms ex Diels等同屬植物的嫩葉,三者均有作為五加皮類藥材的文獻記載;紅毛五加A. giraldii Harms主要分布于四川、甘肅、青海、寧夏等省;糙葉藤五加分布在湖南、廣東、廣西、四川等以莖皮或根入藥;蜀五加主要分布在四川和陜西等地,以莖皮入藥[1]。原主產于黑龍江省山區,現主產于東北的刺五加嫩葉開發成刺五加茶,并申請了相關的專利[2-4],而四川藏、羌族地區五加屬植物的茶葉和相關食品研究和專利申請仍是空白,是極具開發價值和前景的新藥食同源植物,因此對四川產的藏羌五加菜的系統研究與開發利用具有較大的經濟價值和學術價值。金絲桃苷(hyperoside)是黃酮醇苷類化合物,結構為槲皮素-3-半乳糖苷[5],又名田基黃苷、海棠因,現代藥理研究[6-10]表明具有局部鎮痛、抗乙肝病毒、抗氧化作用,對肝臟、心肌、腦缺血損傷和腦梗塞等均有保護作用,對神經系統、循環系統、消化系統、免疫系統等具有調節活性,臨床上主要用于治療抗菌、抗炎、止咳、平喘、祛痰、心腦血管疾病等,近年來,將金絲桃苷開發用于治療抑郁、乙肝等疾病已成為國內外研究熱點[11-12]。課題組前期對四川產紅毛五加進行了比較系統的相關研究[13-15]。
本實驗擬先采用液相色譜-質譜(liquid chromatography-mass spectrometry,LC-MS)聯用技術對紅毛五加、蜀五加和糙葉藤五加中的金絲桃苷進行定性鑒別;進而采用反相高效液相色譜(reverse phase-high performance liquid chromatography,RP-HPLC)測定并比較紅毛五加、蜀五加和糙葉藤五加的老葉、嫩葉及不同種嫩葉的不同加工工藝中金絲桃苷的含量,以期為藏羌五加菜新資源食品和功能食品開發、金絲桃苷的新來源和資源綜合利用提供參考。
1 材料與方法
1.1 材料
無梗五加嫩葉由寬甸天奧短梗五加種植基地提供,是目前有市售的五加屬植物嫩葉,刺五加老葉自采于湖北省,其余樣品采自于四川阿壩藏族羌族自治州、四川甘孜藏族自治州,經劉圓教授鑒定,具體來源信息見表1。各樣品均根據嫩葉的采摘方法,一般在10時左右。選擇形態整齊美觀、無斑點、無害蟲、有光澤的葉片進行采摘。
1.2 試劑與儀器
金絲桃苷 中國食品藥品檢定研究院;乙醇為色譜純,其余試劑均為分析純。
W2695 Separations Module高效液相色譜(W2996二極管陣列檢測器;Empower色譜工作站) 美國Waters公司;LCQ型質譜儀 美國Finigan;Milli-Q超純水系統儀;AE240電子分析天平 梅特勒-托利儀器(上海)有限公司。
1.3 方法
1.3.1 加工工藝
烘干:將采摘的藏五加菜葉于40℃電熱鼓風干燥箱中干燥48h,定期翻動。
曬干:將采摘的藏五加菜置于日光白天溫度18~32℃下曬干,曬干處理持續2d,定期翻動。
陰干:將采摘的藏五加菜放在陰涼通風處干燥1個月,定期翻動。
微波干燥:將采摘的藏五加菜放于家用微波爐(功率為900W)蔬菜鍵下中干燥7~15min。
熱燙或熱燙后冷藏:將采摘的藏五加菜置入沸水中,熱燙2~5min;晾涼后放入-18℃的冰箱中儲藏。
腌漬:采用干腌法。腌制前將藏五加菜晾半干。取一定量食鹽均勻撒在五加菜上,拌勻,使菜體中部分汁液外滲,擠出汁液。入缸時采用放一層菜加一層干鹽的方式,先在缸底鋪一層底鹽,再在鹽層上放一層蔬菜,壓緊,然后再撒一層鹽,再鋪一層菜,把菜體壓緊。如此反復,將菜腌至缸口,最后在菜體上面撒一層食鹽,再壓上重物,擠出滲出的汁液。腌制中要注意掌握,上層用鹽量比下層多一些。當食鹽吸收菜體中的水分而溶化后,鹽水下淋,使鹽分均勻地滲入到原料中去。一般加鹽量應為10%左右。
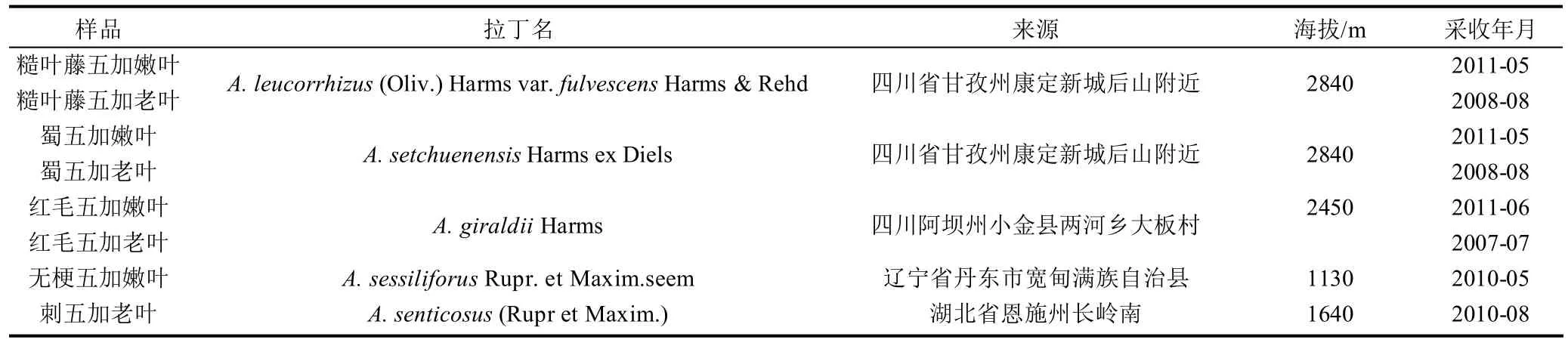
表1 5種五加屬植物來源(n=3)Table 1 Details of 5 Acanthopanax species tested in the present study
制茶葉:挑選出更嫩的藏五加菜嫩葉,去掉較老的葉柄。攤涼與萎凋:將采摘的五加新葉攤放開,定期輕翻動2~3次,當頂葉下垂并失去光澤、水分減少10%左右、手捏有彈性時即可。高溫殺青:殺青溫度為200~220℃,殺青時間為5~8min。揉捻:將殺青后的五加嫩葉采用輕、重、輕的原則,揉捻5~6min,使葉片卷成條索,破碎葉細胞擠出汁,粘附于葉表面,易于沖泡。烘干:將形成球形的藏五加葉茶用不銹鋼篩網盤裝好,厚度為2cm左右,置入烘干箱中烘干,溫度設定為60~70℃,時間4~5h。取出即得。
凍藏:將采摘的藏五加菜嫩葉直接放入-18℃冰箱中儲藏。
1.3.2 溶液的配制
對照品溶液的制備:精密稱取金絲桃苷對照品適量,加乙醇配制成0.17mg/mL溶液。
供試品溶液制備:精密稱定藥粉(過40目篩)0.5g,置圓底燒瓶中,加入50mL 60%乙醇溶液,回流105min,取出,放冷,過濾,取續濾液,定容至50mL,用微孔濾膜(0.45μm)濾過,即得。
1.3.3 儀器條件
質譜條件為電噴霧電離源(electrospray ionization source,ESI),鞘氣為N2,流速為30L/min;輔助氣為N2,流速為5L/min;霧化電壓3.5kV;毛細管電壓9.66V;毛細管溫度300℃;離子極性為負離子。Krosmasil C18色譜柱(4.6mm×250mm,5μm),柱溫30℃。流動相為乙醇(A)-0.5%磷酸水溶液(B),梯度洗脫,程序為:基線(A:B=30:70)、0~4min(A:B=35:65)、5~18min(A: B=40:60)、19~30min(A:B=50:50);檢測波長355nm,流速1mL/min。
2 結果與分析
2.1 金絲桃苷質譜分析
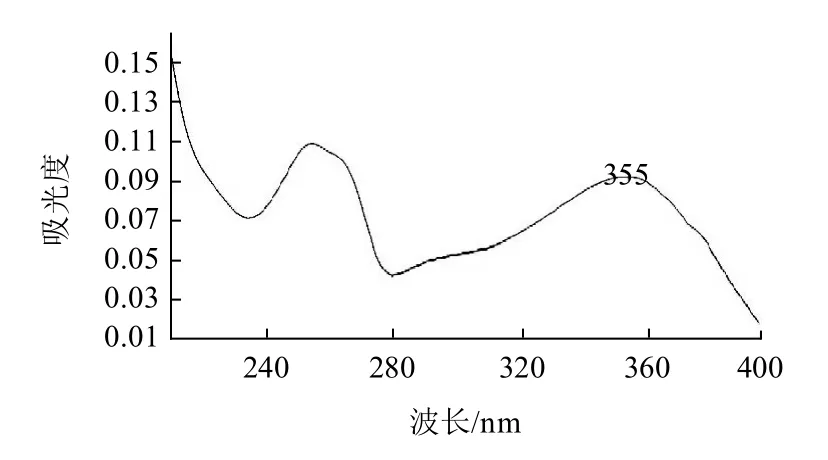
圖1 金絲桃苷紫外吸收譜圖Fig.1 Ultraviolet absorption spectrum of hyperoside
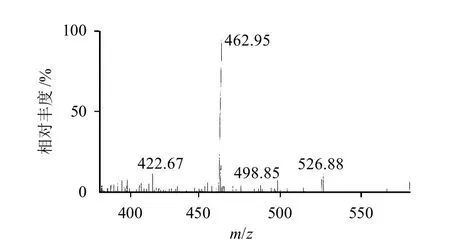
圖2 金絲桃苷質譜圖Fig.2 Mass spectrum of hyperoside
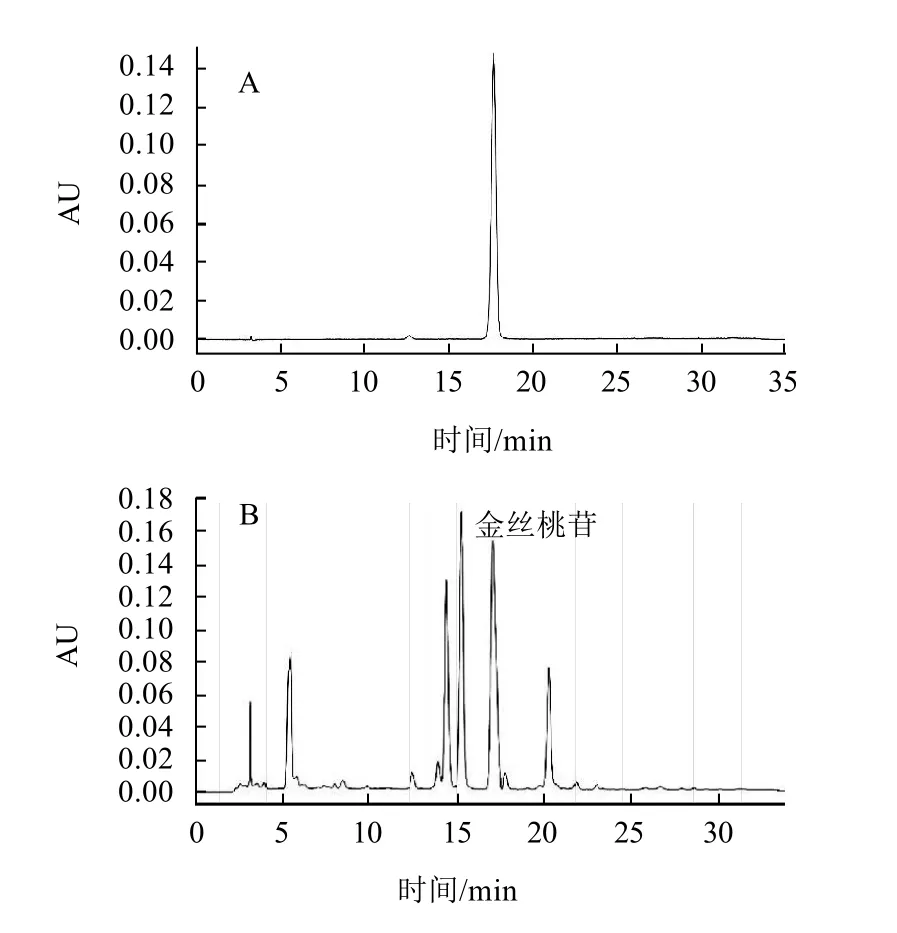
圖3 金絲桃苷對照品(A)和糙葉藤五加嫩葉低溫烘干品(B)色譜圖Fig.3 Mass spectra of hyperoside reference substance (A) and hyperoside extracted from low-temperature dried tender leaves of A. leucorrhizus (Oliv.) Harms var. fulvescens Harms & Rehd (B)
金絲桃苷紫外吸收見圖1、質譜圖見圖2,金絲桃苷的[M-H]-為m/z 462.95。對照品及樣品溶液的色譜圖見圖3。
2.2 提取方法優化
2.2.1 提取溶劑的選擇
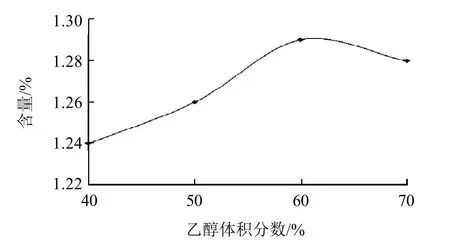
圖4 不同乙醇體積分數對提取糙葉藤五加嫩葉(烘干品)金絲桃苷含量的影響Fig.4 Effect of ethanol concentration on determination of hyperoside content in low-temperature dried tender leaves of A. leucorrhigus var. fulvescens Harms & Rehd
分別精密稱取糙葉藤五加烘干品粉末(40目)0.5g,分別用40%、50%、60%、70%乙醇溶液50mL作提取溶劑,回流2h,最后定容至50mL,用微孔濾膜(0.45μm)濾過,即得。考察結果見圖4,表明當乙醇體積分數為60%時,樣品金絲桃苷提取率最大,故本實驗選擇60%的乙醇溶液作為提取溶劑。
2.2.2 提取時間的選擇
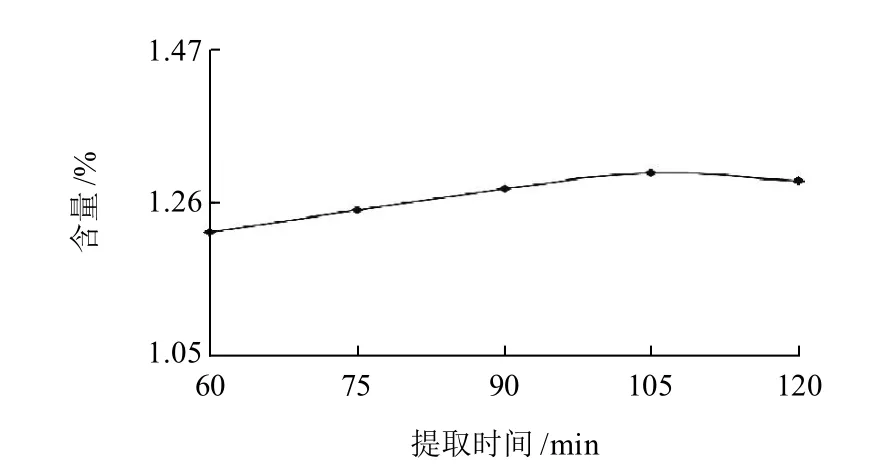
圖5 不同提取時間對提取糙葉藤五加烘干品金絲桃苷含量的影響Fig.5 Effect of extraction time on determination of hyperoside content in hyperoside in low-temperature dried tender leaves of A. leucorrhigus var. fulvescens Harms & Rehd
分別精密稱取糙葉藤五加烘干品粉末(40目)約0.5g,加入60%乙醇溶液50mL,分別回流60、75、90、105、120min,最后定容至50mL,用微孔濾膜(0.45μm)濾過,即得。考察結果見圖5,表明當回流105min時,樣品金絲桃苷提取率最大,故本實驗選擇提取時間為105min。
2.3 方法學考察
2.3.1 線性關系
按1.3.3節色譜條件,分別精密量取金絲桃苷對照品溶液1、2、4、6、10、15μL,注入液相色譜儀,測定峰面積。以進樣量/μg為橫坐標,峰面積為縱坐標繪制標準曲線,回歸方程為Y=2×106X -1.94883×106,R2=0.9990。金絲桃苷線性范圍為0.17~2.55mg。
2.3.2 精密度實驗
精密吸取對照品溶液10μL(n=6),測得峰面積的RSD為0.99%,結果表明儀器精密度良好。
2.3.3 穩定性實驗
精密量取樣品溶液10μL,分別于0、2、4、6、8、10h按1.3.3節色譜條件測定。按照金絲桃苷峰面積計算RSD為1.01%(n=6)。結果表明樣品溶液在配制后10h內穩定。
2.3.4 重現性實驗
取糙葉藤五加嫩葉低溫烘干品6份,按1.3.2節方法制備樣品溶液,按1.3.3節色譜條件測定。結果樣品中金絲桃苷的含量平均值為1.30%,RSD為1.12%(n=6),表明該分析方法重現性良好。
2.3.5 加樣回收率實驗
精密稱取已測定的樣品9份,每份1g,依次加入低、中、高3種質量濃度金絲桃苷對照品溶液,按1.3.2節方法制備樣品溶液,按1.3.3節色譜條件測定。結果平均回收率為100.31%,RSD為0.95%(n=9)。
2.4 樣品測定
按1.3.2節方法制備樣品溶液,按1.3.3節色譜條件測定,每次進樣10μL,測定結果見表2。
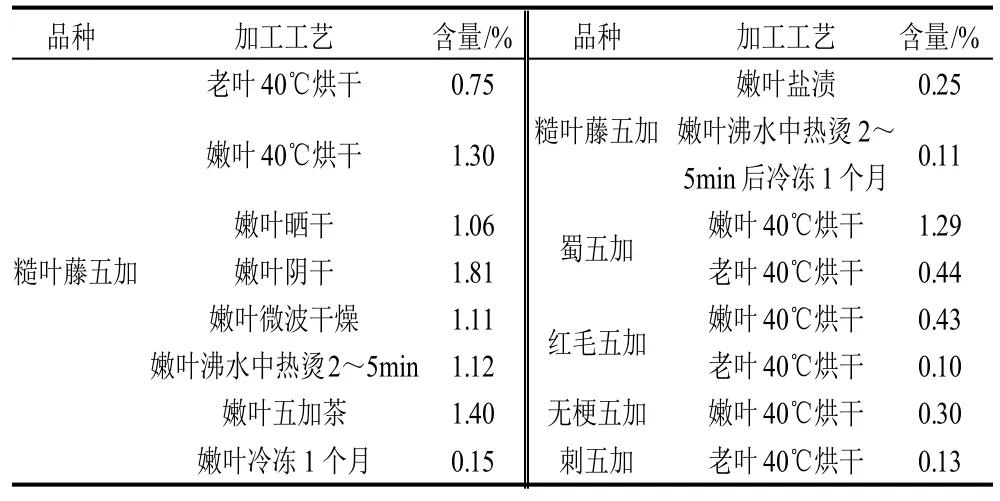
表2 各樣品的金絲桃苷含量Table 2 Hyperoside contents in different samples
3 結論與討論
3.1 根據本課題組前期的研究[16],金絲桃苷提取工藝為石油醚回流,再用一定體積分數的乙醇回流提取的方法;本實驗對所有嫩葉樣品進行了相同的提取工藝對比,發現石油醚回流對嫩葉中金絲桃苷含量影響不大,因此考察用不同乙醇體積分數的溶液進行、不同提取方法和不同的回流時間來提取樣品中金絲桃苷的含量,結果表明60%乙醇溶液回流提取105min對金絲桃苷的提取最完全。
3.2 實驗結果表明:五加屬的老葉含量甚低,與課題組前期發表的文獻[16]結果一致,而嫩葉中的含量很高。糙葉藤五加嫩葉(低溫烘干品)≈蜀五加嫩葉(低溫烘干品)>>紅毛五加嫩葉(低溫烘干品)>無梗五加嫩葉(低溫烘干品),提示四川阿壩藏族羌族自治州、四川甘孜藏族自治州實地考察發現的“五加菜”(尤其是糙葉藤五加)可以作為金絲桃苷的新來源,具有很好的開發前景。
3.3 不同加工方法對糙葉藤五加的金絲桃苷的含量的影響,從本次實驗結果表明:陰干>茶葉>烘干>熱燙≈微波干燥≈曬干>鹽漬>凍藏1個月;茶葉的金絲桃苷含量較高,但是川產五加屬類植物的茶類產品仍然是空白,因此具有很大的市場開發價值。
3.4 不同加工方法的探討
3.4.1 當地藏、羌族牧民一般將其直接炒食或煮湯或熱燙后涼拌食用或家用冰箱冷凍保藏一年食用。本實驗結果表明:熱燙后的藏羌五加菜金絲桃苷含量較高,提示該傳統食用方法具有科學性;藏羌五加茶葉金絲桃苷含量也較高,提示值得進一步開發;家用冰箱冷凍保藏一年慢慢食用,本實驗結果表明:藏羌五加菜直接凍藏1個月之后,其金絲桃苷含量很低;熱燙之后再采用家用冰箱冷凍儲貯含量更低,可能因為冷凍溫度加速了金絲桃苷的降解,因此從金絲桃苷含量的變化來看提示該食用方法不一定科學,但是藏羌五加菜中除含有金絲桃苷外還含有其他多種生物活性成分,因此具體結論還有待課題組的進一步系統綜合評價。
3.4.2 烘干、曬干、陰干均為食材干燥比較傳統的干燥方法,曬干和陰干受天氣影響較大,陰干雖然時間長,但是對保存“五加菜”中的金絲桃苷效果很好;微波干燥方法簡便、快捷,但會一定程度上降低五加菜的金絲桃苷含量。目前國內對金絲桃苷在植物體內的代謝研究較少,本工藝再次提示金絲桃苷在植物體內的代謝有可能與溫度有關,過高或者過低的溫度都影響了金絲桃苷的含量。
3.4.3 按照傳統的鹽漬工藝加工結果表明:金絲桃苷含量很低,提示一定程度上鹽漬工藝破壞了藏羌五加菜的金絲桃苷活性成分,但是有待課題組進一步的系統綜合評價。
[1] 樓之岑, 秦波. 常用中藥材品種整理和質量研究[M]. 北京: 北京醫科大學, 北京大學醫學出版社, 1995: 672-675.
[2] 張育松, 刺五加及刺五加茶的保健功效與加工工藝[J]. 亞熱帶農業研究, 2009, 5(1): 56-59.
[3] 劉玉平. 刺五加茶: 中國, A23F3/34; A61K35/78; A61P37/02[P]. 2001-10-24.
[4] 謝德圣, 謝春陽. 名貴山珍: 刺嫩芽罐頭的研制[J]. 特產研究, 1990 (3): 26-27; 50.
[5] 蔣忠良, 朱胄遠, 伍越環, 等. 金絲桃甙的合成研究[J]. 藥學學報, 1994, 29(11): 874-876.
[6] 李慶林, 桂新, 陳志武, 等. 金絲桃苷對大鼠心肌缺血再灌注損傷的保護作用[J]. 中國藥學雜志, 2002, 37(11): 829-832.
[7] 彭國平, 魏爾清, 葛求富, 等. 金絲桃苷對離體缺氧/缺糖再灌注腦損傷的保護作用[J]. 中國藥學雜志, 2005, 4(6): 434-437.
[8] YANG Yin. Studies on the effect of Hypercium Chinese on anti1ipidperoxidaton[J]. Acta Univ Med, 2001, 6(3): 211-215.
[9] MAREK O B, LYDIA I, HOLKOV A, et al. Anti1ipoxygenase activity of compounds from Hypericum perforatum[J]. Section Celluar Molecular Biology, 2006, 61(3): 331-332.
[10] WU Linlin, YANG Xinbo, HUANG Zhengming, et al. In vivo and in vitro antiviral activity of hypezoside extrated from Abelmoschus manihot (L.) medik[J]. Acta Pharmacol Sin, 2007, 28(1): 404-409.
[11] 袁麗春, 劉斌, 石任兵. HPLC法測定不同市售荷葉材料中金絲桃苷和異槲皮苷的含量[J]. 藥物分析雜志, 2010, 30(1): 41-44.
[12] 馮穎, 孟憲軍, 王建國. 無梗五加果金絲桃昔的分離制備和鑒定[J].食品科學, 2007, 28(5): 285-300.
[13] 劉圓, 孟慶艷, 彭鐮心, 等. 共有峰率和變異峰率雙指標序列法分析藏藥材紅毛五加特定(指紋)圖譜[J]. 藥物分析雜志, 2007, 27(8): 1182-1185.
[14] 劉圓, 孟慶艷, 任朝琴. RP-HPLC法測定川產藏藥不同產地紅毛五加莖皮中腺苷的含量[J]. 藥物分析雜志, 2007, 27(10): 1586-1588.
[15] 劉圓, 孟慶艷, 彭鐮心, 等. 川產藏藥材不同產地紅毛五加多糖的比較[J]. 中草藥, 2007, 38(2): 283-284.
[16] 李瑩, 袁瑋, 劉超, 等. 反相高效液相色譜法測定藏藥材紅毛五加中金絲桃苷的含量[J]. 時珍國醫國藥, 2009, 20(7): 1617-1619.
Determination of Hyperoside in Tibetan Acanthopanax Leaves from Five Species by RP-HPLC
LI Yan-dan,HUANG Yan-fei,DING Ling,ZUO Xu,LIU Yuan*
(Institute of Ethnic Medicine, Southwest University for Nationalities, Chengdu 610041, China)
Objective: To establish a reversed-phase high-performance liquid chromatography (RP-HPLC) method for the determination of hyperoside in Tibetan Acanthopanax leaves from 5 different species. Methods: Hyperoside was identified by liquid chromatography-mass spectrometry (LC-MS). Hyperoside in samples were extracted by refluxing with 60% ethanol for 105 min. The chromatographic separation was achieved on a Kromasil C18 column at 30 ℃ through gradient elution using methanol as mobile phase A and 0.5% phosphoric acid at a flow rate of 1 mL/min. The detection wavelength was set at 355 nm. Results: A calibration curve equation describing the relationship between hyperoside concentration (Y) and peak area (X) was established as follows: Y=2 × 106X + 1.94883 (r=0.990, n=6). The calibration curve was linear over the concentration range of 0.17-2.55. The average spike recovery rate of hyperoside was 100.31% with a RSD of 0.95% (n=9). Conclusion: A simple, accurate and repeatable method to determine hyperoside in Tibetan Acanthopanax leaves has been developed. Tender leaves of Tibetan Acanthopanax from the same species grown in Tibetan and Qiang Autonomous Prefecture and Ganzi Tibetan Autonomous Prefecture, Sichuan Province were found to be much richer in hyperoside than old ones. Low-temperature dried tender leaves of A. leucorrhizus (Oliv.) Harms var. fulvescens Harms & Rehd and A. setchuenensis Harms ex Diels had approximately equal hyperoside levels followed by tender leaves of A. giraldii Harms; tender leaves of A. sessiliforus Rupr had the lowest hyperoside level. Different drying methods were ranked in descending order from the highest to the lowest hyperoside content in dried A. leucorrhizus (Oliv.) Harms var. fulvescens Harms & Rehd as follows: shade drying > processing into tea > oven drying > blanching ≈ microwave drying ≈ sun drying >> salting >1-month frozen storage ≈ 1-month frozen storage after blanching.
Tibetan Acanthopanax;hyperoside;RP-HPLC;LC-MS;content
R284.2
A
1002-6630(2012)16-0106-05
2012-01-16
“十二五”國家科技支撐計劃重點項目(2012BAI27B07);四川省科技支撐計劃項目(2011SZ0233);四川省中醫藥管理局科技專項(2008-32)
李艷丹(1989—),女,碩士研究生,研究方向為民族藥物。E-mail:beanbean-li@hotmail.com
*通信作者:劉圓(1968—),女,教授,博士,研究方向為民族藥物。E-mail:yuanliu163@yahoo.com.cn

