銀鯧酶解物抗氧化活性研究
張敬敏,呂玲玲
(淮海工學院海洋學院,江蘇連云港 222005)
銀鯧酶解物抗氧化活性研究
張敬敏,呂玲玲
(淮海工學院海洋學院,江蘇連云港 222005)
選用胃蛋白酶、胰蛋白酶、堿性蛋白酶和中性蛋白酶對銀鯧蛋白進行酶解以制備蛋白酶解物,以羥基自由基清除活性為指標確定銀鯧最佳水解酶。結果顯示,堿性蛋白酶的水解物抗氧化活性最強。實驗對堿性蛋白酶水解銀鯧的酶解條件(時間、溫度、pH、酶添加量和固液比)進行正交實驗設計,并對最佳水解條件下所獲得的酶解物進行抗氧化活性測試。結果表明,銀鯧蛋白堿性蛋白酶水解物對DPPH自由基和羥基自由基具有清除作用,其自由基清除效果呈現劑量依賴性,而且銀鯧蛋白水解物還具有明顯還原能力。所有這些體外抗氧化數據說明,銀鯧蛋白水解物有明顯的抗氧化效力。
抗氧化,銀鯧,酶解,肽,酶解物
海洋生物長期處于海水這樣一個特異的封閉環境里,在進化過程中產生了與陸地生物不同的代謝系統和機體防御系統,因此海洋生物中蘊藏著許多功能特異、結構特殊的生理活性物質。向海洋索取食物、功能蛋白和特殊活性物質,已成為世界各沿海國家海洋開發的一項重要內容,這其中海洋活性肽的開發研究備受科研工作者的關注。銀鯧屬于鱸形目,鯧科,主要分布在印度西太平洋區域、中國東部與西部和西南部朝鮮半島。銀鯧占鯧魚總量的84%,并在中國、科威特、伊朗、日本等國家的漁業中起著重要的作用[1]。國際市場上,銀鯧被公認為一種經濟價值極高海洋可食魚種。銀鯧肉厚、刺少、味佳,營養豐富,每100g銀鯧魚肉含蛋白質15.6g、脂肪6.6g、碳水化合物0.2g、鈣19mg、磷240mg、鐵0.3mg。銀鯧脂肪多為不飽和脂肪酸ω-3系列,其膽固醇含量也低于所有的動物性食品。實驗對銀鯧魚肉蛋白酶解物的抗氧化活性進行研究,以期拓寬抗氧化活性肽的獲取資源。
1 材料與方法
1.1 材料與儀器
銀鯧 購于當地超市,去皮,剔除骨,-18℃凍藏備用;胰蛋白酶、胃蛋白酶、堿性蛋白酶、中性蛋白酶 無錫市雪梅酶制劑科技有限公司,生物級;DPPH(1,1-di1phenyl-2-picryl-hydrazyl) Sigma公司,色譜純;其它試劑 均為分析純。
YP-001N電子精密天平、pHS-25數顯pH計 上海精密科學儀器有限公司;722S型分光光度計 上海樓光技術有限公司;HZS-H水浴振蕩器 哈爾濱市東明醫療儀器制造廠;GL-21M高速冷凍離心機 長沙湘儀離心機儀器有限公司;DS-1型高速組織搗碎機 上海標本模型廠。
1.2 實驗方法
1.2.1 酶解工藝流程 銀鯧→解凍→勻漿→加熱、調pH→加酶→保溫水解4h→滅酶(90℃,20min)→破乳化→離心(8000r/min,20min)→上清液
1.2.2 最佳水解酶的篩選 選用胃蛋白酶、胰蛋白酶、堿性蛋白酶、中性蛋白酶在適宜酶解條件下對銀鯧魚肉進行酶解,并測定所得酶解液的氨基態氮含量和自由基清除活性。酶解條件如表1所示。
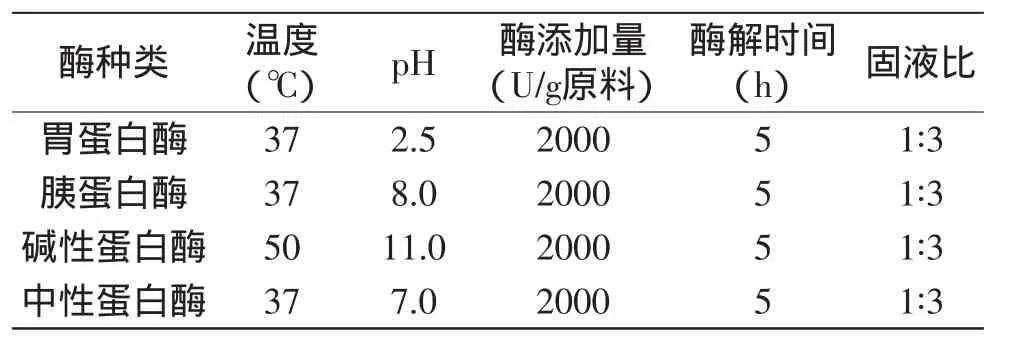
表1 各種蛋白酶酶解參數Table 1 The hydrolysis parameter of several protease
1.2.3 正交實驗 根據最佳水解酶的篩選結果,確定堿性蛋白酶為銀鯧蛋白最佳水解酶。以羥基自由基清除率為指標,選取時間、溫度、加酶量和固液比四因素,采用L9(34)正交實驗對銀鯧酶解條件進行優化設計,因素水平見表2。
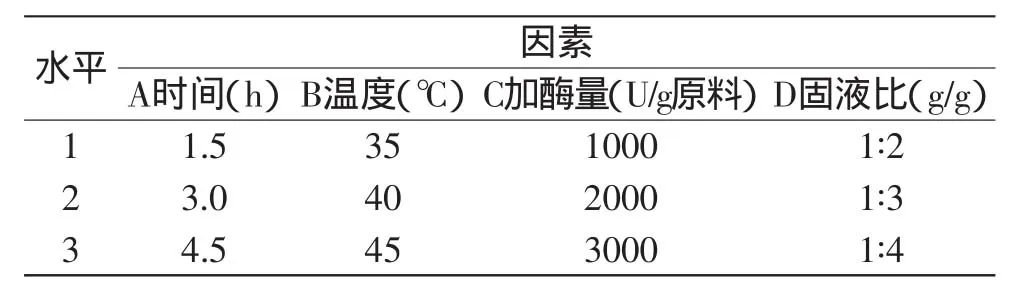
表2 因素水平表Table 2 Level values of each factor
1.2.4 分析方法
1.2.4.1 水解度測定 甲醛滴定法。
1.2.4.2 DPPH自由基(DPPH·)清除活性的測定[2]DPPH自由基清除活性的測定按Bersuder法并稍加改動。將2mL DPPH自由基溶液(0.1mmol/L,溶于95%乙醇)置于試管中,加入一定量待測液,定容至4mL,振蕩混勻。混合液室溫放置30min后,在517nm處測吸光值Ai。對照為2mL DPPH自由基溶液加上2mL蒸餾水,并在517nm處測吸光值Ac。同體積待測液與2mL 95%的乙醇定容至4mL,并在517nm處測吸光值為Aj。DPPH自由基(DPPH·)清除活性用清除率SA(Scavenging activity)表示:
SA(%)=[1-(Ai-Aj)/Ac]×100%
1.2.4.3 羥基自由基(·OH)清除活性的測定[3]取0.2mL FeSO4-EDTA混合液(10.0mmol/L)于5mL刻度試管中,并加入0.5mL的2-脫氧核糖溶液(10.0mmol/L),再加入0.6mL酶解物,用磷酸緩沖液(0.lmol/L,pH7.4)定容至1.8mL,空白及陽性對照管直接用磷酸緩沖液定容至1.8mL。再在樣品及陽性對照管中加入0.2mLH2O2(0.1%),空白管加入蒸餾水0.2mL。溶液混勻后置于37℃恒溫水浴中反應lh,然后加入質量分數為2.8%三氯乙酸(TCA)溶液1.0mL,4000r/min離心20min。取上清液2.0mL于另一支試管中,加入1.0%(w/w)硫代巴比妥酸(TBA)溶液1.0mL,混勻后置沸水浴中反應15min,冷卻后稀釋5倍,在波長532nm處測吸光度值。羥自由基清除活性用清除率SA表示,按下式計算:
SA(%)=[(Ac-As)/(Ac-A0)]×100%
式中:Ac為陽性對照管的吸光度;As為樣品管的吸光度;A0為試劑空白的吸光度。
1.2.4.4 酶解液還原能力的測定[2]取一定濃度的樣品(1~10mg/mL)0.1mL,加入2.5mL pH6.6的磷酸鹽緩沖液(0.2mol/L)和2.5mL 1%的鐵氰化鉀溶液,混勻。將混合物在50℃保溫30min后加入2.5mL 10%的三氯乙酸,混合后以3000r/min離心10min。然后,取上清液2.5mL,加2.5mL蒸餾水和0.5mL 0.1%的FeCl3,室溫放置10min后,在700nm波長處比色,比色值越大,還原能力越強。
2 結果與分析
2.1 最佳水解酶的篩選
不同蛋白酶有著不同的特異酶切位點,因而蛋白酶的選擇是生物活性肽制備過程中一個重要環節。同一種底物蛋白用不同的蛋白酶酶解時,所得到的酶解產物活性可能完全不同[4]。因此,有必要對銀鯧蛋白的最適作用酶系進行篩選。本實驗選取四種蛋白酶(即堿性蛋白酶、中性蛋白酶、胰蛋白酶和胃蛋白酶)作為水解銀鯧蛋白的酶源。
四種蛋白酶分別酶解銀鯧蛋白的水解度結果如圖1所示。由圖1可知,堿性蛋白酶酶解產物的水解度最高(23.4%),而酶解效果最差的是胃蛋白酶,其酶解產物水解度為5.4%。

圖1 不同蛋白酶水解物的水解度曲線Fig.1 Hydrolysis curves of Silver pomfret protein treated with various enzyme preparations
由圖2可知,四種酶解物清除羥基自由基能力的順序為:堿性蛋白酶>中性蛋白酶>胰蛋白酶>胃蛋白酶。四種酶解產物清除羥基自由基的能力強弱與其水解度的高低順序(見圖1)基本一致。其原因據有關學者的研究認為[4-5],水解度的大小指示蛋白分子在酶作用下所斷裂肽鍵數的多少,水解度高意味著生成較多的小分子活性物質(小分子肽或氨基酸);某種程度上可以說水解度與酶解產物抗氧化活性間有一定的相關性。
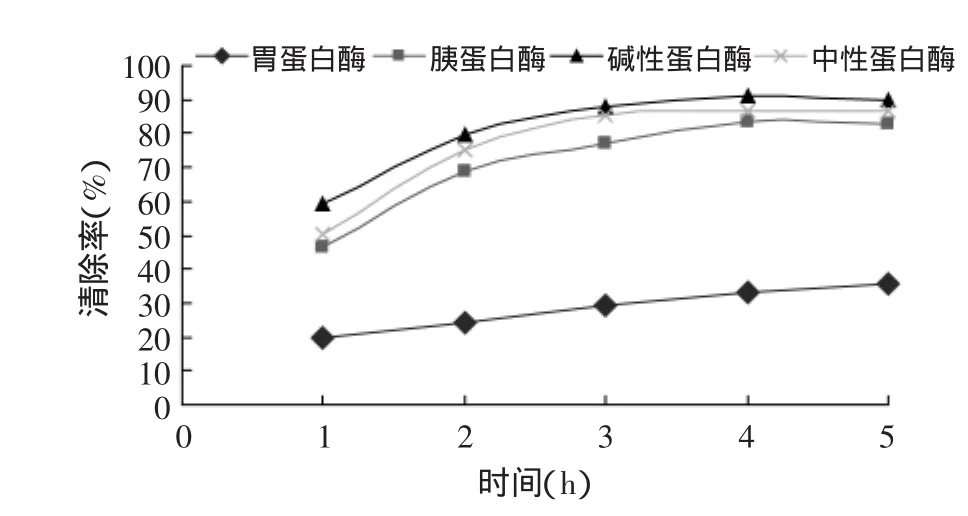
圖2 不同蛋白酶水解物清除羥基自由基的活性Fig.2 Hydroxyl radical-scavenging activity of Silver pomfret protein hydrolysates with various enzyme preparations
2.2 正交實驗
根據以上實驗結果確定堿性蛋白酶為銀鯧蛋白最佳水解酶。以羥基自由基清除率為指標,選取時間、溫度、加酶量和固液比四因素,采用L9(34)正交實驗對銀鯧酶解條件進行優化設計。

表3 酶解最佳工藝條件的正交實驗結果Table 3 Results of the orthogonal trial on optimal parameter of hydrolysis
由表3可知,時間、酶濃度、溫度、固液比四因素對銀鯧酶解產物清除羥基自由基影響效果各不相同,其中時間>酶添加量>溫度>固液比。同時可以得出堿性蛋白酶最佳酶解條件為:時間3h、溫度45℃、酶添加量3000U/g原料、固液比1∶3。
2.3 銀鯧酶解物抗氧化能力
按2.2節正交實驗最佳酶解條件:時間3h、溫度45℃、酶添加量3000U/g原料、固液比1∶3,對銀鯧蛋白進行酶解,酶解液經離心后取上清液冷凍干燥成粉后,測酶解物抗氧化能力。
2.3.1 酶解物抑制DPPH自由基(DPPH·)的能力 堿性蛋白酶水解銀鯧所獲得的酶解物清除DPPH自由基(DPPH·)的活性見圖3。由圖3可知,在較低濃度下(≤8mg/mL),酶解物的清除效率與其濃度接近線性比例關系;當酶解物濃度超過8mg/mL,其清除效率增長極其緩慢。
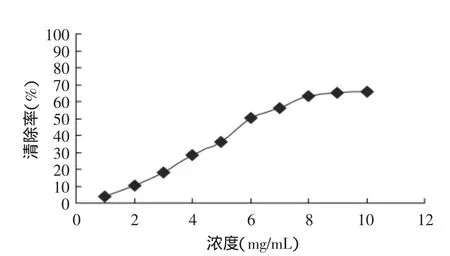
圖3 銀鯧酶解物清除DPPH自由基的活性Fig.3 DPPH radical-scavenging activity of Silver pomfret protein hydrolysates
2.3.2 酶解物清除羥基自由基的能力 羥基自由基(·OH)是一種極強的氧化劑,它一旦產生,就立刻氧化與它緊鄰的任何生物分子,例如核酸、蛋白質、糖以及細胞中的其他成分[6]。Fenton反應是常見的產生·OH的手段,它以過氧化氫為氧化劑,以亞鐵鹽為催化劑,鏈反應的中間過程產生極活潑、極具氧化能力的羥自由基:Fe2++H2O2→Fe3++·OH+OH-。其中產生的·OH可通過氫抽提,單電子轉移或加成等方式攻擊、氧化其他物質。用Fenton反應產生·OH來攻擊脫氧核糖、紅細胞或其它成分可檢測抗氧化劑清除·OH的能力[2,8]。如圖4所示,銀鯧酶解物具有很強的清除羥基自由基的能力,且在一定濃度范圍內清除效率表現出明顯的劑量相關性。當濃度達到5mg/mL,其清除效率高達91.5%。此時若繼續加大濃度時,清除效率略呈下降趨勢。這可能是因為酶解物的抗氧化能力已達到頂峰,多余的酶解物對抗氧化效果不但無濟于事,
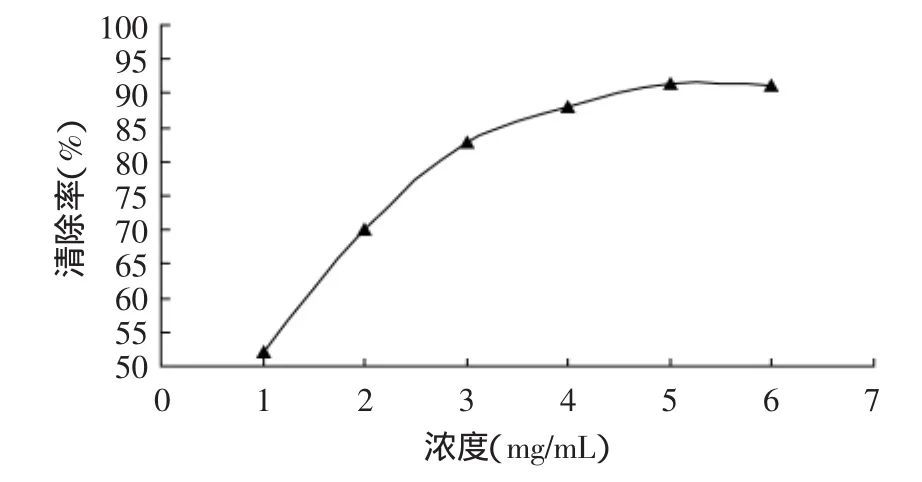
圖4 銀鯧酶解物清除羥基自由基的活性Fig.4 Hydroxyl radical-scavenging activity of Silver pomfret protein hydrolysates
反而由于反應液顏色的加深影響到吸光值的測定,
進而影響到抗氧化效率的測定結果。
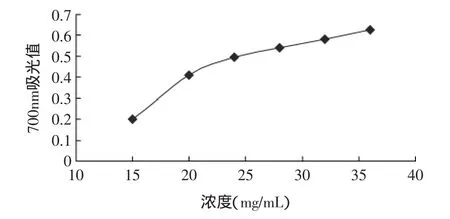
圖5 銀鯧酶解物還原能力Fig.5 Reducing power activity of Silver pomfret protein hydrolysates
2.3.3 酶解物還原能力 一般情況下,還原能力與抗氧化能力呈正相關,實驗參考Oyaizu的方法進行還原能力測定。酶解物將赤血鹽[K3Fe(CN)6]還原成黃血鹽[K4Fe(CN)6],黃血鹽再與Fe3+作用,生成普魯士藍,該物質在700nm處測定吸光值。實驗通過檢測普魯士藍的生成量,確定試樣的還原力。吸光值愈高,表示試樣還原力愈強。
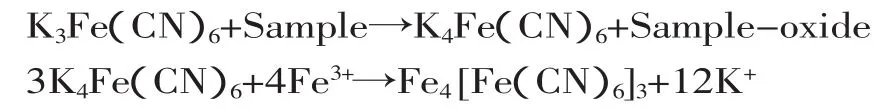
圖5顯示,銀鯧酶解物具有一定的還原力,銀鯧魚酶解物可做為電子供體與自由基進行反應并將它們轉化為穩定物質,從而終止自由基鏈反應。
3 結論
本研究表明,鯧魚肉酶解產物對自由基的清除效果不同,且還原能力也不同。其中對羥基自由基的清除能力相對較強,而對超氧陰離子的清除能力相對較弱。結果可能預示活性肽清除不同自由基的機制具有一定的差別,這與曹文紅等人[7-8]的研究結果較為一致。下一步應對鯧魚肉蛋白酶酶解產物進行分離純化及各種抗氧化肽的鑒定。
[1]PENG Shiming,SHI Zhaohong,HOU Junli,et al.Genetic diversity of silver pomfret(Pampus argenteus) populations from the China Sea based on mitochondrial DNA control region sequences[J].Biochemical Systematics and Ecology,2009,25:1-7.
[2]李琳.鳙魚蛋白控制酶解及酶解物抗氧化研究 [D].廣州:華南理工大學,2006.
[3]REN Jiaoyan,ZHAO Mouming.Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chemistry,2008,108(2):727-736.
[4]任嬌艷.草魚蛋白源抗疲勞生物活性肽的制備分離及鑒定技術研究[D].華南理工大學,2008.
[5]Li B,Chen F,Wang X,et al.Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chemistry,2007,102:1135-1143.
[6]鄭榮梁,黃中洋.自由基生物學[M].北京:高等教育出版社,2007:18-19.
[7]曹文紅,吳紅棉,范秀萍,等.馬氏珠母貝酶解產物清除自由基活性的研究[J].食品研究與開發,2009,30(1):13-17.
[8]Eresha Mendis,Niranjan Rajapakse,et al.Investigation of jumbo squid(Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J].Life Sciences,2005,77(17):2166-2178.
Antioxidant activity of Silver pomfret protein hydrolysates
ZHANG Jing-min,LV Ling-ling
(Ocean Institute,Huaihai Institute of Technology,Lianyungang 222005,China)
Silver pomfret protein hydrolysates were prepared using commercial enzymes,namely pepsin,trypsin Alcalase,and neutral protease.The hydrolysates so prepared were effective as antioxidants in model systems,mainly by scavenging of hydroxyl free radicals.The hydrolysate prepared using Alcalase showed the highest antioxidant activity among all samples.Hydrolysis conditions(temperature,pH,enzyme to substrate level and solid/liquid ratio)for preparing protein hydrolysates with Alcalase from the Silver pomfret proteins were optimized by orthogonal design.the hydrolysates were assessed using methods of DPPH radical scavenging ability.In the best hydrolysis conditions,The antioxidant and free radical-scavenging activities of Silver pomfret protein hydrolysates prepared with alcalase were investigated by employing several in vitro assay systems,including the1,1-diphenyl-2-picrylhydrazyl(DPPH),hydroxylradical-scavenging,andreducingpower.Silverpomfretprotein hydrolysates showed scavenging activity against free radicals such as DPPH·and hydroxyl radicals.The radical-scavenging effect was in a dose-dependent manner.Moreover,Silver pomfret protein hydrolysates also exhibited notable reducing power.The data obtained by the in vitro systems obviously established the antioxidant potency of Silver pomfret protein hydrolysates.
antioxidant;Silver pomfret;hydrolysate;peptide;enzymatic hydrolysis
TS254.1
A
1002-0306(2012)01-0112-04
2010-03-30
張敬敏(1972-),女,碩士研究生,講師,研究方向:食品資源開發與利用。

