復方益母片微生物限度檢查方法的驗證
天津市南開醫院(300100)馬順英
復方益母片是由益母草、雞血藤、當歸等4味中藥組成的中藥制劑,具有補血,活血的功效。根據《中國藥典》2010年版的規定,藥品在進行微生物限度檢查前必須對其檢查方法進行驗證,以確認該供試品所采用的檢查方法無抑菌作用后再進行檢查,才能真實反映該藥品受污染的程度[1]。結果證實復方益母片的細菌,霉菌,酵母菌和控制菌檢查均采用常規法進行。
1 儀器與試藥
1.1儀器 LIBRORAEG120電子天平(日本島津);YJA電動勻漿儀(臺州市椒江五星機械儀器有限公司);MJX-1501培養箱(廣東省醫療器械廠)。
1.2試藥與培養基 營養瓊脂培養基(批號120206),玫瑰紅鈉瓊脂培養基(批號110211),膽鹽乳糖培養基(批號110410),營養肉湯培養基(批號120111),pH7.0 的無菌氫氧化鈉-蛋白胨緩沖液(批號1102222),改良馬丁培養基(批號080408),均為中國藥品生物制品檢定所提供;復方益母片(批號20120706)。
1.3菌種 大腸埃希菌[CMCC(B)44102],金黃色葡萄球菌[CMCC(B)26003],枯草芽孢桿菌[CMCC(B)63501];白色念珠菌[CMCC(F)98001];黑曲霉[CMCC(F)98003],均由中國藥品生物制品檢定所提供。
2 方法與結果
2.1菌液制備 取大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌的新鮮培養物接種至營養肉湯培養基中,30℃~35℃,培養18~24小時;取白色念珠菌的新鮮培養物接種至改良馬丁培養基中,25℃培養18小時。上述培養物用0.9%無菌氯化鈉溶液制成每1mL含菌數約為50~100cfu的菌懸液。取黑曲霉的新鮮培養物接種至改良馬丁瓊脂斜面培養基中,培養5~7天后,加入4mL 0.9%無菌氯化鈉溶液,將孢子洗脫,然后用管口帶有薄的無菌棉花吸出孢子懸液至無菌試管內,用0.9%無菌氯化鈉溶液制成每1mL含孢子數約為50~100cfu的孢子懸液。
2.2供試液的制備 取本品10g,加pH7.0的氯化鈉-蛋白胨緩沖液至100mL,用勻漿儀,混勻,作為1∶10的供試液。
2.3方法驗證
2.3.1細菌、霉菌和酵母菌計數的驗證
2.3.1.1細菌計數的驗證
2.3.1.1.1試驗組 ①常規法:取2.2項下制備的供試液1mL和1mL試驗菌(約50~100cfu)分別注入平皿中,立即傾注瓊脂培養基,待凝,每株試驗菌平行制備2個平皿。在30℃~35℃培養箱中培養48小時,點計菌落數,取均值。
2.3.1.1.2菌液組 取1mL試驗菌(約50~100cfu),分別注入平皿中,立即傾注瓊脂培養基,按平皿法測定所加的試驗菌數(分別為大腸埃希菌、金黃色葡萄球菌和枯草芽孢桿菌)。
2.3.1.1.3供試品 對照組按試驗組的方法,不加菌懸液,按菌落計數方法測定供試品菌數(本底菌)。
2.3.1.1.4稀釋劑 對照組取與供試液等量的稀釋劑和菌懸液1mL注入1個平皿中,培養基注皿,培養,計數。
2.3.1.2霉菌和酵母菌計數的驗證
2.3.1.2.1試驗組 ①常規法:取2.2項下制備的供試液1mL和1mL試驗菌(約50~100cfu)分別注入平皿中,立即傾注瓊脂培養基,待凝,每株試驗菌平行制備2個平皿。在23℃~28℃培養箱中培養72小時,點計菌落數,取均值。
2.3.1.2.2菌液組 取1mL試驗菌(約50~100cfu),分別注入平皿中,立即傾注瓊脂培養基,按平皿法測定所加的試驗菌數(分別為白色念珠菌和黑曲霉菌)。
2.3.1.2.3供試品 對照組按試驗組的方法,不加菌懸液,按菌落計數方法測定供試品菌數(本底菌)。
2.3.1.2.4稀釋劑 對照組取與供試液等量的稀釋劑和菌懸液1mL注入1個平皿中,培養基注皿,培養,計數。
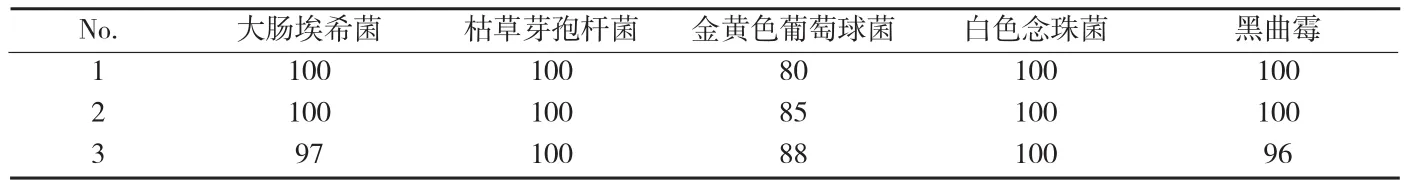
附表1 常規法測定各試驗菌株的回收率(%)

附表2 控制菌驗證結果
試驗組菌回收率=(試驗組菌落數-供試品對照組菌落數)/試驗組菌落數×100%;稀釋劑對照組回收率=稀釋劑對照組菌落數/試驗組菌落數×100%。
《中國藥典》規定對各試驗菌株的回收率均不得低于70%,用常規法測定該品種對5個試驗菌株的回收率,以確定其抑菌程度。結果見附表1。
由附表1可知本品對大腸埃希菌、白色念珠菌、黑曲霉、枯草芽孢桿菌和金黃色葡萄球菌均無抑菌作用。
2.3.2控制菌檢查法的驗證 結果見附表2。
2.3.2.1大腸埃希菌檢查法的驗證
2.3.2.1.1試驗組 取10mL 2.2項下制備的供試液和1mL大腸埃希菌(約50~100cfu)加入100mL的膽鹽乳糖培養基中,培養18~24小時。
2.3.2.1.2陰性菌對照組 取10mL 2.2項下制備的供試液和1 mL金黃色葡萄球菌(約50~100cfu)加入100mL的膽鹽乳糖培養基中,培養18~24小時。
2.3.2.1.3陽性對照組 取1mL 大腸埃希菌(約50~100mL)加入100mL的膽鹽乳糖培養基中,培養18~24小時。
取試驗組、陰性菌對照組和陽性對照組上述培養物各0.2mL,分別接種至含5mL MUG培養基的試管內,培養,于5、24小時在366nm紫外光下觀察,試驗組管MUG陽性,靛基質陽性;陰性菌對照組MUG陰性,靛基質陰性;陽性對照組管MUG陽性,靛基質陽性。
2.3.2.1.4實驗結果 陽性對照組檢出大腸埃希菌;陰性菌對照組未檢出大腸埃希菌;試驗組檢出大腸埃希菌。驗證結果符合要求。
2.3.2.2大腸菌群檢查法的驗證
2.3.2.2.1試驗組 取1mL 2.2項下制備的供試液和1mL大腸埃希菌(約50~100cfu)加入到10mL的膽鹽乳糖發酵培養基中,培養18~24小時。
2.3.2.2.2陰性菌對照組 取1mL 2.2項下制備的供試液和1mL金黃色葡萄球菌(約50~100cfu)加入到10mL的膽鹽乳糖發酵培養基中,培養18~24小時。
2.3.2.2.3陽性對照菌 取1mL 2.2項下制備的供試液和1mL大腸埃希菌(約50~100cfu)加入到10mL的膽鹽乳糖發酵培養基中,培養18~24小時。
試驗組管和陽性對照組管均有菌生長且產酸產氣,陰性菌對照組無菌生長且不產酸產氣。實驗結果:試驗組檢出大腸菌群;陰性菌未檢出大腸菌群;陽性對照組檢出大腸菌群。結果符合要求。
2.3.2.3供試品控制菌檢查 取10mL 2.2項下制備的供試液置100mL的膽鹽乳糖培養基中,依法檢查,結果樣品每1g中未檢出大腸埃希菌。
2.3.2.4本品為口服給藥制劑,致病菌應作大腸埃希菌,其陰性對照采用金黃色葡萄球菌。
由附表2得出結論:試驗組檢出試驗菌,陰性菌對照組未檢出陰性對照菌。
2.4結果 復方益母片微生物限度檢查方法試驗結果為細菌、霉菌和酵母菌計數采用平皿法;控制菌采用常規法。
3 討論
中藥制劑的微生物限度檢查通常是按常規的藥品衛生學檢驗方法進行細菌、霉菌和酵母菌計數的。由于中成藥是含有多種成分的復方制劑,其中任何具有抑菌作用的成分均可影響微生物限度檢查的準確性[2]。因此,本實驗以5種陽性對照菌的回收率作為評價指標,確定了復方益母片的微生物限度檢查方法。
該方法可用于復方益母片微生物的質量控制。

