RNA干擾COPS3表達對肺癌細胞增殖影響的分析
孔慶彧,崔久嵬,于得海,李 薇,王雪梅,2,王冠軍*
(1.吉林大學第一醫院腫瘤中心,吉林 長春130021;2.吉林省人民醫院 血液科)
肺癌為死亡率最高的惡性腫瘤之一,在全世界范圍內死亡率仍呈逐年上升趨勢。近年來隨著對腫瘤發生研究的不斷深入,人們發現并證實腫瘤發生與轉移根本原因在于相關基因的異常表達,尤其是調控細胞生長與分化的癌基因的激活或抑癌基因的失活更成為腫瘤發生機制研究的熱點[1]。COPS3(constitutive photomorphogenic homolog subunit 3 of COP9)是新近發現的一種與腫瘤發生及轉移密切相關的基因,是腫瘤治療的潛在靶點。RNA干擾(RNA interference,RNAi)是一種高效、特異地降解靶基因mRNA的實驗技術,目前已廣泛應用于基因功能領域的研究[2,3]。
本研究通過建立COPS3慢病毒RNAi載體,觀察干擾COPS3基因表達后,肺癌細胞A549增殖、周期分布及細胞凋亡情況,以探討其在肺癌發展中的作用。
1 材料與方法
1.1 主要材料
人肺腺癌細胞株A549、人胚胎腎上皮細胞株293T(ATCC);表達載體 pFH1UGW-GFP(上海Hollybio公司);慢病毒載體及輔助載體(上海吉凱基因 技 術 公 司);M-MLV 反 轉 錄試劑 盒 (Promega);ECL試劑(Amersham);COPS3兔抗小鼠單克隆抗體、β-actin兔抗小鼠多克隆抗體、HRP標記山羊抗小鼠抗抗體(Snata Cruz)。
1.2 COPS3基因的RNA干擾
1.2.1 RNAi慢病毒載體構建 針對COPS3基因mRNA序列,通過“Target Finder Tool”軟件(Gen-Scrip)設計干擾序列及對照序列(表1)。單鏈DNA退火后產生雙鏈DNA oligo,再與雙酶切后的慢病毒干擾載體連接,進而轉化感受態DH5α,挑單克隆進行PCR鑒定;對陽性菌落進行測序。
1.2.2 慢病毒包裝及感染細胞 293T細胞生長至對數生長期時開始轉染,參照Lipofectamine 2000說明書,在6孔板中加入si-COPS3或si-CTRL 2 μg、pCMV載體1.5μg、pVSVG載體1μg。轉染后8h更換正常培養基,繼續培養48h,在此期間觀察轉染效率。最后收集上清液,進行過濾、濃縮并測定病毒滴度。
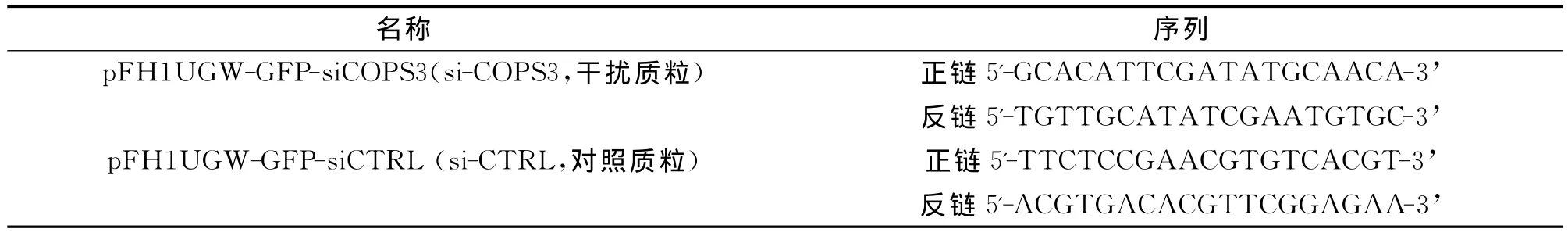
表1 COPS3基因干擾序列
以5×104細胞/孔將A549細胞接種于96孔板,以含有適量病毒的DMEM培養基培養24h,更換新鮮培養基繼續培養72h,在熒光顯微鏡下觀察綠色熒光蛋白表達情況。
1.2.3 慢病毒感染后COPS3基因沉默分析 收集慢病毒感染5d的A549細胞,分別應用real-time PCR及Western blot法分析檢測慢病毒感染A549細胞后COPS3mRNA及蛋白表達水平。
1.3 BrdU法檢測細胞增殖
收集慢病毒感染5d的A549細胞,按5×103細胞/孔接種于96孔板,檢測時間設為接種后24h和72h。調整每孔BrdU終濃度為25μmol/l,繼續培養8h,固定細胞并用核酸酶室溫消化30min后加入BrdU單克隆抗體(1∶200稀釋)與辣根過氧化物酶標記的山羊抗鼠二抗,室溫孵育1.5h,然后加入TMB顯色底物,暗處孵育30min后終止反應。酶標儀讀取490nm處OD值。
1.4 細胞周期分析
收集慢病毒感染細胞以1×106個細胞/孔接種于6孔板,培養24h后收集細胞并固定,加入配制的PI溶液(100μg/ml PI,10μg/ml RNase A)染色30min。應用流式細胞儀進行細胞周期分析。
1.5 細胞凋亡檢測
取慢病毒感染細胞以5×105個細胞/孔接種于6孔板,培養5d,消化并收集細胞,分別加入100μl結合緩沖液、5μl Annexin V 溶液及5μl PI,于暗處室溫孵育5min。取1×106個細胞,應用流式細胞儀進行細胞凋亡分析。
1.6 統計數據處理
所有數據均以平均值ˉx±SD表示,每組實驗重復三次。數據采用SPSS16.0軟件進行pairedt檢驗,P≤0.05認為具有統計學意義。
2 結果
2.1 慢病毒感染A549細胞
將慢病毒感染A549細胞96h后,在倒置熒光顯微鏡下觀察GFP表達情況,可見明顯綠色熒光,證明病毒表達質粒已成功轉入細胞中,感染效率可達50%以上(圖1)。
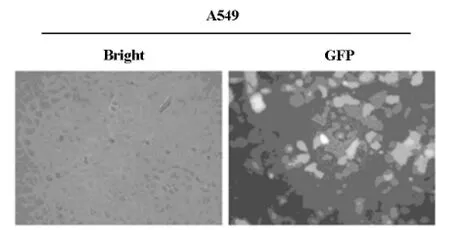
圖1 慢病毒感染A549細胞96h后GFP表達情況(×200)
2.2 RNAi COPS3基因沉默效果驗證
與對照組相比,轉染si-COPS3的A549細胞COPS3mRNA及蛋白質表達水平均顯著下降(圖2,3)。
2.3 干擾COPS3表達對A549細胞增殖的影響
BrdU細胞增殖實驗結果表明,與對照組相比,si-COPS3轉染A549細胞72h后細胞增殖顯著受抑(圖4)。
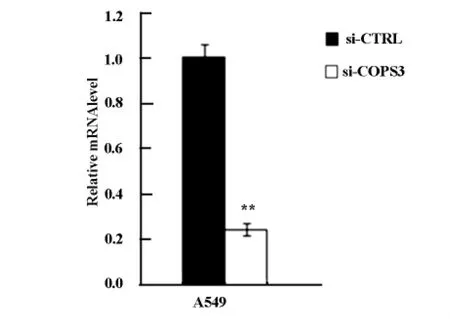
圖2 Real-time PCR分析轉染干擾質粒后A549細胞COPS3mRNA表達情況
圖3 Western blot分析轉染干擾質粒后A549細胞COPS3蛋白質表達水平

圖4 BrdU法分析干擾COPS3基因表達后A549細胞增殖情況
2.4 COPS3基因沉默對A549細胞周期的影響
流式細胞儀檢測細胞周期結果表明,與對照組不同,COPS3基因沉默后細胞周期大多停滯于G0/G1期(圖5A、B)。
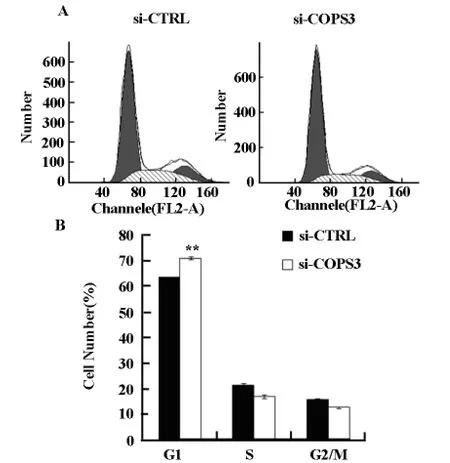
圖5 流式細胞術分析干擾COPS3基因后A549細胞周期情況(A)及其定量分析(B)
2.5 COPS3基因沉默對A549細胞凋亡的影響
流式細胞術分析經 Annexin V-PI雙染后的A549細胞凋亡情況,結果顯示,實驗組凋亡細胞比例均顯著高于對照組(圖6A、B)。
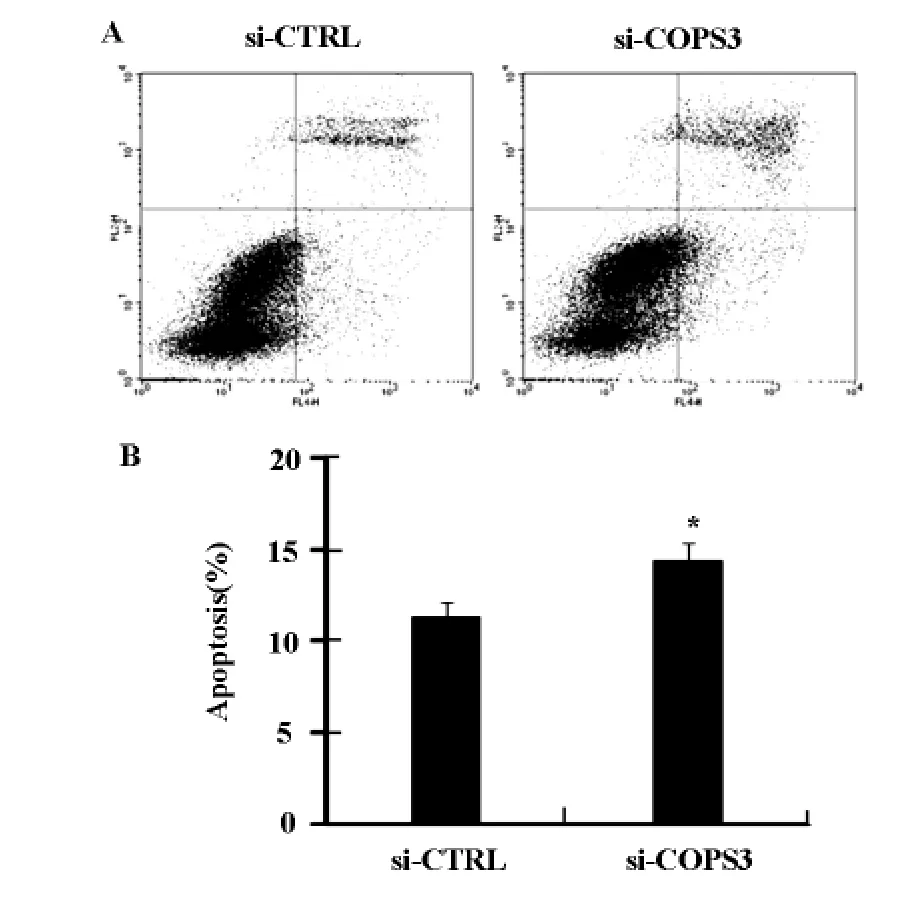
圖6 流式細胞術分析干擾COPS3基因后A549細胞凋亡情況
3 討論
近年來,腫瘤治療分子靶點的探索及相應藥物研發成為抗腫瘤新藥研發的前沿和熱點[3]。
COPS3基因是高度保守COP9信號傳導通路中的一部分,位于人染色體17p11.2。該基因能調控細胞內諸多生物學過程,包括細胞周期、細胞增殖、細胞凋亡和轉移等[4,5]。Dartel等[5]通過 DNA微陣列法亦發現COPS3基因在多種腫瘤中呈現高表達;Yan等[6]研究發現該基因在高度惡性骨肉瘤組織中高表達,而當COPS3過表達后抑制p53基因,可促進腫瘤細胞生長,敲除COPS3基因后,可抑制骨肉瘤細胞增殖。
慢病毒載體具有十分廣泛的宿主范圍,分裂期及非分裂細胞均能感染,并且能夠將較大的外源基因片段有效地整合至宿主基因組中,是目前較為理想的基因轉移載體之一[7]。本實驗以慢病毒為載體,成功建立了COPS3的干擾體系,并將其導入肺癌細胞。發現通過干擾COPS3基因表達,肺癌細胞增殖能力受到明顯抑制,并可以導致細胞周期阻滯于G0/G1期,誘導細胞凋亡,提示COPS在肺癌發生發展中可能起到重要的作用。
本研究為進一步深入探討COPS3基因沉默后在肺癌發生與發展過程中的機制奠定了實驗基礎。
[1]Skrzypski M,Dziadziuszko R,Jassem J.MicroRNA in lung cancer diagnostics and treatment[J].Mutat Res,2011,717(1):25.
[2]Halimi Y,Dessau M,Pollak S,et al.COP9signalosome subunit 7 from Arabidopsis interacts with and regulates the small subunit of ribonucleotide reductase(RNR2)[J].Plant Mol Biol.,2011,77(1-2):77.
[3]Emanuele MJ,Creighton CJ,Schlabach MR,et al.A genome-wide RNAi screen identifies multiple synthetic lethal interactions with the Ras oncogene[J].Cell,2009,137(5):835.
[4]Fuchs B,Pritchard DJ.Etiology of osteosarcoma[J].Clin Orthop Relat Res,2002,397(4):40.
[5]van Dartel M,Cornelissen PW,Redeker S,et al.Amplification of 17p11.2approximately p12,including PMP22,TOP3A,and MAPK7,in high-grade osteosarcoma[J].Cancer Genet Cytogenet,2002,139(2):91.
[6]Yan T,Tang G,Ren T,et al.RNAi-mediated COPS3gene silencing inhibits metastasis of osteogenic sarcoma cells[J].Cancer Gene Ther.2011,18(6):450.
[7]Cockrell AS,Kafri T.Gene delivery by lentivirus vectors[J].Mol Biotechnol,2007,36(3):184.

