煙草野火病菌拮抗細菌的篩選及其應用研究
文景芝,楊曉敏,李櫻梅,孫劍萍
(1.東北農業大學農學院,哈爾濱 150030;2.牡丹江煙草科學研究所,黑龍江 牡丹江 157011)
由丁香假單胞桿菌煙草致病變種[Pseudomonas syringae pv.tabaci(World et Foster)Young et al.]引起的煙草野火病屬暴發性、毀滅性細菌病害[1],其發生嚴重影響煙草的品質和產量。該病最早于1917年由美國人Wolf和Foster報道,1917~1918年野火病成為美國北卡州危害最嚴重的病害[2]。近年來,該病在我國云南、貴州、河南、山東、湖北、遼寧和吉林等省煙草種植區均大面積發生,并有逐年加重的趨勢。目前該病害在抗病育種方面雖然取得一些進展,但研究表明中國推廣的烤煙品種長脖黃、NC82、G140、G28、K326、紅花大金元等均不抗野火病[3]。目前生產上最常用的藥劑為農用鏈霉素,雖對該病害防效較好,但連續使用不僅造成環境污染和殘留問題,對煙葉出口和卷煙安全帶來不利影響,而且使病原菌產生抗藥性,因此生物防治越來越受到人們的關注。當前應用較多的生防細菌主要有芽孢桿菌(Bacillus spp.)、假單胞桿菌(Pseudomonas spp.)、土壤放射桿菌(Agrobacterium radiobacter)以及其他一些細菌[4]。目前已篩選出對野火病菌有抑制作用的株系和對病菌有很高活性的放線菌類型C-25,A/60c-7/2和C-7/20,而且在美國放射形野桿菌(Radial field bacillus)菌系K84已進入商品化應用[5]。丁愛云等篩選出對野火病拮抗活性較強的菌株,其中細菌2株,放線菌2株,但國內在野火病的生物防治方面仍停留在室內試驗階段,研究還不夠深入[6]。考慮到從煙葉中分離到細菌更容易定殖于煙葉中,因此本研究從不同品種的健康煙葉中分離大量細菌,從中篩選對野火病菌表現較強拮抗能力且抑菌效果穩定的菌株,對其進行16S rDNA鑒定,并進行發酵條件優化,測定發酵液的田間防效。為測定拮抗細菌在煙草葉片中的定殖能力,本研究對拮抗細菌進行利福平抗性誘導試驗,為生物農藥的開發和應用奠定基礎。
1 材料與方法
1.1 供試菌株及培養基
煙草野火病菌(Pseudomonas syringae pv.tabaci)由牡丹江煙草科學研究所提供。
細菌的分離培養采用NA培養基;細菌的發酵培養采用NB培養液;細菌的保存采用PDA培養基。培養基配方參照文獻[7]。
1.2 煙草葉片的采集與細菌的分離
從牡丹江煙草科學研究所試驗田采集不同品種健康煙葉30份,分別取2 g葉片研磨,采用平板稀釋分離法分離葉片內外的細菌[8]。挑取不同類型單菌落在NA平板上劃線純化培養,將單菌落轉接到PDA斜面上編號培養后,保存待用。
1.3 煙草野火病菌拮抗細菌的篩選
拮抗細菌的篩選:將混有5%病原菌發酵液的培養基冷卻成平板。吸取70 μL待測細菌菌懸液在平板上劃線[9],以無菌培養液劃線為對照,28℃培養2~3 d后觀察抑菌效果,測量抑菌帶寬度。對于有抑菌效果的進行皿內復篩,檢測其遺傳穩定性,方法同上。
拮抗細菌的純培養[10]:把稀釋10-5倍的菌液涂布于牛肉膏固體培養基平板,培養一段時間后形成單菌落。挑選長勢好、菌落飽滿的菌株用連續劃線法對細菌純化培養,保存待用。
1.4 拮抗細菌菌株的鑒定
拮抗菌株的形態觀察及生理生化特性鑒定,參照文獻[11]。
拮抗菌株的16S rDNA鑒定:采用Schroth等的方法提取拮抗細菌菌株總DNA[12],并稍作改進。采用細菌16S rDNA V3區通用引物對F338GC和R518(引物由上海生工合成)進行PCR。PCR反應體系:dNTP(10 mmol·L-1)0.5 μL,10×buffer(含 MgCl2)5 μL,引物 F338GC 和 R518(25 μmol·L-1)各 1 μL,TaqDNA 酶 1 μL,模板 2 μL(200 ng·μL-1),無菌去離子水39.5 μL。PCR擴增條件:95℃ 5 min,94℃ 10 s,62℃ 20 s,66℃40 s,68℃ 7 min,35個循環。經1%瓊脂糖凝膠電泳檢測后,將PCR產物交上海生工測序,將測得的16S rDNA序列與GenBank數據庫序列進行BLAST分析比對,確定拮抗細菌菌株的分類地位。
1.5 拮抗細菌菌株的利福平抗性標記
參照杜立新等的方法并稍加改進[13]。首先在NA平板上活化拮抗細菌菌株,挑取單菌落在含有利福平5 μg·mL-1的NB培養基中28℃下震蕩培養2 d,然后在含有5 μg·mL-1利福平的NA平板上培養,待長出菌落后,逐級提高利福平濃度進行誘導培養,使菌株逐漸適應高濃度利福平。用NA平板拮抗試驗驗證抗藥菌株對煙草野火病菌的拮抗性,以原始菌株為對照。
1.6 拮抗細菌發酵條件的優化
1.6.1 發酵液中拮抗細菌活菌數與菌液吸光度的相關性測定
將拮抗細菌菌懸液用無菌水稀釋成10-4、10-5、10-6、10-7四個濃度,采用UV-8000紫外分光光度計測定各濃度菌懸液OD625值,同時在NA平板上加入各濃度菌懸液100 μL,用涂布器涂勻,28℃下培養2 d,計測各濃度菌懸液的菌落數,計算單位體積活菌數和吸光值與活菌數的相關性。
1.6.2 單因子試驗
在發酵條件初篩的基礎上,選取不同單一碳源(可溶性淀粉、葡萄糖、木糖、麥芽糖、甘油、乳糖、蔗糖和甘露醇,用量0.5%);在碳源不變情況下,選取不同單一有機氮源(牛肉膏、蛋白胨、酵母膏和胰蛋白胨,用量1%)和不同單一無機氮源(NH4NO3、(NH4)2SO4、NH4Cl和KNO3,用量1%),并進行兩種較優有機氮源的組合配比試驗;在較優碳源、氮源情況下,加入不同量的NaCl(0.1%、0.3%和0.5%);較優碳源、氮源和NaCl中,加入不同量的無機氮源(0.1%、0.3%和0.5%)。測定各條件下菌懸液OD625值及其對煙草野火病菌的抑菌活性。
1.6.3 培養基優化正交試驗
依據單因子試驗結果,選取較優不同碳源濃度(0.1%、0.3%和0.5%)、較優不同有機氮源濃度(0.5%、1%和2.0%)、較優無機不同氮源濃度(0.1%、0.3%和0.5%)、不同NaCl濃度(0.1%、0.3%和0.5%),進行4因素3水平的正交試驗,28℃下震蕩培養2~3 d。測定各條件下菌懸液OD625值及其對煙草野火病菌的抑菌活性。
1.6.4 培養條件的優化試驗
采用優化后的發酵培養基,在不同培養溫度(25、28、33、36和39℃)、不同培養基pH(4.0、4.5、5.0、6.0、6.5、7.0、7.5、8.0和9.0)、不同接種量(1%、2%、3%、4%、5%、8%和10%)和不同通氣量(250 mL三角瓶中分別裝20、30、40、50、60、70和80 mL)條件下培養拮抗細菌菌株,28℃培養2~3 d后,測定各條件下菌懸液OD625值及其對煙草野火病菌的抑菌活性。
1.7 拮抗細菌發酵液的田間藥效試驗
本試驗于2010年6~7月在牡丹江煙草科學研究所試驗場煙田進行,每小區有團棵期煙株15株。共設3個處理:A-拮抗菌活菌發酵液(6倍稀釋液,約6×108cfu·mL-1);B-拮抗菌優化發酵液(6倍稀釋液,約6×108cfu·mL-1);C-藥劑甜葉桔(3 000倍稀釋液);D-清水對照。采用隨機區組排列,重復3次。采用高壓噴霧法噴霧(每處理噴施2 L),隔天重新噴1次。2 d后各處理噴施病原菌,每處理噴施2 L。噴施病原菌后保濕,第5天、第10天按照中華人民共和國煙草病害分級標準(YC T 39-1996)[3]分別調查,每小區調查10株,每株調查中下部葉片10片,計算病情指數及防治效果。
2 結果與分析
2.1 煙草野火病菌拮抗細菌的篩選
從健康煙草成熟葉片中分離到細菌287株,其中14株對煙草野火病菌具有一定拮抗作用,抑菌帶寬度在3.6~9.3 mm之間。其中菌株Y32的抑菌效果最好,并且抑菌效果穩定(見圖1-A),至少達10代左右。
2.2 菌株Y32的鑒定
菌株Y32的形態特征觀察結果表明,菌株Y32在NA培養基上生長良好,菌落形態為圓形或近圓形,突起,乳白色,不透明,不產生色素。其生理生化特性為:運動性試驗、葡萄糖氧化發酵、M.R.試驗、V.P.試驗、檸檬酸鹽利用試驗、接觸酶試驗、淀粉水解試驗、硫化氫試驗、硝酸鹽還原試驗以及明膠液化試驗均為陽性,且NaCl含量為2%、5%、7%、10%時菌株生長良好,吲哚試驗為陰性。上述特性與枯草芽孢桿菌(Bacillus subtilis)完全一致,初步確定該菌株為枯草芽孢桿菌。
菌株Y32 16S rDNA測序結果如下:GCTATGC AATACTTACCTGCAATAGTGACGAAAGTCTGGAC GGAGCAACGCCGCGTGAGTGATGAAGGTTTTCGG ATCGTAAAGCTCTGTTGTTAGGGAAGAACAAGTA CCGTTCGAATAGGGCGGTGCCTTGACGGTACCTAA CCAGAAAGCCACGGCTAACTACGTGCCAGCAGCC GCGGTAATAAAAA。此序列與GenBank中已報道的序列同源性比較結果表明,Y32與枯草芽孢桿菌 MSB10(Bacillus subtilis MSB10)的同源性達到96%,證明該菌屬于枯草芽孢桿菌(Bacillus subtilis)。
2.3 拮抗細菌Y32的利福平抗性標記
試驗最終培養出抗80 μg·mL-1利福平的標記菌株,記為Y32標記。該標記菌株對煙草野火病菌的拮抗作用如圖1-D所示,表明Y32標記菌株對煙草野火病菌的拮抗效果顯著低于原始菌株,而且在培養過程中出現拮抗細菌生活力下降、拮抗活性降低、菌體變透明等現象,與原始菌株不同,而且無法計數,因此不能作為進一步研究拮抗細菌在煙草植株體內定殖試驗的材料。
2.4 拮抗細菌發酵條件的優化
2.4.1 發酵液中拮抗細菌的活菌數與菌液吸光度的相關性
發酵液中拮抗細菌的活菌數量與其OD625值呈線性關系,線性方程為y=1.4541x+6.4316,r2=0.9393,因此可以用發酵液的OD625值代表發酵液中的拮抗細菌活菌數。以下試驗均用發酵液的OD625值來表示發酵液中的拮抗細菌活菌數。
2.4.2 單因子試驗
試驗結果表明,最佳碳源為葡萄糖,最適濃度為0.1%;單一氮源以蛋白胨和酵母膏為宜,其中0.5%酵母膏+0.3%蛋白胨的配比抑菌效果最好,且組合濃度為1%時拮抗細菌的產量最大,且抑菌帶最寬;無機氮源以0.5%KNO3最好;一定量的NaCl能促進拮抗細菌的生長,并能提高拮抗細菌的抑菌活性,其中以0.3%NaCl效果最好。
2.4.3 培養基優化正交試驗
以抑菌帶寬為指標,得出拮抗細菌的實驗室最佳發酵配方為:氮源(酵母膏∶蛋白胨=5∶3)1%,葡萄糖0.1%,NaCl 0.3%,KNO30.5%。通過培養條件優化試驗,結果得到抑菌帶寬度達到16.8 mm(見圖1-B),大于正交試驗結果中的最高值11.4mm。
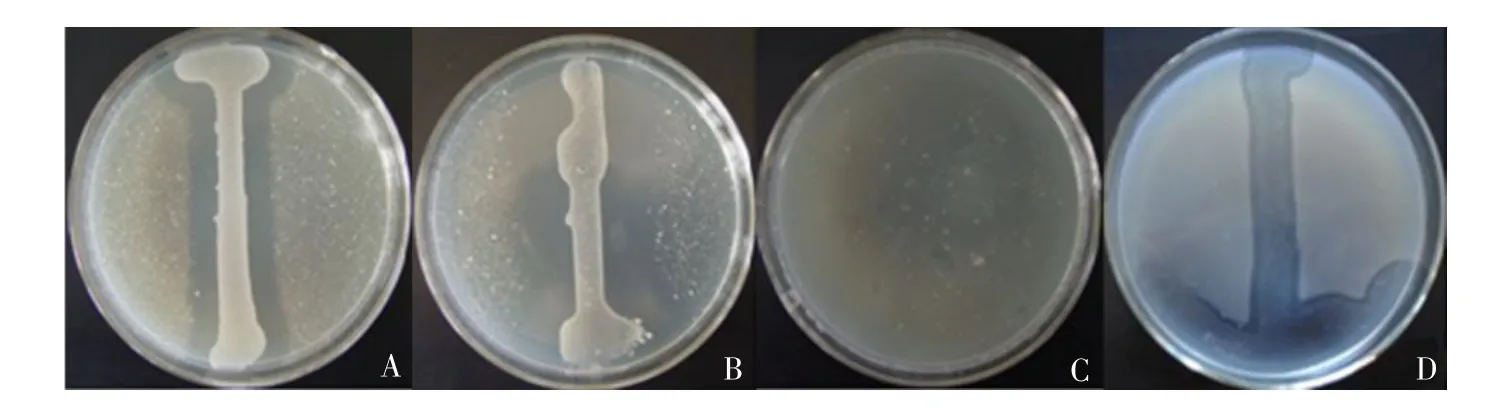
圖1 菌株Y32對煙草野火病菌的拮抗效果Fig.1 Effect of Y32 against Pseudomonas syringae pv.tabaci
2.4.4 培養條件的優化
試驗結果顯示,使拮抗細菌的生長量最大、且抑菌帶最寬的培養條件為:溫度28℃、pH 7.0~7.5、接種量4%、裝液量250 mL三角瓶裝50 mL。
2.5 Y32發酵液對煙草野火病的田間藥效
試驗結果見表1。Y32菌株優化發酵前防效為60.7%,顯著好于藥劑甜葉桔的防效45.3%,優化發酵后的防效為71.6%,比優化發酵前提高了10.9%,顯著高于其他處理。
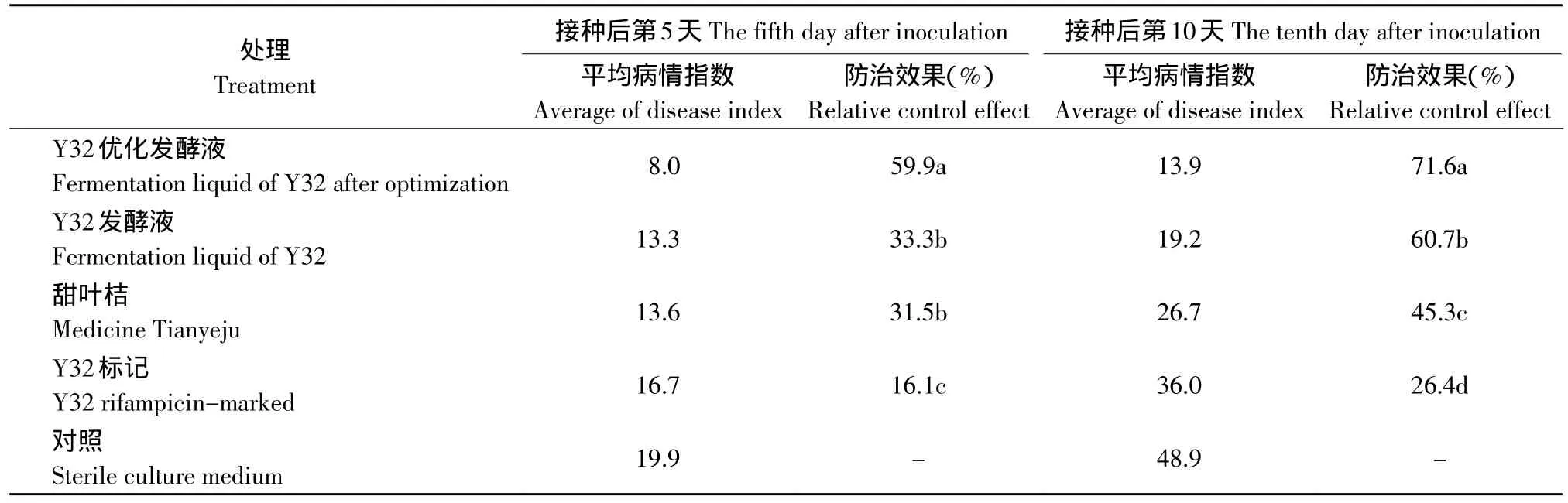
表1 Y32發酵液對煙草野火病的田間藥效Table1 Field effect of Y32 fermentation liquid against tobacco wildfire disease
3 討論與結論
拮抗菌篩選方法中,最常用的有平板劃線法、抑菌圈法和瓊脂塊法[8]。由于本試驗中病原菌和所篩選的拮抗菌均為細菌,在以上方法的基礎上,將病原菌與待測細菌均制成菌懸液再進行拮抗性鑒定,這種方法觀察結果更加直觀、快速。由于細菌在離體條件下拮抗作用與自然環境下防病作用往往不存在必然聯系,因此本試驗又將篩選出的拮抗效果較好的Y32菌株進行田間試驗,防效較多。
細菌是目前人們研究的一類重要生防菌,能夠產生細菌素、抗生素及次生代謝產物等活性物質,對病原菌具有很強的抑制作用,具有廣泛的用途和巨大的經濟價值。已開發出大量優良生防菌株進行商品化應用,取得了可觀的生態效益[14]。本試驗篩選出的枯草芽孢桿菌Y32對煙草野火病菌具有很強的拮抗作用。通過發酵條件優化和培養基成分正交試驗,明確其最佳的發酵配方為:氮源1%(酵母膏∶蛋白胨=5∶3),葡萄糖0.1%,NaCl 0.3%,KNO30.5%;最佳培養條件為:發酵溫度28℃,培養基pH 7.0~7.5,接種量4%,裝液量250 mL三角瓶裝液50 mL。其最佳發酵條件的確定,為以后活性物質的進一步研究和生物農藥的開發奠定基礎。
拮抗細菌能否在目標植株內定殖是生防菌取得防效的關鍵[14],研究拮抗細菌在植株體內定殖的方法主要有抗利福平、氨芐青霉素和卡那霉素等抗菌素標記法及電鏡觀察法、抗血清法和免疫膠體金染色法等[15]。本試驗雖然獲得了利福平抗性標記菌株,但由于該標記菌株對煙草野火病菌的抑制作用顯著低于野生菌株,并且在培養基上菌落呈透明狀,已經不能代表原來的野生菌株,因此認為利福平抗性標記不適于研究拮抗細菌在煙草葉片中的定殖能力,其他標記方法有待研究,如綠色熒光蛋白標記方法,本研究將針對此方法進一步進行該生防菌的定殖研究。
[1]袁美麗,高潔,張佳環,等.煙草野火病藥劑防治研究[J].吉林農業大學學報,1994,16(4):18-23.
[2]Lucas G B.Diseases of tobacco[M].Third edition.Raleigh North Carolina,U.S.A.,1975∶397-405.
[3]孔凡玉,朱賢朝,石金開,等.我國煙草侵染性病害發生趨勢原因及防治對策[J].中國煙草,1995(1):31-34.
[4]Keer A.Interactions of soil micro flora with cucurbit wilt special emphasis on non-pathogenic Fusarium[J].Soil Biology and Biochemistry,1982,20:167-192.
[5]張廣民,呂軍鴻,闞光鋒,等.煙草野火病研究概況[J].中國煙草學報,2002,8(2):34-37.
[6]丁愛云,鄭繼法,時呈奎,等.煙草幾種重要病害拮抗菌的篩選[J].中國煙草科學,1999(1):10-11.
[7]方中達.植病研究方法[M].第三版.北京:中國農業出版社,1998:171-208,212-218.
[8]Edwards K,John stone C,Thompson C.A simple and rapid method for the preparation of plant genomic DNA for PCR analysis[M].Nucleic Acids Research,1991,19:1349.
[9]王曉翠,李杰.豬源乳酸芽孢桿菌的篩選與鑒定[J].東北農業大學學報,2011,42(3):131-135.
[10]耿印印,王旭梅,王紅旗,等.污染土壤中耐鎘菌株的篩選、鑒定及吸附試驗研究[J].東北農業大學學報,2010,41(11):59-65.
[11]布坎南R E,吉本斯N E.伯杰細菌鑒定手冊[M].8版.北京:科學出版社,1984:54-68.
[12]Schroth N,Milton J G.Hancock.Importance of chitin synthesis for gunfal growth and as a target for antofungal agents[J].Journal of General Microbiology,1981,53(10):281-285.
[13]杜立新,馮書亮,曹克強,等.枯草芽孢桿菌BS-208和BS-209菌株在番茄葉面及土壤中定殖能力的研究[J].河北農業大學學報,2004,27(6):78-82.
[14]Jiang X L,Xie D L,Ni C F,et al.The antibioticaction of zhongshenmycin[J].Acta Phytopathologica Sinica,1997,27(2):133-138.
[15]楊海蓮,孫曉璐,宋末.水稻內生陰溝腸桿菌的定殖研究[J].自然科學進展,1999,9(12):1241-1244.

