利用絮凝及雙水相萃取分離純化發酵液中的R,R-2,3-丁二醇*
高健,薛鋒,李鳳偉,徐虹
1(鹽城工學院化學與生物工程學院,江蘇鹽城,224051)
2(南京工業大學食品與輕工學院、材料化學工程國家重點實驗室,江蘇南京,210009)
利用絮凝及雙水相萃取分離純化發酵液中的R,R-2,3-丁二醇*
高健1,2,薛鋒1,李鳳偉1,徐虹2
1(鹽城工學院化學與生物工程學院,江蘇鹽城,224051)
2(南京工業大學食品與輕工學院、材料化學工程國家重點實驗室,江蘇南京,210009)
針對Paenibacillus polymyxa ZJ-9一步法發酵菊芋菊粉粗提液制備R,R-2,3-丁二醇的發酵液特點,利用殼聚糖對該發酵液進行絮凝研究。結果表明,殼聚糖分子量、殼聚糖用量、助凝劑海藻酸鈉用量、pH和攪拌時間分別為:43.5 kDa、0.75 g/L、0.125 g/L、5.0和15 min時,絮凝效果最佳,在此工藝條件下,發酵液中菌體和蛋白質的絮凝率分別高達89.46%和78.93%,而R,R-2,3-丁二醇保留率約為98.54%。利用雙水相萃取技術對絮凝后的發酵液中R,R-2,3-丁二醇進行了分離,結果表明,異丙醇/硫酸銨雙水相體系萃取效果最好,當異丙醇和硫酸銨的用量分別約為33%和30%(w/w)時,R,R-2,3-丁二醇在上相的分配系數和萃取率最高,分別約為7.96和89.40%,且異丙醇/硫酸銨雙水相體系能夠有效萃取分離絮凝后的發酵液中不同含量的R,R-2,3-丁二醇。絮凝和雙水相萃取技術分離發酵液中R,R-2,3-丁二醇具有針對性強、效率高、成本低等優點,適用于工業化生產。
Paenibacillus polymyxa ZJ-9,R,R-2,3-丁二醇,絮凝,殼聚糖,雙水相萃取
2,3-丁二醇是一種典型的生物基化學品,是潛在的重要四碳平臺化合物,用途廣泛,可應用到食品、燃料、航空航天以及化工等多個領域,用于制備食品添加劑、燃料添加劑、燃料、塑料、炸藥、溶劑、油墨、香水、軟化劑、增濕劑、熏蒸劑、增塑劑等,具有生物降解性[1-2]。R,R-2,3-丁二醇除了具有2,3-丁二醇的用途外,還是優良的抗凍劑,合成手性試劑和手性配體的重要中間體,在手性藥物和天然產物的合成中也有潛在的重要應用[3-7]。
2,3-丁二醇親水性強、沸點高、黏度大,易于和水發生共沸現象,分離提純2,3-丁二醇一直成為制約發酵法生產2,3-丁二醇的瓶頸問題。傳統的2,3-丁二醇分離方法一般是先采用離心法或膜過濾法對發酵液進行預處理,然后通過有機溶劑萃取、真空膜蒸餾、逆氣流提取、鹽析等技術進一步濃縮提純[8-10]。但是離心法、蒸餾法能耗比較大;膜過濾法、有機溶劑萃取法成本高、污染重。而殼聚糖絮凝和雙水相體系萃取技術由于具有操作簡單、利于放大、環境友好、成本低等優點逐漸成為分離提純發酵中2,3-丁二醇的研究熱點[11-13]。作者在前期研究過程中,篩選獲得菌株Paenibacillus polymyxa ZJ-9能一步法發酵菊芋菊粉粗提液高產R,R-2,3-丁二醇,且光學純度達98%以上[14]。而一步法發酵菊粉粗提液制備R,R-2,3-丁二醇,發酵液中除了含有大量菌體、蛋白質、未消耗的培養基外,還含有多粘類芽孢桿菌合成的大量粘稠性物質以及菊芋菊粉粗提液中殘留的纖維素、果膠等,發酵液成分非常復雜,進一步增加了分離純化發酵液中R,R-2,3-丁二醇難度。本工作首次嘗試利用殼聚糖對此類體系進行絮凝研究,然后再用親水性有機溶劑/鹽組成的雙水相體系對絮凝后的發酵液進行萃取分離R,R-2,3-丁二醇。
1 材料及方法
1.1 R,R-2,3-丁二醇發酵液制備
在最佳發酵培養條件下,利用菌株P.polymyxa ZJ-9一步法發酵菊粉粗提液合成R,R-2,3-丁二醇,取42 h的發酵液(測定R,R-2,3-丁二醇和菊粉的濃度分別約為37.56 g/L和3.83 g/L)用于分離純化研究[14]。
1.2 實驗方法
1.2.1 絮凝劑的配制
選擇脫乙酰度大于90%殼聚糖(分子量約為86.0 kDa),先用水分散殼聚糖使其終濃度為5%,再加終濃度為5%的HCl溶液水解殼聚糖(每100 mL的5%HCl加1 mL左右的雙氧水),置回流裝置分別加熱水解15 min、30 min、45 min、60 min、75 min和90 min,水解后將溶液移至旋轉蒸發儀,減壓蒸發濃縮至粘糊狀,加入無水乙醇后用定性濾紙抽濾,沉淀用研缽研磨,加入乙醇重復研磨幾遍后,用真空干燥器室溫干燥,結果為纖維狀或粉末狀的固體。檢測水解后的殼聚糖分子大小,篩選具有最佳絮凝效果的適宜分子量的殼聚糖水解片段。
采用1.0%的醋酸溶液配制殼聚糖水解片段溶液,并用蒸餾水配制助凝劑海藻酸鈉溶液,兩者濃度均為10.0 g/L,磁力攪拌溶解后,靜置溶脹24 h后備用。
1.2.2 發酵液絮凝單因素實驗
用量筒量取40 mL發酵液于50 mL小燒杯中,在磁力攪拌下,向發酵液中逐滴加入適量殼聚糖,然后滴加少量助凝劑海藻酸鈉,攪拌數分鐘后,靜置,取上清液分析菌體及蛋白的絮凝率。從殼聚糖用量、海藻酸鈉用量、絮凝pH值和攪拌時間4個因素進行單因素實驗研究。
1.2.3 發酵液絮凝正交實驗
根據單因素實驗的結果,選擇殼聚糖用量、海藻酸鈉用量、絮凝pH值和攪拌時間4個因素,按照L9(43)進行正交實驗(見表1),以確定最佳的發酵液絮凝工藝條件。

表1 絮凝正交實驗因素水平表
1.2.4 雙水相萃取實驗
取5 mL絮凝后的R,R-2,3-丁二醇發酵液到10 mL的具塞比色管中,分別考察乙醇/磷酸氫二鉀、乙醇/硫酸銨、異丙醇/磷酸氫二鉀、異丙醇/硫酸銨4個雙水相萃取體系對絮凝后的發酵液中的R,R-2,3-丁二醇分離純化效果。依次加入親水性有機溶劑、鹽,振搖,靜置,然后測定R,R-2,3-丁二醇和殘糖在雙水相體系中的分配系數及萃取率。分配系數K=Ct/Cb,萃取率Y/%=Mt/M×100,去除率R/%=(1-Mt)/M×100,其中Ct、Cb分別為雙水相萃取時上、下相中的物質的濃度;Mt、Mb分別為上相物質的量和物質的總量。
1.3 分析方法
1.3.1 發酵液細胞生物量的測定
將發酵液稀釋20倍,在660 nm處測定稀釋液的吸光值,并將其轉換成細胞的干重(DCW)。

1.3.2 R,R-2,3-丁二醇的含量測定
發酵液預處理:取5 mL發酵液到離心管,10000 r/min離心10 min,然后取上清液按1∶1體積比加入乙酸乙酯萃取,靜置分層后取上層清液進行氣相分析。
檢測條件:毛細管手性色譜柱Cyclosil-B,30 m×250 μm×0.5 μm;進樣口溫度200℃,進樣量1.0 μL;分流比20∶1;載氣為高純N2,流速1.2 mL/min;采取程序升溫,初始溫度130℃,最終溫度160℃(維持1 min),升溫速率5℃/min;FID檢測器,檢測器溫度240℃。
1.3.3 菊粉含量檢測
菊粉含量檢測參照張江紅等方法[11]。
1.3.4 蛋白質濃度測定
蛋白質濃度測定采用考馬斯亮藍法[15]。
1.3.5 殼聚糖分子量測定
利用凝膠色譜法測定殼聚糖分子量,以標準分子量的葡聚糖為基準[16]。
2 結果與討論
2.1 殼聚糖分子質量對R,R-2,3-丁二醇發酵液絮凝效果的影響
分子質量約為86.0 kDa殼聚糖分別經HCl加熱水解15 min、30 min、45 min、60 min、75 min和90 min后,測定水解后殼聚糖分子量(kDa)分別約為:72.8、61.2、43.5、28.6、16.9和8.7。分別利用水解后殼聚糖片段及未水解的殼聚糖對R,R-2,3-丁二醇發酵液中的菌體和蛋白進行絮凝。由圖1可知,分子量約為43.5 kDa的殼聚糖對發酵液中的菌體和蛋白絮凝效果最好。殼聚糖相對分子質量越大黏度越大,絮凝效率也會越高,但分子質量過大,黏度過高,形成的絮凝顆粒會迅速沉淀,不利于絮凝劑和游離菌體充分作用,反而影響其絮凝效果[16]。但小分子質量的殼聚糖對發酵液中的蛋白質絮凝效果要優于對菌體的絮凝,小分子質量的殼聚糖形成的膠團小,黏度雖低,但相對表面積比較大,能夠充分接觸比菌體形狀小得多的蛋白質,易產生絮凝。
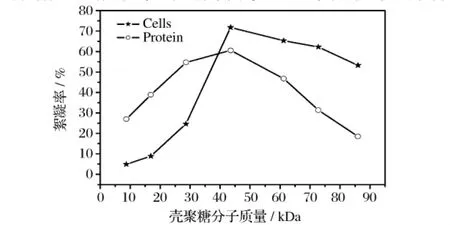
圖1 殼聚糖分子質量對絮凝效果的影響
2.2 殼聚糖絮凝最佳工藝條件確定
通過單因素實驗對絮凝的工藝條件進行了研究,結果表明,殼聚糖用量、助凝劑海藻酸鈉用量、pH和攪拌時間分別為:0.75 g/L、0.125 g/L、5.0和15 min時,絮凝效果相對較好。在上述實驗的基礎上,采用正交實驗確定發酵液絮凝的最佳工藝條件,實驗結果見表2。
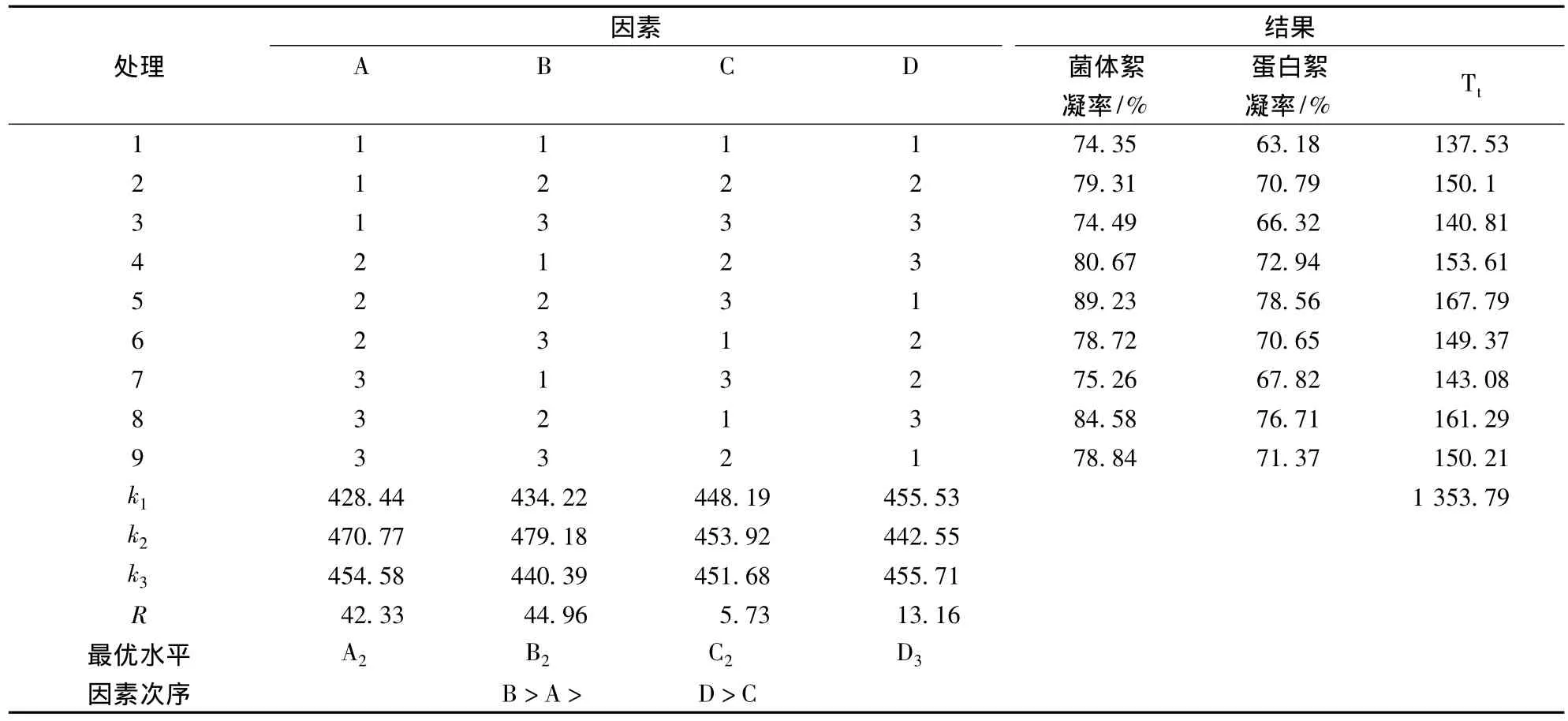
表2 絮凝正交實驗表及結果
經極差分析處理與方差分析,其結果分別見表2和表3。由表可知,發酵液絮凝的影響因素次序為:B﹥A﹥D﹥C,即海藻酸鈉用量(B)對絮凝影響最大,其次是殼聚糖用量,相對其它因素,pH值對絮凝效果影響最小。正交實驗結果表明,發酵液絮凝的最佳工藝條件為A2B2C2D3。在最佳絮凝工藝條件下,發酵液中菌體和蛋白質的絮凝率分別達89.46%和78.93%。最佳條件絮凝后,R,R-2,3-丁二醇濃度約為37.01 g/L,R,R-2,3-丁二醇保留率高達98.54%。

表3 方差分析表
助凝劑海藻酸鈉能夠吸附在顆粒表面并起架橋作用,溶液中細小顆粒立即團聚成大顆粒沉淀下來,海藻酸鈉用量過多時,使膠團過大,導致快速沉淀,反而不利于發酵液中的游離菌體及蛋白質與殼聚糖充分發生作用,導致絮凝效果偏低。進一步加大殼聚糖用量,對發酵液中的菌體和蛋白質的絮凝效果反而降低,可能是因為發酵液中菌體和蛋白質在殼聚糖表面吸附過多,處于吸附過飽和狀態,使形成的膠團重新出現穩定狀態,難以絮凝沉淀。攪拌時間過短,絮凝劑不能夠和菌體及蛋白質充分接觸,導致絮凝不充分;而攪拌時間過長,容易攪碎絮凝形成的膠團,溶液體系再次趨于穩定,難以發生絮凝沉淀,絮凝效果反而不佳。一般情況下,酸性條件有利于殼聚糖對發酵液中的菌體和蛋白質進行絮凝,殼聚糖在酸性條件下發生質子化,呈現陽離子絮凝劑的特征,質子化位點提供架橋的端點,并通過助凝劑的架橋作用促進絮凝發生。過酸的條件易使殼聚糖發生水解,反而不利于架橋作用,阻礙殼聚糖對菌體的絮凝。但是,pH越小越有利于去除蛋白質,這可能是因為溶液過酸容易使蛋白質發生變性作用。
2.3 雙水相萃取體系的選擇
選擇乙醇/硫酸銨、乙醇/磷酸氫二鉀、異丙醇/硫酸銨、異丙醇/磷酸氫二鉀4個雙水相體系為考察對象,取絮凝后的上清液5 mL到具塞比色管中,分別加入2 mL醇后再分別添加濃度(w/w)為15%、20%、25%、30%和35%的鹽,充分振搖后靜置12 h。結果表明,在鹽濃度梯度范圍內,乙醇/硫酸銨體系均難以分相;當鹽濃度為15%和20%時,乙醇/磷酸氫二鉀和異丙醇/磷酸氫二鉀體系也不分相,而鹽濃度達25%和30%時,上述兩種體系上相體積遠大于加入的醇的體積,分相效果欠佳;在鹽濃度梯度范圍內,異丙醇/硫酸銨體系分相效果良好,上相體積與加入的異丙醇體積相當。分析原因,可能是乙醇水化能力比異丙醇強,水分子留在乙醇相中較多,對體系分相不利。王志華等[17]也曾進行過這方面相關研究,發現對于雙水相萃取,異丙醇比乙醇效果好,與本文研究結論較一致。由于硫酸銨比磷酸氫二鉀更利于體系分相,且價格低廉,因此從考察的4個體系中選定異丙醇/硫酸銨雙水相體系對絮凝后發酵液中的R,R-2,3-丁二醇進行分離純化。
2.4 雙水相體系對絮凝后發酵液中R,R-2,3-丁二醇的分離效果
利用異丙醇/硫酸銨雙水相體系對絮凝后的發酵液中R,R-2,3-丁二醇進行分離純化,雙水相體系中的異丙醇和硫酸銨的濃度(w/w)能夠顯著地影響R,R-2,3-丁二醇分離效果,結果如圖2和圖3。

圖2 異丙醇和硫酸銨濃度對R,R-2,3-丁二醇分配系數(k)的影響

圖3 異丙醇和硫酸銨濃度對R,R-2,3-丁二醇萃取率(Y)的影響
由圖2和圖3可知,隨著異丙醇濃度的提高,R,R-2,3-丁二醇在上相的分配系數和萃取率逐步增加,但異丙醇的濃度從24%向36%的變化過程中,分配系數和萃取率上升趨勢趨于平緩,到33%時萃取率幾乎不再改變,而硫酸銨濃度變化對R,R-2,3-丁二醇分離效果的影響,30%濃度明顯優于35%及40%濃度。因此,當異丙醇和和硫酸銨的濃度分別為33%和30%時,雙水相萃取體系對絮凝后發酵液中R,R-2,3-丁二醇的分離效果最佳,R,R-2,3-丁二醇在上相的分配系數和萃取率分別達7.96和89.40%。上述結果表明,絕大部分R,R-2,3-丁二醇存在于上相異丙醇中。雖然R,R-2,3-丁二醇具有很強的親水性,但在異丙醇/硫酸銨雙水相體系中,由于鹽析作用,導致大多數R,R-2,3-丁二醇分配到上相異丙醇中,隨著異丙醇濃度的增加,鹽析作用不斷增強,R,R-2,3-丁二醇在上相的分配系數和萃取率也逐步提高[13]。
異丙醇/硫酸銨雙水相體系對絮凝后的發酵液中的菊粉幾乎不產生萃取作用,結果如圖4所示。由圖4可以看出,伴隨異丙醇和硫酸銨濃度的增加,絮凝后的發酵液中菊粉在上相的分配系數進一步降低,當異丙醇和硫酸銨的質量濃度分別為33%和30%時,菊粉在上相的分配系數僅為0.038,絕大部分菊粉分配在下相水中,R,R-2,3-丁二醇與菊粉在異丙醇/硫酸銨雙水相體系中選擇性分離系數高達209.47,該結果表明絮凝后的發酵液中發酵產物R,R-2,3-丁二醇和發酵液中殘留的底物菊粉通過異丙醇/硫酸銨雙水相萃取能夠達到高效分離的效果。
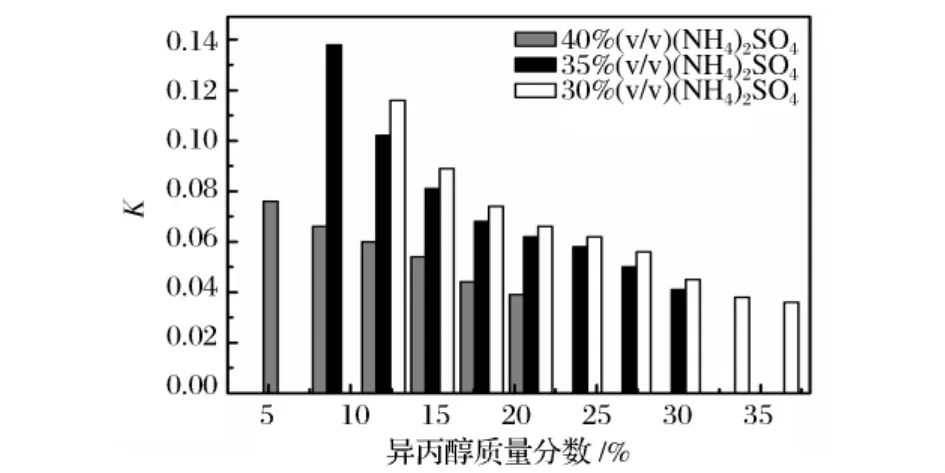
圖4 異丙醇和硫酸銨濃度對菊粉分離的影響
2.5 絮凝后發酵液中R,R-2,3-丁二醇含量對分離效果的影響
菌株P.polymyxa ZJ-9一步法發酵菊粉粗提液合成R,R-2,3-丁二醇,不同發酵批次,產物R,R-2,3-丁二醇的產量經常發生變化,特別是補料發酵,產量差異尤為明顯。利用異丙醇/硫酸銨雙水相體系對絮凝后的發酵液中不同含量的R,R-2,3-丁二醇進行了萃取分離,由表4可以看出,隨著發酵液中的R,R-2,3-丁二醇含量的提高,R,R-2,3-丁二醇在上相的分配系數和萃取率也逐步增加,萃取分離效果越來越好,因此,異丙醇/硫酸銨雙水相體系非常適合分離純化絮凝后的發酵液中不同含量的R,R-2,3-丁二醇。在進行雙水相萃取時,有趣的是,在上下相之間常形成一個“中間相”,其主要成分是可溶性蛋白質和菌體,由于在雙水相體系混合過程中蛋白質發生了不可逆轉的變性作用,導致了變性蛋白存在于上、下相之間[18]。由表4可知,異丙醇/硫酸銨雙水相體系能夠有效地對絮凝后發酵液中殘留的菌體、可溶性蛋白質及其它雜質進行進一步去除,大幅度地提高了對發酵液中R,R-2,3-丁二醇分離純化效果。
發酵液中2,3-丁二醇的傳統分離方法主用包含2個過程,先用膜過濾法或離心法去除殘留的菌體、蛋白和一些雜質,再用蒸餾法獲得2,3-丁二醇[13],這些方法導致分離純化丁二醇成本高、效果差。而利用異丙醇/硫酸銨雙水相體系對絮凝后發酵液中R,R-2,3-丁二醇進行萃取分離明顯優于上述分離效果,菊粉主用存在于下相水中可重復利用,殘留菌體和蛋白主用凝聚在“中間相”中容易去除,產物R,R-2,3-丁二醇主要分配在上相異丙醇中,很方便地通過蒸餾進行進一步分離純化(異丙醇沸點僅為82.5℃),并且上相中幾乎不含菌體和蛋白質量,有效地避免了蒸餾過程中經常發生的粘漿現象[13]。利用雙水相萃取分離R,R-2,3-丁二醇,具有效率高、成本低等優點,適用于工業化分離制備R,R-2,3-丁二醇。
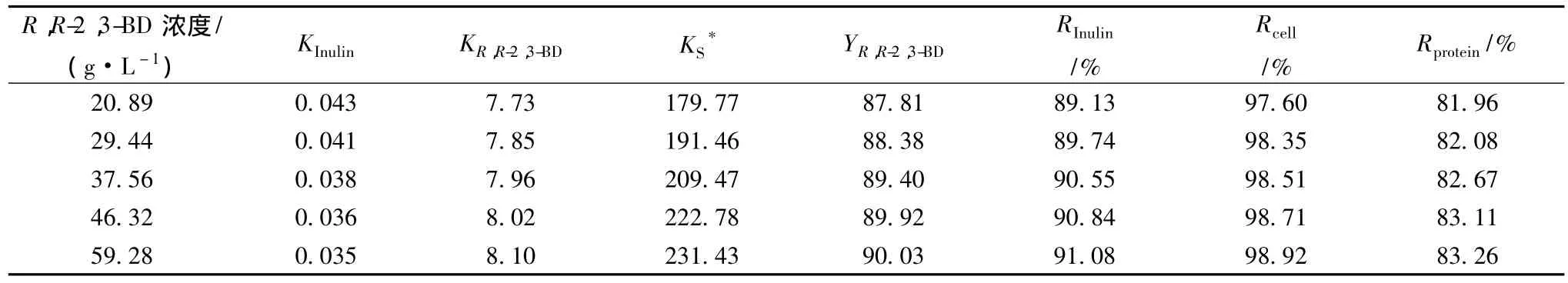
表4 發酵液中R,R-2,3-丁二醇含量對分離效果的影響
3 結論
利用殼聚糖對P.polymyxa ZJ-9一步法發酵菊粉粗提液制備R,R-2,3-丁二醇的發酵液進行絮凝,研究發現分子質量為43.5 kDa的殼聚糖對發酵液中的菌體和蛋白絮凝效果最好,并通過單因素實驗和正交實驗對絮凝的最佳工藝條件進行了研究,結果表明,殼聚糖用量0.75 g/L、助凝劑海藻酸鈉用量0.125 g/L、pH 5.0和攪拌時間15 min時,絮凝效果最佳,且海藻酸鈉用量對絮凝影響最大,其次是殼聚糖用量,相對其它因素,pH對絮凝效果影響最小。在最佳絮凝工藝條件下,發酵液中菌體和蛋白質的絮凝率分別高達89.46%和78.93%,而R,R-2,3-丁二醇保留率約為98.54%。利用雙水相萃取技術對絮凝后的發酵液中R,R-2,3-丁二醇進行了分離,結果表明異丙醇/硫酸銨雙水相體系萃取效果最好,當異丙醇和硫酸銨的用量分別約為33%和30%(w/w)時,R,R-2,3-丁二醇在上相的分配系數和萃取率最高,分別為7.96和89.40%,并且異丙醇/硫酸銨雙水相體系能夠有效萃取分離絮凝后的發酵液中不同含量的R,R-2,3-丁二醇。絮凝和雙水相萃取分離純化發酵液中R,R-2,3-丁二醇具有效率高、成本低等優點,對發酵液中R,R-2,3-丁二醇大規模分離提取應用提供了可靠的技術基礎。
[1]Tran A V,Chambers R P.The dehydration of fermentative 2,3-butanediol into methyl ethyl ketone[J].Biotechnol Bioeng,1987,29(3):343-351.
[2]Ng T K,Busche R M,McDonald C C,et al.Production of feedstock chemicals[J].Science,1983,219(4585):733-740.
[3]Celińska E,Grajek W.Biotechnological production of 2,3-butanediol-Current state and prospects[J].Biotechnology Advances,2009,27(6):715-725.
[4]Mas C D,Jansen N B.Tsao G T.Production of optically active 2,3-butanediol by Bacillus polymyxa[J].Biotechnol Bioeng,1988,31:366-377.
[5]Ceskis B,Lebedavia K V,Moiseankov A M.Eflective synthesis of the(4R,8R)-and(4R,8S)-diastereomers of 4,8-dimethyldecanal,Aggregation pheromones of the brionid beetles tribolium confusm and tribolium cast aneum[J].Izv Akad Nauk SSSR Ser Khim,1988(4):865.
[6]羅云富,李援朝.手性鄰二醇——(2S,3R)21,2,32丁三醇212對甲苯磺酸酯的不對稱合成[J].有機化學,2002,22(4):262-264.
[7]Shigeki I,T akehiro T,Hiroyuki I,et al.Color-compensating plate for surpert wisted-nematic liquid-crystal display device[J].Jpn Kokai T okkyo Koho,1991,91:623.
[8]Qureshi N,MeagherM M,Hutkins R W.Recovery of 2,3-butanediol by Vacuum Membrane Distillation[J].Separation Science and Technology,1994,29(13):733-1748.
[9]Anvari M,Khayati G.Insitu recovery of 2,3-butanediol from fermentation by liquid-liquid extraction[J].Ind Microbiol Biotechnol,2009,36(2):313-317.
[10]江波,張江紅,李志剛,等.2,3-丁二醇的發酵及鹽析分離工藝[J].生物加工過程,2009,7(1):44-48.
[11]張江紅,孫麗慧,修志龍.2,3-丁二醇發酵液的絮凝除菌與絮凝細胞的循環利用[J].過程工程學報,2008,8(4):779-783.
[12]Sun L H,Jiang B,Xiu Z L.Aqueous two-phase extraction of 2,3-butanediol from fermentation broths by isopropanol/ammonium sulfate system[J].Biotechnol Lett,2009,31(3):371-376.
[13]Jiang B,Li Z G,Dai J Y.Aqueous two-phase extraction of 2,3-butanediol from fermentation broths using an ethanol/phosphate system[J].Process Biochemistry,2009,44(1):112-117.
[14]Gao J,Xu H,Li Q J,et al.Optimization of medium for one-step fermentation of inulin extract from Jerusalem Artichoke Tubers using Paenibacillus polymyxa ZJ-9 to Produce R,R-2,3-butanediol[J].Bioresource Technology,2010,101:7076-7082.
[15]Bradford M M A.Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-251.
[16]蔣挺大.甲殼素[M].北京:中國環境科學出版社,1996:99-109.
[17]王志華,馬會民,馬泉莉,等.雙水相萃取體系的研究[J].應用化學,2001,18(3):173-175.
[18]Louwrier A.Model phase separations of proteins using aqueous/ethanol components[J].Biotechnol Tech,1998,12(5):363-365.
ABSTRACTR,R-2,3-Butanediol(R,R-2,3-BD)can been produced through one-step fermentation of inulin extract from Jerusalem artichoke tubers using Paenibacillus polymyxa ZJ-9.The pretreatment of fermentation broth by chitosan flocculation was investigated.The results were as following:the optimum flocculation was obtained using 0.75 g/L of chitosan with 43.5 ku molecular weight,0.125 g/L of sodium alginate,pH 5.0 and stirring for 15 minutes.The flocculation rate of cells and proteins reached 89.46%and 78.93%,respectively,and the retained ratio of R,R-2,3-butanediol reached 98.54%.Then,the different aqueous two-phase extraction systems were used to further investigate extraction of R,R-2,3-BD from the pretreated fermentation broth and the isopropanol/ammonium sulphate system was chosen as optimum system.The optimum phase composition was 33%(w/w)of isopropanol and 30.0%(w/w)of ammonium sulphate,and the partition coefficient and recovery of R,R-2,3-BD reached 7.96 and 89.40%,respectively.Furthermore,the isopropanol/ammonium sulphate aqueous two-phase extraction system could be used to separate different concentration R,R-2,3-BD from the pretreated fermentation broth by chitosan flocculation.
Key wordsPaenibacillus polymyxa,2,3-butanediol,flocculation,chitosan,aqueous two-phase extraction
Flocculation and Aqueous Two-phase Extraction of R,R-2,3-Butanediol from Fermentation Broth
Gao Jian1,2,Xue Feng1,Li Feng-wei1,Xu Hong2
1(School of Chemical and Biological Engineering,Yancheng Institute of Technology,Yancheng 224051,China)
2(State Key Laboratory of Materials-Oriented Chemical Engineering,College of Food Science and Light Industry,Nanjing University of Technology,Nanjing 210009,China)
博士(徐虹博導為通訊作者)。
*江蘇省自然科學基金計劃項目(BK2010290);江蘇省教育廳高校科研成果產業化推進項目(JHB2011-54);鹽城工學院科研基金項目(XKY2009006)。
2012-03-16,改回日期:2012-05-06

