蟲草菌多糖對吸煙引起的樹突狀細胞氧化損傷的保護作用*
王晨浩,徐 珺,王文梅,張偉云
南京大學醫學院 江蘇省醫學分子技術重點實驗室,南京 210093
越來越多的實驗證明,從高等植物、微生物或藻類提取的多糖具有良好的抗氧化、抗腫瘤、抗衰老、免疫調節活性[1-4]。蟲草菌多糖是冬蟲夏草(Cordyceps sinensis)的主要活性成分之一,具有多種生物活性。野生冬蟲夏草分布地域狹窄、資源稀少,需求量極大。研究發現,蟲草菌絲體的藥理作用與野生冬蟲夏草相似,且易于大規模發酵培養。本課題組從一株蟲草無性型真菌的發酵液中分離純化出胞外多糖(EPS)并且已發現其具有免疫調節作用[5]。我們之前的研究表明,蟲草菌多糖可抑制荷瘤小鼠體內腫瘤的生長和轉移,且進一步的實驗表明這一抑制作用是通過EPS調節小鼠體內的免疫系統和提高其抗氧化能力來發揮作用的[5-6]。
樹突狀細胞(DC)是機體專職抗原遞呈細胞,它在機體的特異性免疫和非特異性免疫中發揮著重要的橋梁作用,且它是機體免疫反應的重要啟動者,對于調節和維持機體內免疫系統的平衡與穩定有著重要的作用。在吸煙引起的相關疾病如慢性阻塞性肺病和肺癌的發病過程中樹突狀細胞起著重要的作用[7-8]。
吸煙造成的氧化應激損害機體的免疫防御功能已被廣泛認可,本文首次研究蟲草菌多糖(EPS)對于吸煙引起的樹突狀細胞的氧化損傷的保護作用。
1 材 料
1.1 藥品與試劑
南京(精品)香煙(南京卷煙廠,焦油:12 mg/支、尼古丁:1.2 mg/支);DCS細胞系(北京協和醫科大學);胎牛血清、RPMI-1640培養基(美國Gibco公司);MTT、二甲基亞砜(DMSO)、DCFH-DA(美國Sigma公司);CAT試劑盒、SOD試劑盒和LDH試劑盒(南京建成科技有限公司);其它試劑均為生化試劑或分析純。
1.2 儀器
TE2000-S倒置相差顯微鏡(日本Nikon公司);FACS Cailbur流式細胞儀(美國Becton-Dickson公司);MCO-15AC二氧化碳培養箱(日本Sanyo公司);Model-550酶標儀(美國Bio-Rad公司);Heraeus Fersco 17高速冷凍離心機(美國Thermo公司)。
2 方 法
2.1 EPS的制備
按照本實驗室建立的方法進行真菌發酵培養。收集蟲草菌發酵液,制備胞外多糖EPS[5]。EPS為均一多糖,其分子量為1.04×105,糖基組成為甘露糖-葡萄糖-半乳糖(23∶1∶2.6)。
2.2 香煙提取物的制備
將點燃的香煙通過吸煙泵導入RPMI-1640培養基,每支煙溶于10 mL培養液,通過調節流速控制一支煙在5 min左右燃完,過濾除菌即制得100%的煙提取物(CSE),于-20℃保存備用。使用時按比例用培養基稀釋。
2.3 MTT法測定香煙提取物對DCS細胞增殖的影響
取對數生長的DCS細胞,調整為以1×105·mL-1,接種于96孔培養板,100 μL/孔,貼壁。加入不同濃度的CSE,在培養液中終濃度分別為0%、3.75%、7.5%、15%、30%(原提取物為100%)。設5個平行孔,培養 48 h。加 10 μL MTT(5 mg·mL-1),培養 4 h,然后加入10%十二烷基硫酸鈉(SDS)過夜,用酶標儀于570 nm處測定OD值。
2.4 香煙提取物對DCS的作用及ROS含量測定
將 DCS 細胞(1×105·mL-1)接種于 24 孔板,1 mL/孔,貼壁。加入不同濃度CSE,設4個復孔,繼續培養 48 h。胰酶消化,收集細胞,離心(1000 r·min-1,10 min)去上清液,加入 DCFH-DA(150 μL/管,終濃度為 10 μmol·L-1),室溫避光孵育 30 min。添加 PBS(300 μL/管),用流式細胞儀檢測10000個細胞內的DCFH-DA平均熒光強度,激發波長488 nm,發射波長530 nm,用FLOWJO軟件分析數據。
2.5 EPS對DCS的保護后ROS含量測定
將 DCS 細胞(1×105·mL-1)接種于 24 孔板,1 mL/孔,貼壁。加不同濃度藥物 EPS(12.5、25、50、100 μg·mL-1),設 4 個復孔。培養 24 h 后加 7.5%CSE,繼續培養24 h。胰酶消化,收集細胞,離心(1000 r·min-1,10 min)去上清液,同上述方法檢測細胞內的DCFH-DA平均熒光強度。
2.6 EPS保護后DCS細胞乳酸脫氫酶(LDH)的測定
DCS 細胞稀釋成 1×105·mL-1,接種于 24 孔板,1 mL/孔,貼壁。加不同濃度 EPS(12.5、25、50、100 μg·mL-1),設 4 個復孔,培養 24 h 加 7.5%CSE(7.5%CES可引起ROS顯著增加)處理24 h。吸取培養上清液用于LDH活檢測。測定方法參照試劑盒說明書。
2.7 EPS保護后DCS細胞過氧化氫酶(CAT)和超氧化物歧化酶(SOD)活力的測定
DCS 細胞稀釋成 1×105·mL-1,接種于 24 孔板,1 mL/孔,貼壁。加不同濃度藥物 EPS(12.5、25、50、100 μg·mL-1),設 4 個復孔,作用 24 h 后加 7.5%CSE處理24 h,然后換新鮮培養基繼續培養。24 h后收集細胞,用PBS洗兩遍,重懸于0.2 mL 0.1 mol·L-1PBS(含 0.05 mmol·L-1EDTA)中,反復凍融3 次,4℃ 10200 r·min-1離心 30 min,取上清液用于CAT、SOD檢測。測定方法參照試劑盒說明書。
2.8 統計方法
3 結 果
3.1 香煙提取物對DCS細胞增殖的抑制作用
香煙提取物作用DCS細胞48 h后,其增殖能力明顯受抑制,在30%CSE作用下,具有顯著抑制作用(P<0.05),見圖 1。
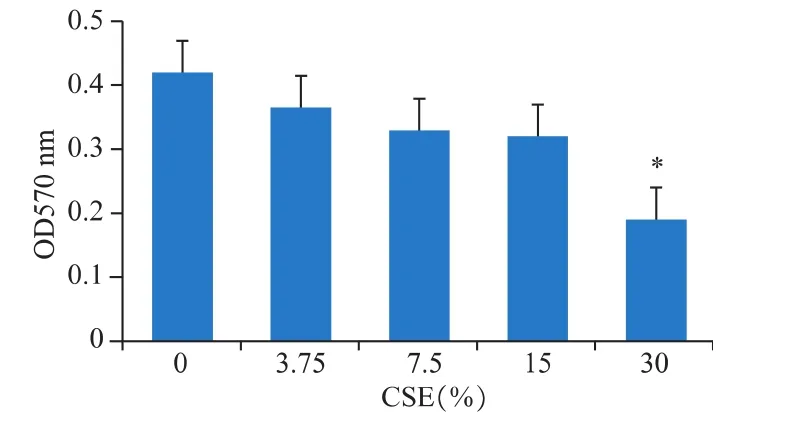
圖1 香煙提取物對DCS細胞增殖能力的影響
3.2 香煙提取物對DCS細胞ROS產生的影響
流式細胞儀檢測結果如圖2所示。香煙提取物作用DCS細胞48 h后,其ROS產生水平在CSE濃度為7.5%、15%和30%時有顯著增加(P<0.05),且呈劑量依賴關系。

圖2 香煙提取物對DCS細胞ROS水平的影響
3.3 EPS對DCS細胞ROS產生的保護作用
EPS與DCS細胞共同孵育24 h后,在25、50、100 μg·mL-1劑量組ROS產生的量明顯降低,可以抵抗煙引起的ROS增加(見圖3)。
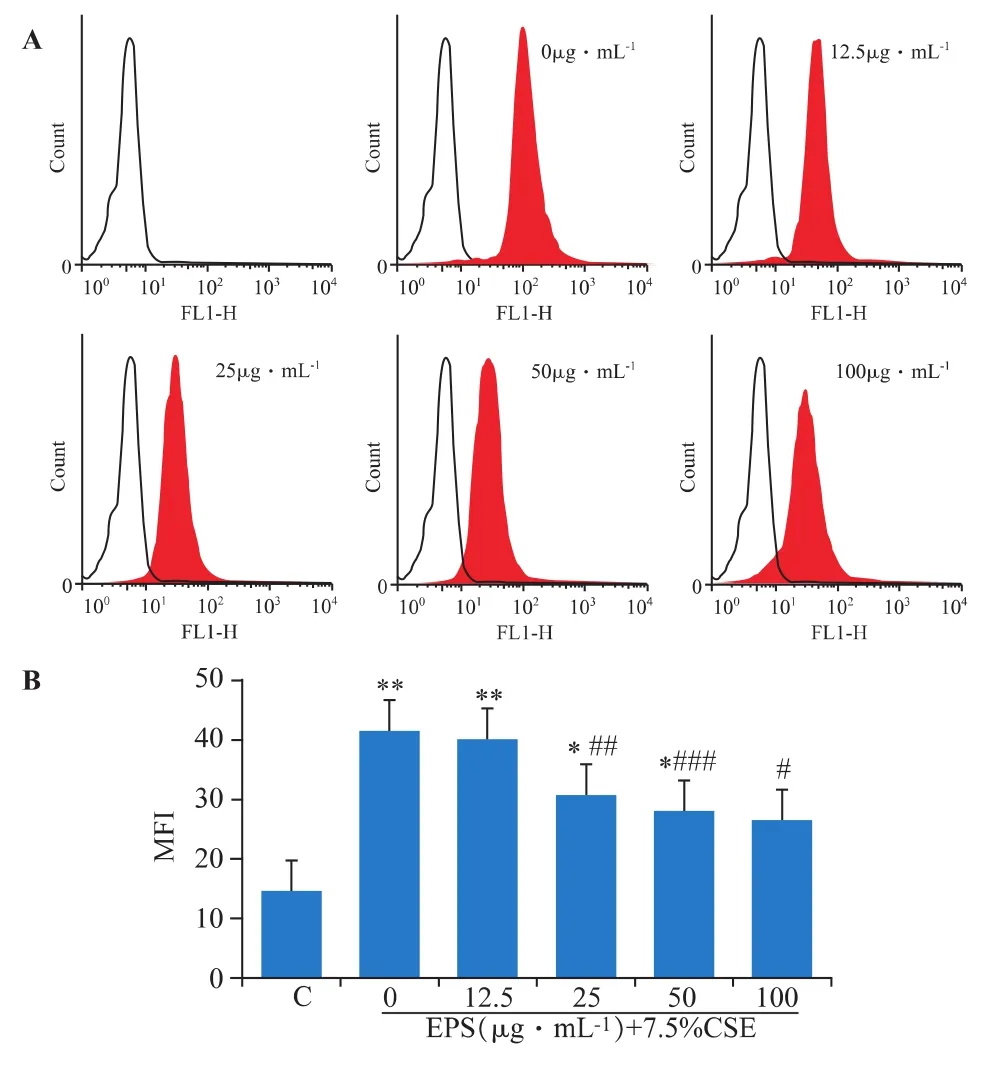
圖3 EPS對CSE誘導DCS細胞產生的ROS的抑制作用
3.4 EPS對DCS細胞LDH過度釋放的保護作用
LDH是廣泛存在于細胞中參與能量代謝的一類重要酶。LDH的過度釋放是細胞受損的一個重要指標。如圖4所示,由于煙的傷害導致DCS細胞釋放到細胞外的LDH活性顯著提高(P<0.001)。而采用EPS預孵育24 h,則顯著降低了LDH的水平(12.5 μg·mL-1和 25 μg·mL-1,P<0.05;50 μg·mL-1,P<0.01;100 μg·mL-1,P<0.001),且呈濃度依賴關系。
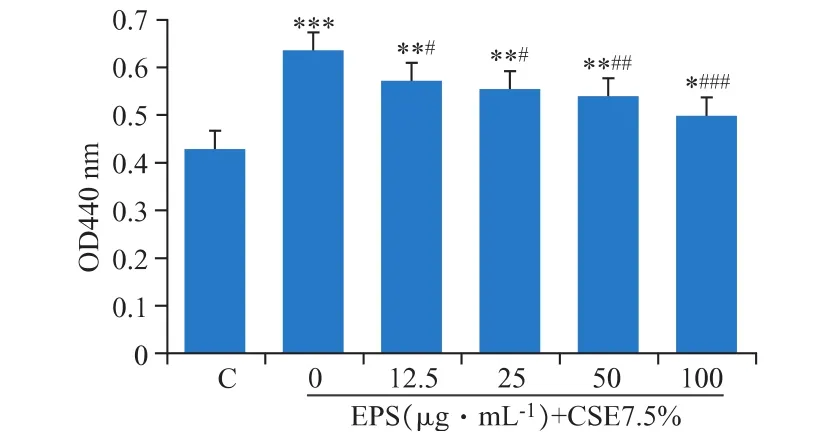
圖4 EPS對CSE誘導DCS細胞產生的LDH的抑制作用
3.5 EPS對DCS細胞CAT產生的保護作用
CAT是胞內催化H2O2分解的一類重要的抗氧化酶。如圖5所示,CSE的處理損耗了胞內大量的CAT(P<0.001),使 CAT 活性從 0.23 U·(mg prot)-1下降到 0.03 U·(mg prot)-1,而 EPS 的預處理,緩解了CAT活性的下降,效果極其顯著(P<0.001)。
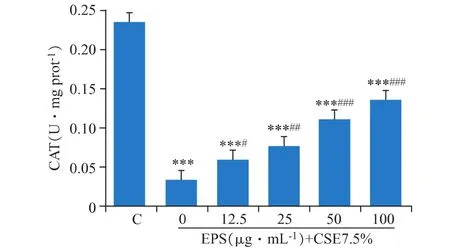
圖5 EPS對CSE處理的DCS細胞的CAT活性的影響
3.6 EPS對DCS細胞SOD產生的保護作用
SOD可以清除超氧陰離子自由基,從而保護細胞免受損傷。如圖6所示,CSE處理之后,細胞內SOD活性顯著下降(P<0.001),EPS預處理后對胞內SOD活力有非常顯著地提升(P<0.001)。
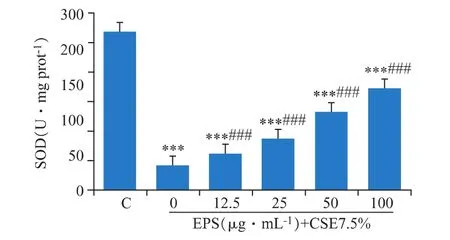
圖6 EPS對CSE處理的DCS細胞的SOD活性的影響
4 討 論
氧是人正常代謝所必須的成分,在人體中,需要用氧參與體內很多反應以維持生命。但在反應過程中,會產生一系列的活性氧(reactive oxygen species,ROS)。在正常的生理狀態下,ROS會在抗氧化酶及外源性和內源性的抗氧化劑的作用下處于生成與清除的動態平衡中,維持在極低水平,發揮其正常的生理功能[9]。但在內源性或外源性的刺激下,使機體代謝異常而驟然產生大量的ROS,或機體抗氧化防御能力不足時,則使得機體處于氧化應激狀態,導致細胞可逆或不可逆的損傷,引起細胞凋亡或壞死[10]。
已有研究顯示,吸煙可導致細胞內ROS升高,高濃度的ROS在細胞內可以攻擊生物膜中的多不飽和脂肪酸,使細胞質膜損傷,乳酸脫氫酶泄露,并導致細胞凋亡[11]。本實驗使用CSE誘導損傷的DCS,觀察EPS對氧化應激下細胞的保護作用。
實驗結果表明,CSE作用于DCS后,細胞的存活率明顯下降且LDH釋放量上升,說明CSE導致DCS細胞明顯損傷;而使用EPS預處理后,細胞LDH釋放量和ROS水平都顯著降低,說明細胞所受損傷減輕,證實EPS對氧化損傷狀態下的DCS有保護作用。CAT、SOD是廣泛存在于組織細胞中抗氧化酶類,可以通過清除過多的活性氧,保持胞內的氧化平衡,避免細胞氧化損傷[12]。在本實驗中CSE作用24 h可使DCS細胞內抗氧化酶活性明顯下降,其下降趨勢可以被不同濃度的EPS減弱。這些結果表明,EPS對DCS細胞的氧化應激有保護作用,并且其保護作用與調節細胞內抗氧化酶活性有關。
[1]Wu F,Yan H,Ma X,et al.Structural characterization and antioxidant activity of purified polysaccharide from cultured Cordyceps militaris[J].Afr J Microbiol Res,2011,5(18)∶2743-51.
[2]Umehara S,Fujiwara H,Shiozaki A,et al.PSK induces apoptosis through the inhibition ofactivated STAT3 in human esophageal carcinoma cells[J].Int J Oncol,2012,41(1)∶61-6.
[3]Xiao JH,Xiao DM,Chen DX,et al.Polysaccharides from the medicinal mushroom Cordyceps taii show antioxidant and immuno enhancing activities in a D-galactose-induced aging mouse model[J].Evid Based Complement Alternat Med,2012∶273435.
[4]Li XT,Zhang YK,Kuang HX,et al.Mitochondrial protection and anti-aging activity of Astragalus polysaccharides and their potential mechanism[J].Int J Mol Sci,2012,13(2)∶1747-61.
[5]Zhang W,Yang J,Chen J,et al.Immunomodulatory and antitumour effects of an exopolysaccharide fraction from cultivated Cordyceps sinensis(Chinese caterpillar fungus)on tumour-bearing mice[J].Biotechnol Appl Biochem,2005,42(1)∶9-15.
[6]Chen JP,Zhang WY,Lu TT,et al.Morphological and genetic character- ization of a cultivated Cordyceps sinensis fungus and its polysaccharide component possessing antioxidant property in H22 tumor-bearing mice[J].Life Sci,2006,78(23)∶2742-8.
[7]Givi ME,Redegeld FA,Folkerts G,et al.Dendritic cells in pathogenesis of COPD [J].Curr Pharm Des,2012,18(16)∶2329-35.
[8]Vassallo R,Tamada K,Lau JS,et al.Cigarette smoke extract suppresses human dendritic cell function leading to preferential induction of Th-2 priming[J].J Immunol,2005,175(4)∶2684-91.
[9]Sardina JL,López-Ruano G,Sánchez-Sánchez B,et al.Reactive oxygen species∶are they important for haematopoiesis[J].Crit Rev Oncol Hematol,2012,81(3)∶257-74.
[10]Gibson GE,Huang HM.Oxidative stress in Alzheimer’s disease[J].Neurobiol Aging,2005,26(5)∶575-8.
[11]Asano H,Horinouchi T,Mai Y,et al.Nicotine-and tar-free cigarette smoke induces cell damage through reactive oxygen species newly generated by PKC-dependent activation of NADPH oxidase[J].J Pharmacol Sci,2012,118(2)∶275-87.
[12]Ray G,Husain SA.Oxidants,antioxidants and carcinogenesis[J].Indian J Exp Biol,2002,40(11)∶1213-32.