長期膽汁反流對大鼠胃黏膜的影響
王學偉 曹勤 唐劍敏
(上海中醫藥大學附屬普陀醫院消化內科,*病理科,上海 200062)
長期膽汁反流對胃和食管黏膜的影響尚不明確。研究[1]發現膽汁反流至胃,甚至食管,十分常見。Dixon等[2]通過病理研究發現,膽汁反流可能與胃竇黏膜腸化生有關。近年來研究[3]發現,膽汁反流不但與反流性食管炎有關,而且可能是Barrett食管的重要病因,還可能與食管腺癌的發生有關[4]。因此,明確長期膽汁反流對胃和食管黏膜的病理影響,具有重要的臨床意義。本研究建立模擬人體生理性膽汁反流途徑的大鼠模型,觀察長期膽汁反流對大鼠胃黏膜的病理影響,通過免疫組化方法研究長期膽汁反流對胃泌素表達的影響,并探討其在膽汁反流中的作用。
1 資料與方法
1.1 動物和抗體 Sprague-Dawley大鼠,清潔級,雄性,8周齡,體質量250~300 g,購自中國科學院上海實驗動物中心。羊抗大鼠胃泌素多克隆IgG抗體購自美國Santa Cruz公司,兔抗羊IgG抗體購自北京中山公司。
1.2 動物模型 大鼠預適應1周,術前禁食24 h,只給予5%葡萄糖液,術前6 h禁葡萄糖液。麻醉采用10%水合氯醛0.3 mL/100 g腹腔注射。上腹正中切口4 cm,于十二指腸膽總管開口下0.5 cm處橫斷十二指腸、縫合斷端,于前胃與腺胃交界2 mm處前胃大彎側作1 cm切口,距Treitz韌帶4 cm遠側空腸系膜對側作1 cm切口,行胃-空腸吻口。術后24 h禁食,給予5%葡萄糖液,24 h后少量進食飼料,3 d后恢復正常飲食。
1.3 組織病理 模型建立1年后,13只大鼠經10%水合氯醛0.3 mL/100 g腹腔注射麻醉,斷頭法處死,大鼠胃經10%甲醛固定72 h,石蠟包埋,切片厚度4μm,HE染色。
1.4 免疫組化 切片65℃烘烤1 h,脫蠟、水化,自來水洗10 min,蒸餾水洗2次,蒸餾水浸泡5 min;再將切片放入3%H2O2,室溫孵育10 min,以消除內源性過氧化物酶活性,自來水洗10 min,蒸餾水洗2次,蒸餾水浸泡5 min;于檸檬酸緩沖液中微波抗原修復15 min,磷酸緩沖液(PBS)洗,5 min×3次;將切片放入正常血清中,室溫孵育30 min,以封閉內源性抗原結合位點;加入經PBS 1:100稀釋的一抗,4℃孵育過夜;PBS洗,5 min×3次;加入二抗,室溫孵育1 h,PBS洗5 min×3次;加入酶標物,室溫孵育1 h,PBS洗5 min×3次;加入DAB顯色液,顯色6 s,自來水洗10 min,蘇木素復染20 s,自來水洗5 min,鹽酸浸泡1 s,自來水洗5 min,室溫晾干,中性樹膠封片。
2 結 果
2.1 組織病理 正常1年齡大鼠中,僅少數胃部有輕度慢性炎性反應。膽汁反流1年后,13只大鼠腺胃部腺體增生非常顯著,大多數同時伴有腺體顯著擴張;長期膽汁反流導致3只大鼠腺體發生異型增生,其中1只出現癌變;膽汁反流大鼠中糜爛和潰瘍少見,僅見于3只和1只大鼠。與此類似,腸化生極少見,僅見于1只大鼠(圖1)。膽汁反流1年后,13只大鼠前胃部鱗狀上皮顯著增生,并伴有明顯角化,其中7只大鼠在黏膜下層形成巨大的角化珠,更有3只大鼠形成角化囊腫;與腺胃部類似,前胃部腸化生極少見,僅見于1只大鼠;所有膽汁反流大鼠前胃均未見到糜爛或潰瘍(圖2)。
2.2 免疫組化 正常大鼠胃泌素陽性染色細胞主要分布于腺胃胃竇部上皮內,并且數量較少。膽汁反流1年后,腺胃胃竇部上皮內胃泌素陽性染色細胞顯著增生,呈聚集性存在,腺胃胃體部上皮內亦可見胃泌素陽性染色細胞增生(圖3)。
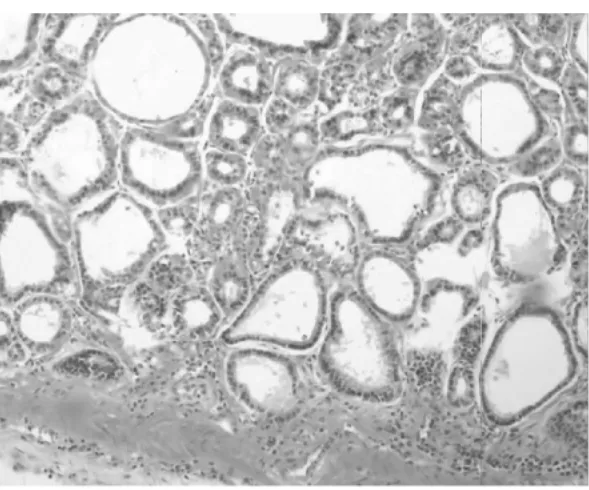
圖1-1 腺胃腺體增生、擴張

圖1-2 腺胃腺體異型增生

圖1-3 腺胃腺體癌變
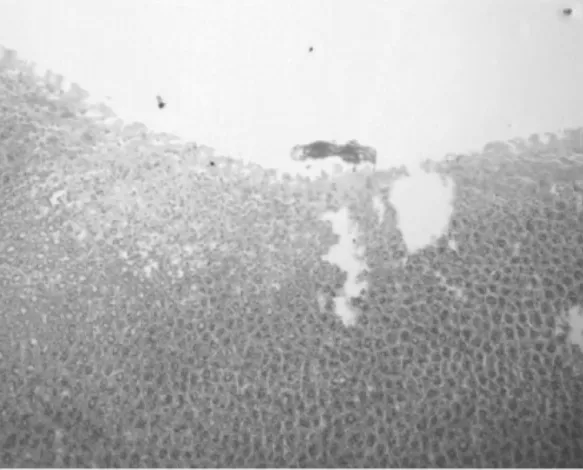
圖1-4 腺胃黏膜糜爛

圖1-5 腺胃潰瘍
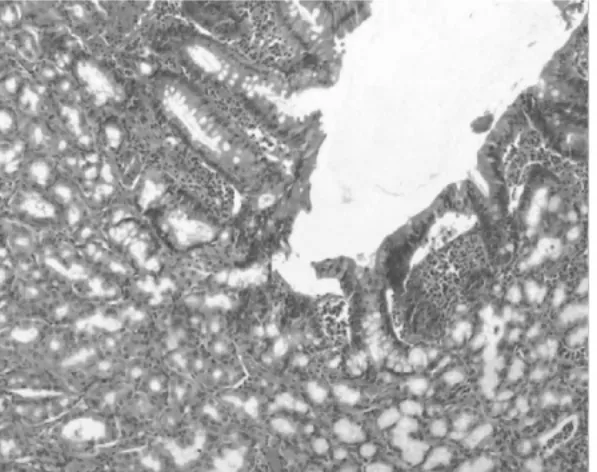
圖1-6 腺胃腺體腸化生
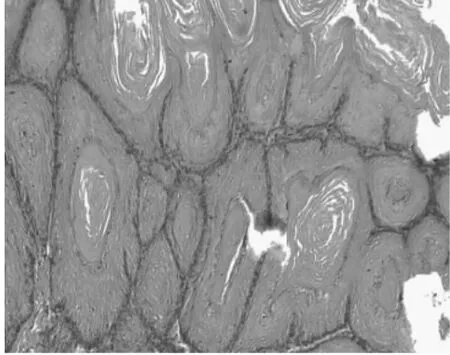
圖2-1 前胃鱗狀上皮
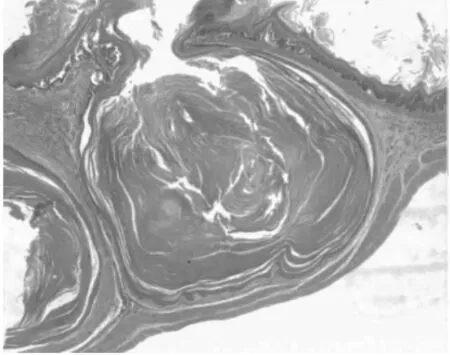
圖2-2 前胃鱗狀上皮角化珠
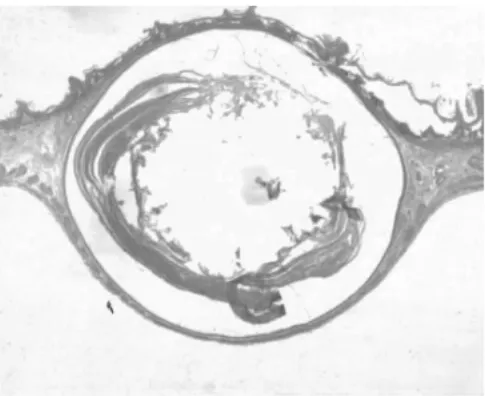
圖2-3 前胃角化囊腫增生、角化

圖2-4 前胃鱗狀上皮腸化生

圖3-1 正常大鼠胃竇胃泌素陽性染色細胞呈單個存在

圖3-2 正常大鼠胃體亦有少量胃泌素陽性染色細胞

圖3-3 長期膽汁反流大鼠胃竇胃泌素陽性染色細胞增生伴腺體增生
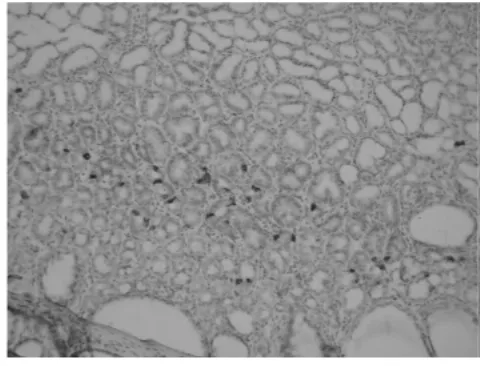
圖3-4 膽汁反流大鼠胃體胃泌素陽性染色細胞增生伴腺體增生、擴張
3 討 論
大鼠的胃由近端的前胃和遠端的腺胃組成,前胃黏膜被覆鱗狀上皮,與食管相似,腺胃類似于人胃,分為胃體和胃竇。本模型根據Kaminishi等[5]建立的模型而改進,使膽汁通過幽門反流入腺胃,經位于前胃的胃-空腸吻合口流入空腸,整個腺胃保持完整,故類似于人體生理性膽汁反流途徑,不僅便于觀察膽汁反流對腺胃黏膜的影響,還可觀察其對前胃鱗狀上皮的影響。
本研究發現,長期膽汁反流導致大鼠腺胃胃體和胃竇小凹上皮增生,與1994年休斯頓會議對反應性胃炎(reactive gastritis,RG)的描述一致[6]。所有大鼠腺胃腺體增生,并呈囊狀擴張,與Taylor等[7]和 Mukaisho等[8]的發現一致,提示胃腺體增生、擴張是膽汁反流性胃炎的特征。本模型僅發現1例腺胃癌變,這可能是由于本模型中腺胃是完整的,類似于生理性膽汁反流;而其他模型均將腺胃與空腸吻合,類似于Billroth II手術,膽汁反流強度可能高于生理性反流,因此胃癌發生率高。臨床中發現,兩種不同類型上皮的交界處易發生腫瘤。在其他模型中,胃癌多發生于腺胃-空腸吻合口周圍。有研究者認為,腸化生是胃黏膜的一種適應性改變,當胃黏膜的局部微環境變為類似于腸內環境時,胃黏膜便出現腸化生,以此來減堿性腸液對黏膜的損傷。將帶血管蒂的大鼠胃壁瓣分別移植到腸壁上,移植黏膜發生典型的腸化生,pH測定發現移植黏膜的pH>6,顯著高于胃內(一般pH<4.5)。在腺胃-空腸吻合口周圍,膽汁反流強度可能要高于本模型,造成局部黏膜微環境的pH顯著升高,因此腸化生發生率較高。本模型中鱗狀上皮顯著增生,呈乳頭狀凸起,上皮增生形成角化珠和角化囊腫。本模型盡管膽汁反流長達1年,卻僅有1例腸化生,更無腺癌發生。此差異可能與手術方式不同有關。
膽汁反流可導致高胃泌素血癥,并通過抑制生長抑素的釋放、降低血清生長抑素的水平進一步加重高胃泌素血癥;高胃泌素血癥又會加重膽汁反流。患者行膽囊切除后6個月,其胃竇黏膜G細胞的數量即有增加,并存在顯著的膽汁反流性胃炎和小凹上皮增生,這提示膽汁反流可導致G細胞增生,并引起高胃泌素血癥。通過免疫組化方法,我們發現本模型中腺胃胃竇和胃體G細胞顯著增生。膽囊收縮素-2(cholecystokinin,CCK-2)受體是胃泌素的特異性受體,主要表達于壁細胞和ECL細胞。我們推測膽汁反流導致G細胞增生,引起高胃泌素血癥,在循環胃泌素的作用下,壁細胞上的CCK-2受體被激活并分泌HB-EGF和雙調蛋白等生長因子,促進胃上皮增殖,進一步導致異型增生和癌變。
綜上所述,我們通過建立模擬人體生理性膽汁反流的大鼠模型發現,長期膽汁反流能導致腺胃腺體增生并發生異型增生和癌變,前胃鱗狀上皮亦顯著增生,這可能與長期膽汁反流所致的腺胃G細胞增生和高胃泌素血癥有關。
[1] Fein M,Freys SM,Sailer M,et al.Gastric bilirubin monitoring to assess duodenogastric reflux[J].Dig Dis Sci,2002,47(12):2769-2774.
[2] Dixon MF,Mapstone NP,Neville PM,et al.Bile reflux gastritis and intestinal metaplasia at the cardia[J].Gut,2002,51(3):351-355.
[3] Oberg S,Peters JH,DeMeester TR,et al.Determinants of intestinal metaplasia within the columnar-lined esophagus[J].Arch Surg,2000,135(6):651-655.
[4] O′riordan JM,Tucker ON,Byrne PJ,et al.Factors influencing the development of Barrett's epithelium in the esophageal remnant postesophagectomy[J].Am J Gastroenterol,2004,99(2):205-211.
[5] Kaminishi M,Sadatsuki H,Johjima Y,et al.A new model for production of chronic gastric ulcer by duodenogastric reflux in rats[J].Gastroenterology,1987,92(6):1913-1918.
[6] Dixon MF,Genta RM,Yardley JH,et al.Classification and grading of gastritis.The updated Sydney system[J].The A-merican Journal of Surgical Pathology,1996,20(10):1161-1181.
[7] Taylor PR,Mason RC,Filipe MI,et al.Gastric carcinogenesis in the rat induced by duodenogastric reflux without carcinogens:morphology,mucin histochemistry,polyamine metabolism,and labelling index[J].Gut,1991,32(12):1447-1454.
[8] Mukaisho K,Miwa K,Kumagai H,et al.Gastric carcinogenesis by duodenal reflux through gut regenerative cell lineage[J].Dig Dis Sci,2003,48(11):2153-2158.

