基因芯片分析IFRD1表達沉默后肝癌細胞周期相關基因表達的變化
胡 衛,方肇勤,梁 超,管冬元,吳中華
(1.三峽大學醫學院,湖北 宜昌 443002;2.上海中醫藥大學基礎醫學院,上海 201203)
IFRD1(interferon-related developmental regulator 1,干擾素相關發育調節因子1)基因位于人染色體7q22~q31,含12個外顯子,核酸長度2604kb,該基因編碼的蛋白質由453個氨基酸組成。已有資料表明,IFRD1在多種細胞中表達,尤其在組織增生或再生中顯著表達,提示該基因可能具有促進組織增生的作用[1~3]。由于 IFRD1基因在上皮細胞、成肌細胞、造血細胞、神經細胞等多種組織和細胞分化中均扮演一定的角色[4~6],推測其可能是一個核蛋白,具有轉錄調控作用。我們前期研究發現,該基因在DEN誘發大鼠肝癌組織中表達升高,經 RNA干擾實驗證實,該基因與肝癌細胞SMMC-7721的惡性增殖有關[7]。為進一步探討其在肝癌發生發展中的作用及機制,我們采用基因芯片檢測了該基因表達下調后人肝癌細胞基因表達譜的改變,本文重點關注細胞周期通路相關基因的變化。
1 材料
1.1 細胞株
人肝癌SMMC-7721細胞,購自中科院上海細胞生物所。
1.2 主要試劑和耗材
細胞培養耗材均為corning公司產品,主要試劑有 Trizol(GIBCO BRC)、RNeasy Mini Kit(QIAGEN)、脂質體lipo2000(Invitrogen);實時熒光定量PCR試劑盒(TAKARA,SYBR Premix Ex Taq:Perfect Real Time)、人類表達譜芯片(Affymetrix U133 Plus 2.0 array)、轉染載體(pSilencerTm2.1-U6 neo質粒)和BamH I與Hind III限制性內切酶均為Ambion公司產品。
1.3 主要儀器
實時熒光定量PCR儀為GENE公司的Rotor-Gene 3000;酶標儀為 BIO-TEK公司的 ELX8001.3儀器。Agilent-bioanalizer 2100以及 Affymetrix的芯片雜交爐、芯片洗滌系統、芯片掃描儀等。
2 方法
2.1 人肝癌細胞SMMC-7721的培養及脂質體轉染
肝癌細胞常規培養,轉染前1d取生長對數期的細胞,消化后離心收集細胞并計數,重新用含血清不含抗生素的培養液稀釋細胞并分別等量加入新的培養皿中。實驗分為正常組(SMMC-7721細胞)、G418組(SMMC-7721細胞 +G418)、陰性組(SMMC-7721細胞+G418+陰性載體對照)、RNAi組(SMMC 7721細胞+G418+IFRD1基因 shRNA)。細胞鋪皿后20h以內進行脂質體轉染,10cm培養皿每皿需15ml培養液 +2×1.5ml轉染培養液(含 24.0 μg質粒DNA+60 μL脂質體)。轉染后第2天換成 G418培養液。-
2.2 實時熒光PCR檢測干擾效率
脂質體轉染后第6天,收集各組細胞 Trizol法提取總 RNA。各實驗組取2μg總 RNA進行反轉錄,再以反轉錄產物為模板,以GAPDH為內參做相對表達量分析,實時熒光PCR檢測干擾效率。IFRD1基因干擾效率的檢測引物為:上游GCC CTG GAA TTG AAA GTG AA,下游 TGG GCA TAT GGT CAG CAG TA,擴增產物長度為299bp。GAPDH內參基因的引物分別為:上游 GAG TCA ACG GAT TTG GTC GT,下游 TTG ATT TTG GAG GGA TCT CG,擴增產物長度為238bp。
擴增反應體系(共計 25μL)為:消毒雙蒸水9.5μL,SYBR Premix Ex Taq(2 × )12.5μL.上、下游引物(各 5μmol/L)2μL.RT產物 1μL擴增反應條件:95℃ ×30s;95℃ ×5s,60℃ ×30s,40 個循環。結果采用△△CT法加以分析。
2.3 基因芯片檢測
Trizol法抽提總 RNA后,采用 RNeasy Mini Kit試劑盒純化RNA,然后將純化的RNA樣品送至上海生物芯片有限公司進行 RNA質量鑒定(毛細管電泳)及其后續的人基因組表達譜檢測(芯片型號U133 plus 2.0 array,合同號為 CB2009559)。
2.4 芯片數據分析
芯片數據分析方法,在參考Affymetrix genechip網站的技術手冊基礎上,充分利用上海生物芯片有限公司在線的SBC分析系統進行芯片數據處理與分析。
篩選芯片數據中細胞周期通路相關基因,找出表達量變化在1.1倍及以上的基因(上調1.1或下調0.91),并用GenMAPP軟件分析對照組與干擾組各基因的比值,以不同顏色標示其上調和下調的倍數:比值 >=1.5(紅色),>=1.2(粉紅),>=1.1(玫瑰紅);比值 <=0.67(藍色),<=0.83(淡藍色),< =0.91(灰色)。
3 結果
3.1 IFRD1基因的干擾效率
實時熒光PCR檢測發現,IFRD1干擾組目的基因的表達量下降,相對表達量陰性組為3.97,RNAi組為 2.53(圖1、圖 2)。
3.2 各組細胞總RNA質檢及轉錄特征
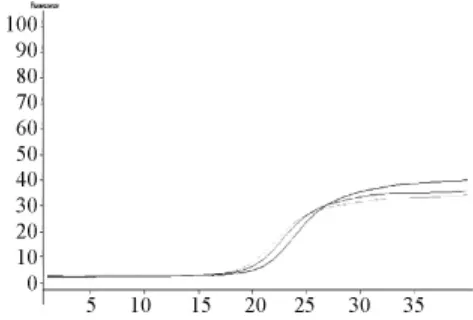
圖1 IFRD1擴增曲線圖
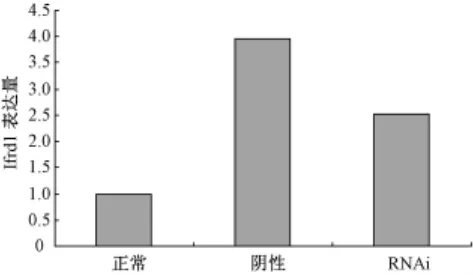
圖2 RNAi后各組IFRD1表達量
由RNA質檢結果(表1和圖3~圖7)可以看出,基準峰后18S和28S峰清楚,中間無雜帶污染,說明各組細胞抽提的RNA沒有出現降解現象。
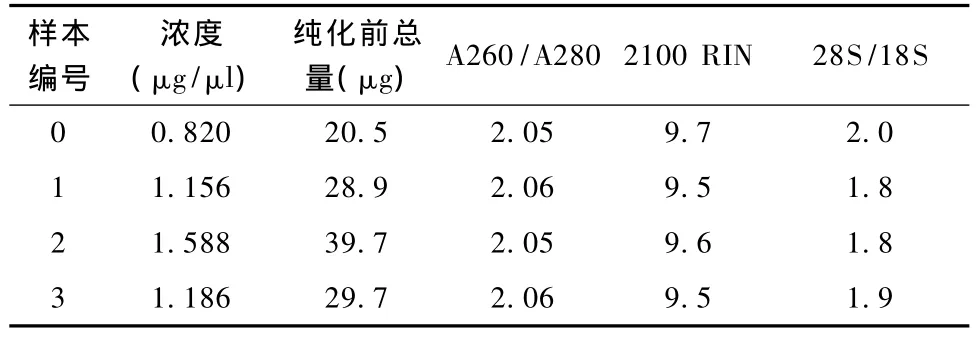
表1 RNA質量檢測結果
圖3 RNA ladder電泳結果
圖4 正常組RNA電泳結果
圖5 G418組RNA電泳結果
圖6 陰性組RNA電泳結果
圖7 RNAi組RNA電泳結果
3.3 芯片結果
3.3.1 干擾基因的表達 在數據表中,找到IFRD1基因2個對應轉錄本,其RNAi實驗組與陰性對照組的比值分別為0.71(1555/2178)與0.69(4434/6427),與前面PCR檢測結果近似,提示該基因經RNAi后,發生了部分降解,出現表達后沉默現象。
3.3.2 細胞周期通路基因改變 (1)周期蛋白、CDK、CKI表達變化。在真核細胞內,細胞周期主要由周期蛋白(cyclin)-周期蛋白依賴性激酶(cyclin-dependent kinase,CDK)-周期蛋白依賴性激酶抑制因子(cyclin-dependent kinase inhibitor,CKI)三者形成的1個精密的調控網絡進行監督調控。在細胞周期中,細胞周期蛋白 cyclins是CDK的正向調節因子,CKI為CDK的負向調節因子。表2和圖8顯示,IFRD1干擾后,細胞周期蛋白cyclin和CDK表達以上調為主,而抑制因子 CKI以下調為主,表明細胞處于生長期;(2)S期DNA合成相關基因表達變化。表3圖8顯示,在 S期染色體 DNA復制前,要求G1期染色體處于復制前感受狀態,該狀態需要前復制復合物(PLC)結合在復制起點上。PLC由DNA復制起點識別復合體(ORC)、微型染色體維持蛋白復合物(MCM)以及CDC6和CDC45組成。這種處于復制前狀態的染色體必須在特定的CDK-cyclin作用下才能啟動DNA復制。ORC由ORC1L、ORC2L、ORC3L、ORC4L、ORC5L、ORC6L 6 個亞基構成,均參與 DNA 復制,其中亞基 1、2、4、5在復制啟動中發揮重要的功效。微型染色體維持蛋白基因家族由 MCM2、MCM3、MCM 4、MCM 5、MCM 6、MCM 7組成蛋白復合體,均參與DNA復制、復制啟動及轉錄調控等環節。IFRD1干擾后,MCM蛋白復合體以下調為主,ORC表達均下調,而 CDC6和 CDC45表達也下調,提示 RNAi組細胞 S期 DNA合成不活躍,染色體復制受阻;(3)細胞周期其他相關分子的變化。表4圖8顯示,從芯片結果可以看出,G1/S期檢測點 p21、p57表達均下調,說明 G1/S期轉化順利;G2-M期檢測點關鍵基因如MAD2L1、MAD2L2和BUB3等表達均上調,提示細胞有絲分裂受阻,細胞不能順利從G2期進入M期分裂增殖;一些抑制細胞增殖因素如 TP53、MDM2表達均上調,亦提示細胞分裂增殖不活躍。
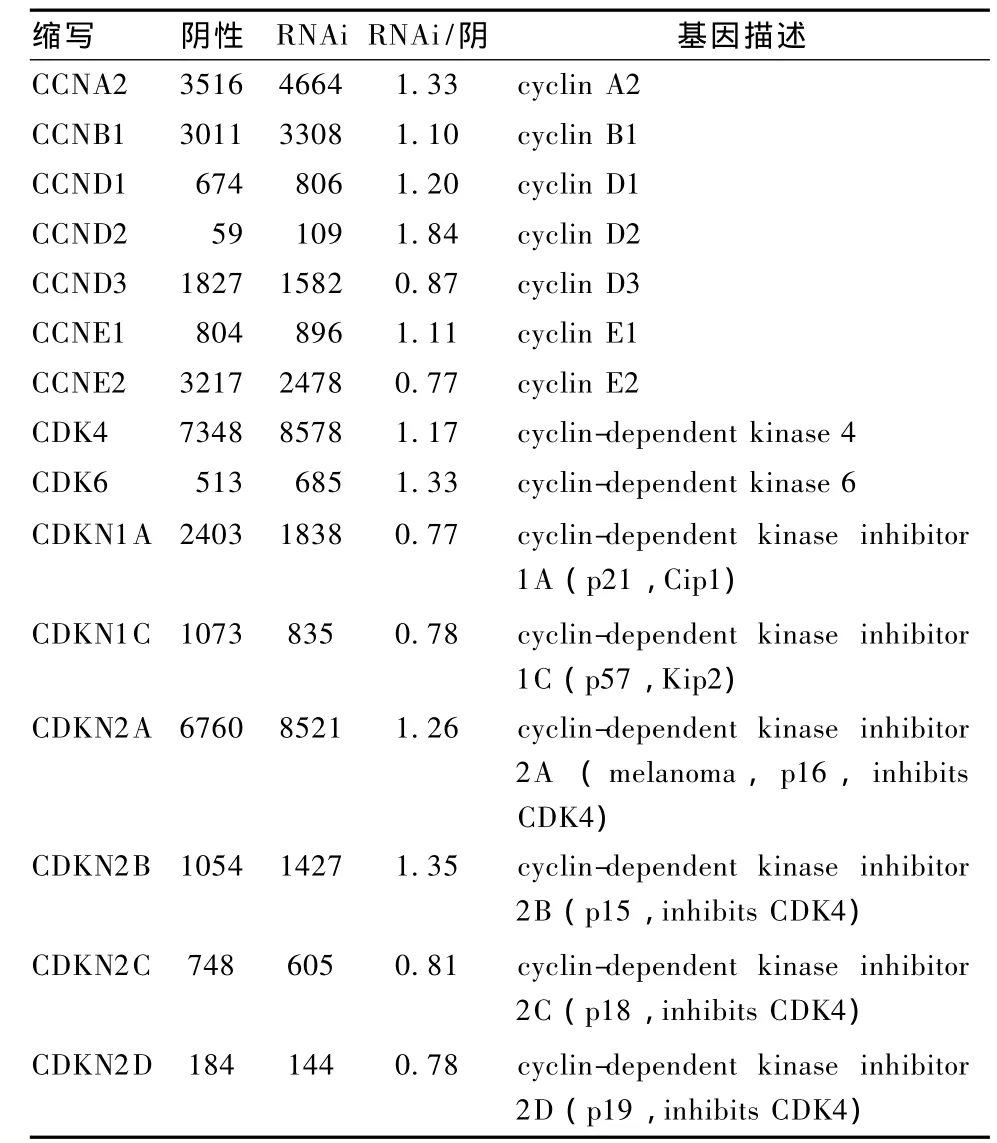
表2 IFRD1 RNAi后細胞周期通路CDK及相關分子表達
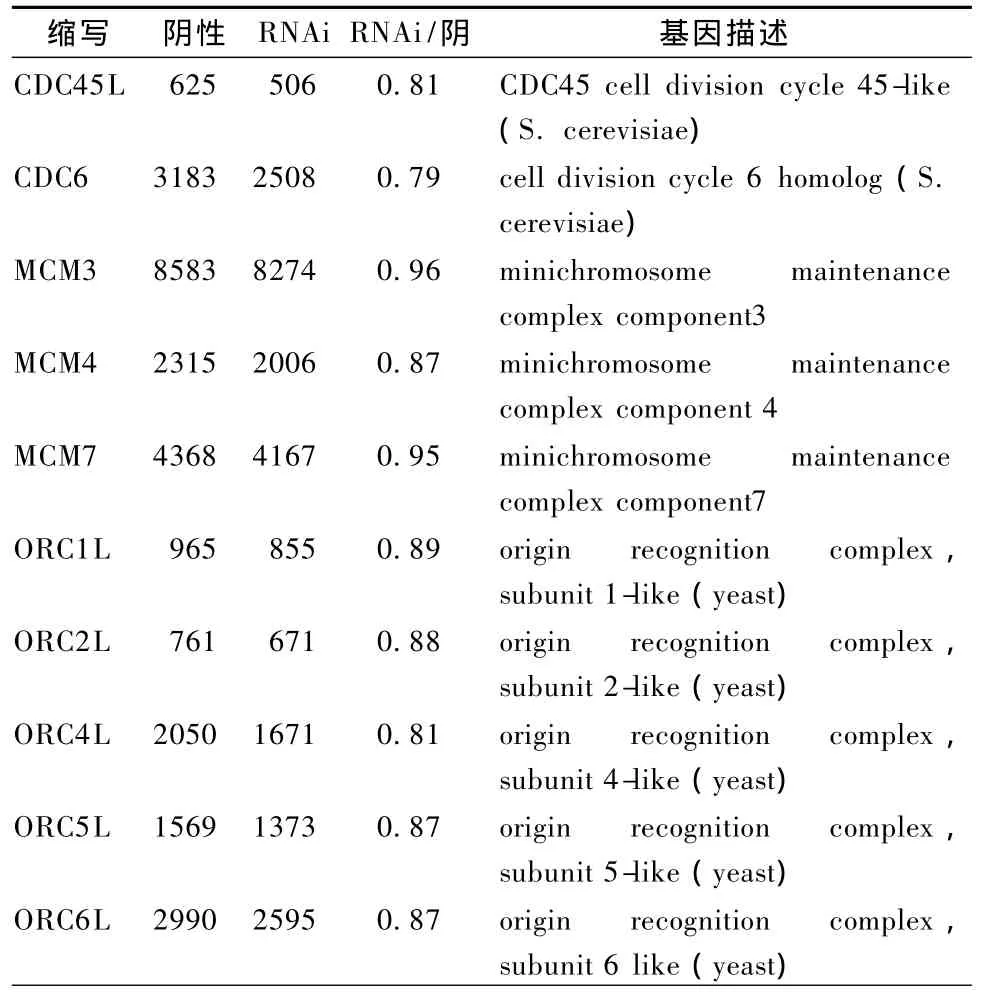
表3 IFRD1 RNAi后細胞周期通路S期DNA合成相關基因表達變化
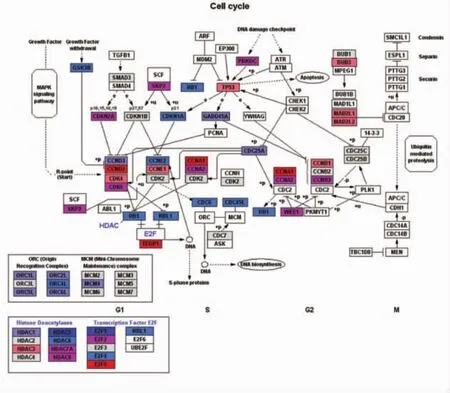
圖8 細胞周期基因表達量變化
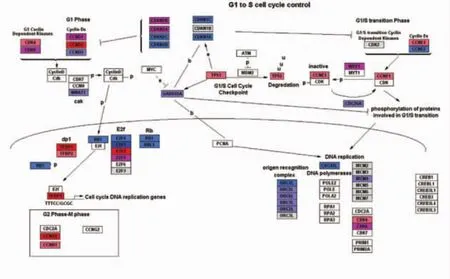
圖9 G1-S基因表達量變化
4 討論
基因芯片技術因其可以同步開展成千上萬個基因表達的檢測,形成較為完整的細胞基因表達譜,具有高通量、高速度、平行化等優點,成為目前研究基因表達的最有力的工具之一。近年來,該技術在中醫藥防治腫瘤的研究中得到了廣泛的應用[8]。本研究在RNA干擾下調 IFRD1基因表達水平后,采用人類表達譜芯片檢測該基因在肝癌細胞中表達降低后引起肝癌細胞基因表達譜的變化,以期闡明其影響肝癌發生發展的機制。
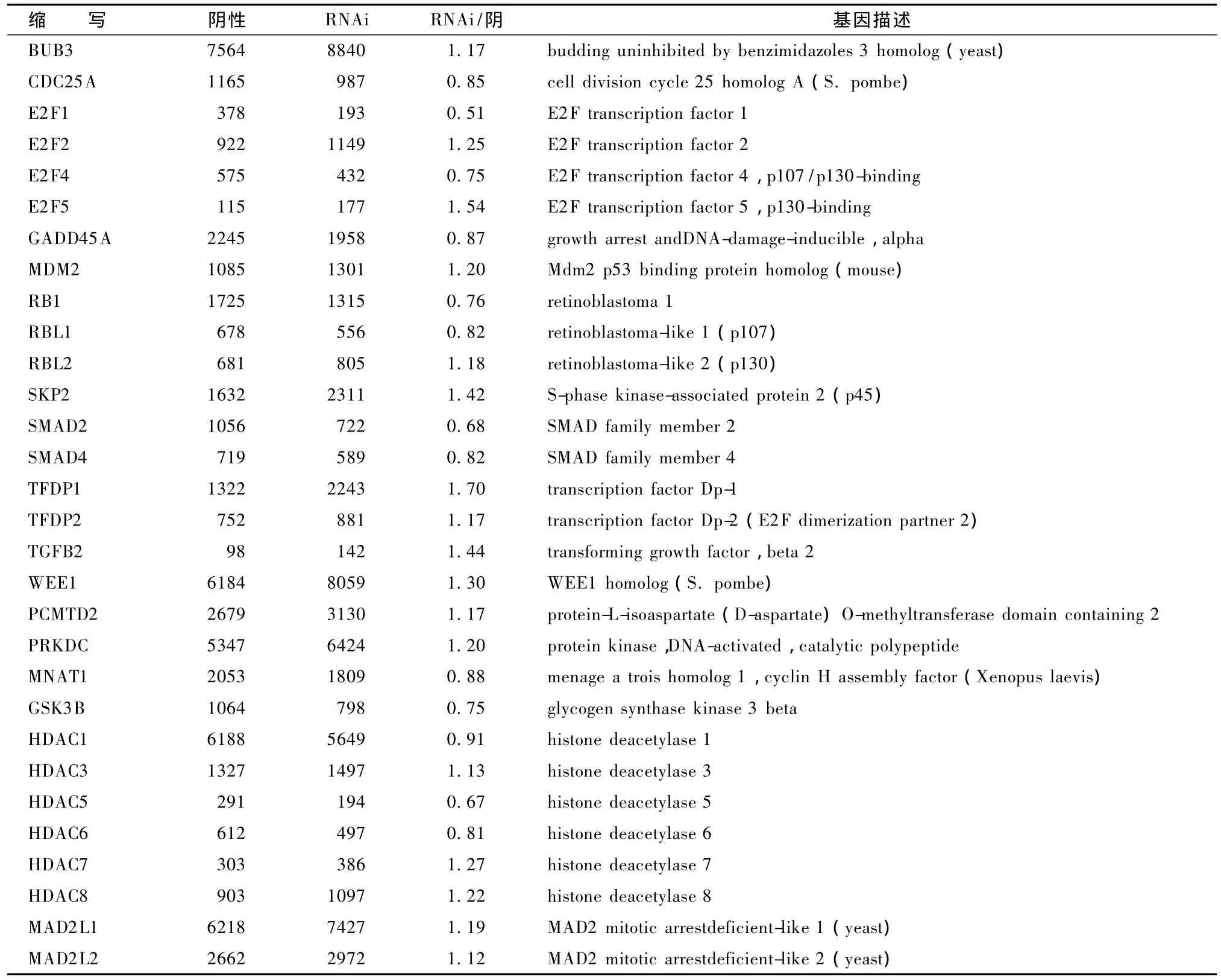
表4 IFRD1 RNAi后細胞周期通路其它基因的變化
“細胞周期”也稱“細胞分裂周期”,是指一個細胞經生長、分裂而增殖成2個細胞的全過程,依次分為G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)和 M期(有絲分裂期)。細胞周期的準確調控對生物的生存、繁殖、發育和遺傳十分重要。
本研究發現,IFRD1干擾后引起大量基因的變化。芯片結果顯示,細胞周期蛋白和CDK表達上調為主,CKI表達下調為主,提示細胞周期比較活躍;G1/S期檢測點p21、p57表達均下調,表明 G1-S期轉換順利;但S期DNA合成相關基因以下調為主,提示S期 DNA合成受到抑制,有絲分裂檢測點受阻,最終導致細胞增殖分裂受限。這可能是IFRD1基因RNA干擾后導致人肝癌細胞增殖變緩的機制。
[1]Swietlicki E,Iordanov H,Fritsch C,Yi L,Levin MS,Rubin DC.Growth factor regulation of PC4/TIS7,an immediate early gene expressed during gut adaptation after resection[J].JPEN J Parenter Enteral Nutr,2003,27(2):123-131.
[2]Han H,Hansen TR,Berg B,Hess BW,Ford SP.Maternal undernutrition induces differential cardiac gene expression in pulmonary hypertensive steers at high elevation[J]. Am J Physiol Heart Circ Physiol,2008,295(1):H382-389.
[3]Micheli L,Leonardi L,Conti F,Buanne P,Canu N,Caruso M,Tirone F.PC4 coactivatesMyoD by relieving the histone deacetylase 4-mediated inhibition of myocyte enhancer factor 2C[J].Mol Cell Biol,2005,25(6):2242-2259.
[4]Roth A,Gill R,Certa U.Temporal and spatial gene expression patterns after experimental stroke in a rat model and characterization of PC4,a potential regulator of transcription[J].Mol Cell Neurosci,2003,22(3):353-364.
[5]Vietor I,Huber LA.Role of TIS7 family of transcriptional regulators in differentiation and regeneration[J].Differentiation,2007,75(9):891-897.
[6]Vietor I,Vadivelu SK,Wick N,Hoffman R,Cotten M,Seiser C,Fialka I,Wunderlich W,Haase A,Korinkova G,Brosch G,Huber LA.TIS7 interacts with the mammalian SIN3 histone deacetylase complex in epithelial cells[J].EMBO J,2002,21(17):4621-4631.
[7]梁超,方肇勤,管冬元,等.RNAi檢測 IFRD1在肝癌增殖中的作用及不同中醫治法的調節[J].世界科學技術·中醫藥現代化,2010,12(5):723-729.
[8]胡衛,方肇勤.基因芯片技術在中醫藥防治腫瘤研究中的應用[J].上海中醫藥大學學報,2009,23(3):84-86.

