苦參提取物對茄子黃萎病菌的化感效應研究初報
賈利元 張淑紅 張恩平 周寶利
(1商丘職業技術學院,河南商丘 476005;2沈陽農業大學園藝學院,設施園藝省部共建教育部重點實驗室,遼寧沈陽 110866)
土壤致病菌是引起蔬菜減產的原因之一,連作導致土壤中茄子黃萎病菌的積累,從而引起茄子黃萎病的普遍發生。目前生產中尚無有效的方法來控制該病害的發生(Zhang et al.,2006;Zhou et al.,2007)。植物的化感作用在自然界普遍存在,近年來,國內外學者在植物化感作用方面做了大量研究工作(Muhsin et al.,2001;Chaudhary & Bhansali,2006),植物對微生物的化感作用備受關注。有些植物的殘體經微生物腐解釋放的化感物質,能夠抑制病原微生物的生長與繁殖(Aryaa et al.,1995;宋衛國 等,2005;Chaudhary & Bhansali,2006)。許多研究針對不同的病菌進行了植物材料的抑菌篩選,大量的研究表明,菊科、唇形科、百合科、葫蘆科、豆科、十字花科等植物的提取物具有廣泛的抑菌作用(李玉平 等,2003;陸志科和謝碧霞,2005;李麗娜 等,2006)。沈陽農業大學園藝學院茄子嫁接栽培與生態防治課題組針對茄子黃萎病菌,對54種植物提取物進行了抑菌篩選,結果表明苦參提取物對茄子黃萎病菌菌絲生長和孢子萌發具有較強的化感抑制作用,并提取了苦參的主要活性成分苦參生物堿和苦參黃酮類化合物(Zhang et al.,2006)。
從天然植物中提取抗菌活性物質的研究目前已有報道,但有關它們的抗菌機理的研究卻甚少。從現有的文獻資料來看,有的是直接作用于病菌,如抑制孢子萌發、菌絲生長,有的則是間接干擾病菌的代謝過程,影響其結構和功能等(Eksteen et al.,2001;Bowers & Locke,2002)。許多病菌在入侵植物細胞時產生各種降解多糖的胞外酶,通過酶分解植物細胞壁中的多糖物質,從而使完整的細胞崩潰,進而達到侵染的目的。近年來,國內外的研究主要集中在苦參提取物的抑菌活性上,而抑菌機理的研究甚為薄弱。為進一步探索苦參提取物對茄子黃萎病菌的抑制作用,本試驗在已有研究結果的基礎上,明確苦參提取物中起化感抑菌作用的主要活性成分是苦參生物堿和苦參黃酮類化合物,并通過這兩種成分對茄子黃萎病菌菌絲干質量、菌絲毒素含量與胞外酶活性的影響來分析其化感抑制作用機理,旨在為茄子黃萎病的防治奠定理論基礎。
1 材料與方法
1.1 試驗材料
苦參(Sophora flavescens,Ait)購于沈陽農業大學校醫院。
茄子黃萎病菌(VerticilliuMdahliae)從沈陽農業大學園藝學院蔬菜試驗基地病圃(日光溫室)的茄子病株上分離獲得,按照柯赫氏法則(Koch’s postulate)對其進行分離鑒定。
1.2 苦參活性成分的分離提取
提取:稱取苦參50 g,粉碎后按1V︰2V加入蒸餾水,并加入5 g根際土以接種微生物,在25 ℃恒溫培養箱中腐解15 d,加入80%乙醇(1V︰5V),超聲波(KQ-100DB型超聲波數控清洗器)振蕩30 min,4 000 r·min-1離心20 min,過濾,濾渣再用60%乙醇提取2次,合并濾液,濃縮后濃縮液放4 ℃冰箱中保存備用。
黃酮類化合物的分離提取:取上述濃縮液 20 ML,經石油醚脫酯后,加入等量乙酸乙酯萃取3次,合并萃取液,減壓濃縮,冷凍干燥后得到的黃色粉末即為苦參黃酮類化合物(崔永明等,2006)。
苦參總生物堿的分離提取:取上述濃縮液 20 ML,減壓蒸餾,除盡乙醇,膏狀物用乙酸乙酯溶解后,用2%鹽酸調pH為3,冰箱放置過夜,過濾,取濾液用乙醚反復萃取,棄去醚層,合并水層,用碳酸鈉調pH為9,用等體積的三氯甲烷萃取至無生物堿反應(用改良碘化鉍鉀試劑檢測,無桔黃色沉淀出現),合并三氯甲烷萃取液,旋轉蒸發回收三氯甲烷得到褐色生物堿(袁靜 等,2005)。
1.3 苦參提取物生物活性的測定
1.3.1 抑菌活性的測定 抑菌試驗:將上述分離得到的生物堿和黃酮類化合物溶解,分別配成母液,濃度為50 mg·mL-1。采用含毒介質法,將生物堿和黃酮類化合物母液分別與PDA培養基混合,配成含有不同濃度(0.25、0.50、1.00、2.00、4.00 mg·mL-1)生物堿和黃酮類化合物的培養基;然后在無菌條件下,每個培養皿接 1個活化培養的茄子黃萎病菌菌絲圓片(直徑為6 mm),每處理3次重復,以不含苦參提取物的PDA培養基作為對照(CK)。24 ℃下暗培養,8 d后用十字交叉法測定菌落直徑,并計算抑菌率。
菌絲干質量測定:將苦參提取物與馬鈴薯蔗糖液體培養基混合,配成含有不同濃度(1、5、10、20 mg·ML-1)苦參提取物的培養基,取80 ML裝入150 mL的三角瓶中,高壓滅菌。分別接入兩片直徑為6 mm的黃萎病菌菌盤,每處理3次重復。在24 ℃下恒溫振蕩(110 r·min-1)培養10 d后,用無菌濾紙過濾,半角濾紙上殘渣80 ℃烘干,得菌絲干質量。
1.3.2 黃萎病菌菌絲毒素含量的測定 將苦參提取物與馬鈴薯蔗糖液體培養基混合,配成含有不同濃度(1、5、10、20 mg·mL-1)苦參提取物的培養基,取80 ML裝入150 ML的三角瓶中,高壓滅菌。分別接入兩片直徑為6 mm的黃萎病菌菌盤,每處理3次重復。在24 ℃下恒溫振蕩(110 r·min-1)培養10 d后,用無菌濾紙過濾,濾液5 000 r·min-1離心20 min,取其上清液旋轉蒸發濃縮至4 mL,于OD=280 nm處測光密度值(趙明敏 等,2006)。
1.4 苦參提取物對黃萎病菌胞外酶活性的測定
酶液提取:將苦參提取物與PDA液體培養基混合配成含不同濃度(1、5、10、20 mg·ML-1)苦參提取物的培養基,取30 mL裝入150 ML的三角瓶中,高壓滅菌。分別接入兩片直徑為6 mm的黃萎病菌菌盤,每處理3次重復。在24 ℃下恒溫振蕩培養14 d后,用無菌濾紙過濾,所得濾液離心(常溫,110 r·min-1),其上清液為粗酶液。測定纖維素酶、半纖維素酶、果膠酶和蛋白酶活性的OD值(沈壽國 等,2005)。
1.5 數據處理
所有數據均采用SPSS11.5軟件進行差異顯著性分析。
2 結果與分析
2.1 苦參提取物對茄子黃萎病菌的抑菌作用
由表1可知,苦參黃酮類化合物在濃度為4.00 mg·ML-1培養7 d時對茄子黃萎病菌的抑菌率達 100.00%,濃度為 1.00 mg·mL-1培養 7 d時抑菌率大于 95%;而苦參生物堿濃度為 4.00 mg·mL-1培養7 d時的抑菌率為69.57%,與苦參黃酮類化合物在濃度為0.25 mg·ML-1培養7 d時的抑菌率相同,苦參生物堿在濃度為0.25 mg·mL-1培養7 d時的抑菌率僅為8.70%。苦參黃酮類化合物濃度大于1.00 mg·ML-1培養9 d時抑菌率在93%以上,培養12 d時的抑菌率還維持在90%左右,具有較強的抑菌效果。而苦參生物堿在濃度為4.00 mg·ML-1培養12 d時抑菌率達到了73.06%,但在低濃度(0.25 mg·ML-1)條件下的抑菌率還是較低,僅為14.08%。
由表2可知,不同濃度的苦參提取物對茄子黃萎病菌菌絲干質量產生不同的抑制作用,并且菌絲干質量隨苦參提取物濃度增加而逐漸降低。苦參提取物濃度為20 mg·mL-1時,菌絲干質量較低,為 0.138 g;苦參提取物濃度大于5 mg·ML-1時,菌絲干質量均與對照差異達顯著水平,提取物濃度為1 mg·ML-1時,菌絲干質量與對照差異不顯著。
2.2 菌絲毒素含量
毒素是病原物的代謝產物,對寄主組織有明顯的損傷作用,在植物病害發生、發展過程中具有明顯的致病或致毒作用。苦參提取物處理后,茄子黃萎病菌菌絲毒素含量隨著提取物濃度的增加呈降低的趨勢,各濃度處理菌絲毒素含量均與對照差異顯著。苦參提取物濃度為5 mg·ML-1和10 mg·ML-1處理的菌絲毒素含量差異不顯著(表2)。
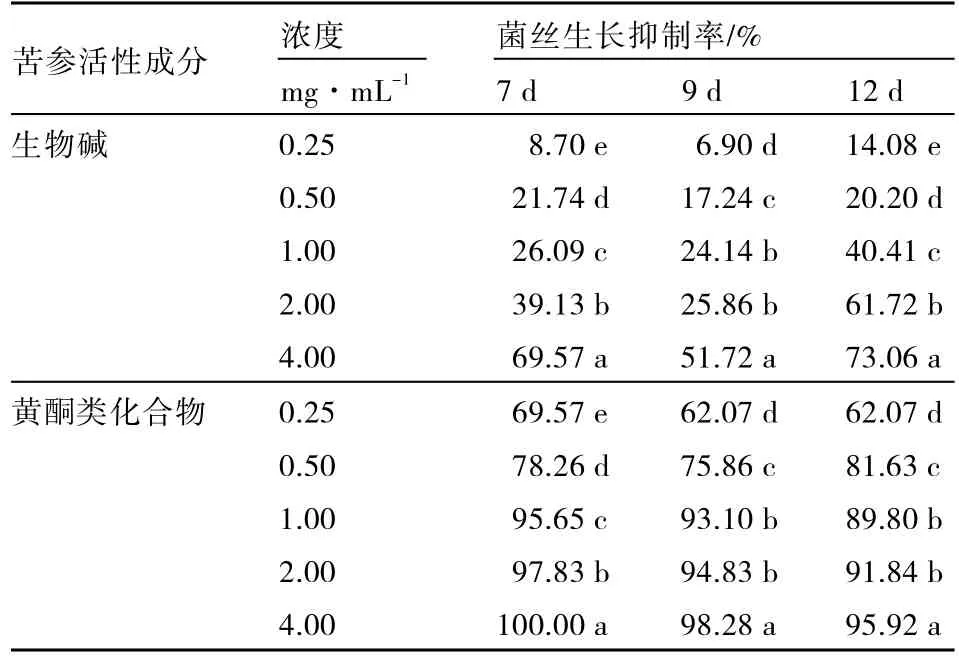
表1 苦參提取物對茄子黃萎病菌的抑菌作用
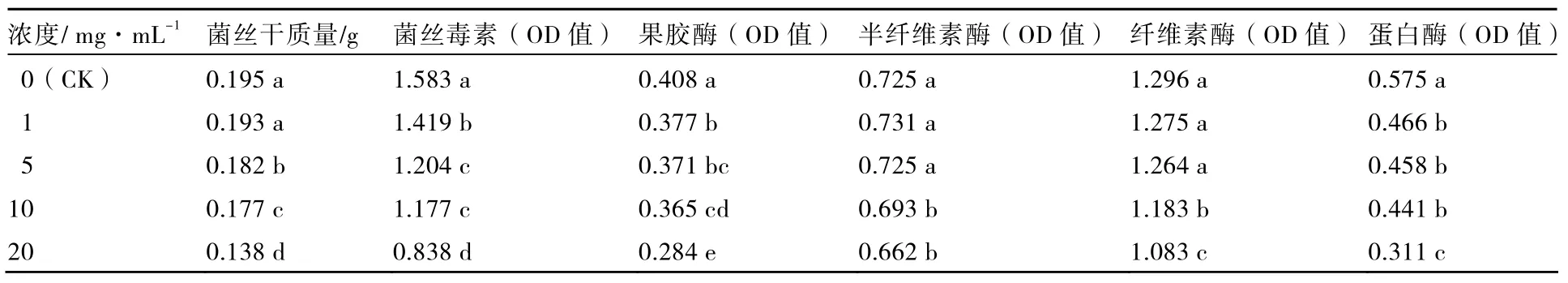
表2 苦參提取物對茄子黃萎病菌菌絲干質量及胞外酶活性的影響
2.3 胞外酶活性
4種胞外酶的活性均隨著苦參提取物處理濃度的增加而降低(表 2)。濃度為 20 mg·mL-1的處理果膠酶活性最低,與對照差異達顯著水平;而苦參提取物濃度為1、5 mg·ML-1及5、10 mg·ML-1處理間的果膠酶OD值差異不顯著。苦參提取物濃度為1、5 mg·ML-1的處理半纖維素酶OD值與對照差異不顯著,濃度為10、20 mg·ML-1的處理與對照差異達顯著水平。當苦參提取物濃度低于5 mg·mL-1時,纖維素酶OD值與對照差異不顯著。苦參提取物濃度為20 mg·mL-1時蛋白酶變化顯著,OD值最低,與對照差異達顯著水平,1、5、10 mg·mL-1處理間蛋白酶OD值差異不顯著。
3 結論與討論
植物與微生物之間存在著兩種化感作用,一種是促進作用,連作和輪作條件下茄子根系分泌物對茄子黃萎病病原菌有明顯的化感促進作用(Wang et al.,2005);一種是化感抑制作用,中國細香蔥根系分泌物可抑制假單胞菌引起的番茄枯萎病菌繁殖(Yu,1999)。如何利用化感作用的抑制效應進行病蟲害的生物防治已經成為研究熱點。
本試驗結果表明,對茄子黃萎病菌起化感作用的苦參主要活性成分是黃酮類化合物,濃度為4.00 mg·mL-1培養7 d對茄子黃萎病菌的抑菌率達100.00%,而苦參生物堿在濃度為0.25 mg·mL-1培養7 d的抑菌率僅為8.70%。當其他條件固定不變時,隨著苦參提取物濃度的提高,茄子黃萎病菌分泌的果膠酶活性隨之越低,纖維素酶和蛋白酶的活性均有降低趨勢,而半纖維素酶活性變化不明顯。本試驗僅針對苦參生物堿和黃酮類化合物進行了初步的抑菌試驗及抑菌機理的研究,在明確了起主要起抑菌作用的是黃酮類化合物的基礎上,后續的試驗應集中在黃酮類化合物的分離、田間抑菌效果及機理的研究。
崔永明,余龍江,敖明章,楊英,胡菁.2006.甘草總黃酮的提取技術及其抑菌活性研究.中藥材,29(8):838-840.
李麗娜,紀明山,李艷麗,楊春喜,宿宗艷.2006.4種植物提取物對植物病原菌的抑菌作用.農藥,45(1):61-63.
李玉平,馮俊濤,邵紅軍,祝木金,慕小倩,張興.2003.25種菊科植物提取物對3種植物病原菌的藥效試驗.西北農林科技大學學報,31(4):123-126.
陸志科,謝碧霞.2005.不同種竹葉的化學成分及其提取物抗菌活性的研究.西北林學院學報,20(1):49-52.
沈壽國,石志琦,徐朗萊,范永堅.2005.蛇床子素對小麥赤霉病菌葡萄糖鈣吸收和三磷酸腺酶活性的抑制.農藥學學報,7(2):135-139.
宋衛國,李寶聚,石延霞,劉開啟.2005.大蒜提取物抑制番茄灰霉菌活性測定.中國蔬菜,(8):21-22.
袁靜,關麗杰,叢斌,張宗儉,王力鐘.2005.苦參生物堿抑菌生物活性測定.農藥,44(2):86-89.
趙明敏,劉正坪,霍秀文.2006.利用病原真菌毒素離體篩選茄子抗黃萎病突變體的研究.華北農學報,21(1):92-95.
Aryaa T,Chunhanr H,Aryac S.1995.Effect of allicin and extracts of garlic and bignonia on two fungi.Indian Journal of Mycology and Plant Pathology,25(3):316-318.
Bowers J H,Locke J C.2002.Effect of botanical extracts in combination with biocontrol organisms on control of FusariuMwilt of muskmelon.Phytopathology,90:1142-1150.
Chaudhary B L,Bhansali E.2006.Allelpapthic effects ofLantana camaraL. extract on spore germaination ofPhyscomitriuMjaponicum(Hedw.)Mitt.Alleolpathy Journal,17:265-272.
Eksteen D,Pretorius J C,Nieuwoudt T D,Zietsman P C.2001.Mycelial growth inhibition of plant pathogenic fungi by extracts of south African plant species.Annals of Applied Biology,139:243-249.
Muhsin T M,Al-Zubaidy S R,Ali E T.2001.Effect of garlic bulb extract on the growth and enzymatic activities of rhizosphere and rhizop lane fungi.Mycopathologia,152:143-146.
Wang R H,Zhou B L,Zhang F L.2005.Allelopathic effects of root extracts on VerticilliuMwilt.Allelopathy Journal,15:75-84.
Zhou X,Zhou B L,Li Z W,Dong C F.2007.Inhibitory and preventive effects of plants extracts againstVerticilliuMdahliae.Alleolpathy Journal,20:145-156.
Zhang S H,Zhou B L,Zhang L,Fu Y W.2006.Inhibitory effects of natural plant extracts onVerticilliumalbo-atrum.Chinese Journal of Applied Ecology,17(6):1137-1140.
Yu J Q.1999.Allelopathic suppression of pseudomonas solanacearuMinfection of tomato(Lycopersicon esculentrm)in a tomato-Chinese chive(AlliuMtuberosum)intercropping system.Journal of CheMical Ecology,25:2409-2417.

