左旋西替利嗪二鹽酸鹽合成工藝的優(yōu)化
徐小軍,尤慶亮,趙蒙蒙,喻宗沅
(湖北省化學(xué)研究院,湖北 武漢 430074)
左旋西替利嗪二鹽酸鹽(Ⅵ)是一種高效、安全的抗過(guò)敏藥物,也是一種高選擇性外周H1受體拮抗劑,2001年2月首次在德國(guó)上市,在三大抗過(guò)敏藥物中最安全、適用范圍最廣,作用時(shí)間長(zhǎng)達(dá)24 h,起效劑量低,是FDA認(rèn)可的可以安全用于孕婦的抗過(guò)敏藥物。與西替利嗪二鹽酸鹽相比,具有無(wú)嗜睡、無(wú)鎮(zhèn)靜作用等突出優(yōu)點(diǎn)。
Corey等[1]以左旋4-氯二苯甲胺為原料,用N,N-二氯乙基-4-甲基苯磺酰胺構(gòu)建哌嗪環(huán),得到左旋1-N-單對(duì)氯二苯甲基-4-N-對(duì)甲苯磺酰基哌嗪,再與HBr/冰醋酸和苯酚反應(yīng),除去對(duì)甲苯磺酰保護(hù)基,得到高光學(xué)純度的左旋4-氯二苯甲基哌嗪,收率為59%,該方法需用大量的溶劑萃取以除去粗品中的苯酚衍生物。王玉玲等[2]優(yōu)化了反應(yīng)條件,以對(duì)羥基苯甲酸代替苯酚,到反應(yīng)終點(diǎn)時(shí),直接將反應(yīng)混合物傾入水中,經(jīng)過(guò)濾除去對(duì)羥基苯甲酸的衍生物,可得到高光學(xué)純度的左旋4-氯二苯甲基哌嗪,收率為62%;左旋4-氯二苯甲基哌嗪與2-(2′-氯乙氧基)乙酰胺反應(yīng)得到相應(yīng)的酰胺,再經(jīng)水解得到目標(biāo)化合物左旋西替利嗪。Rajan等[3]用N,N-二氯乙基-4-甲氧基苯磺酰胺代替N,N-二氯乙基-4-甲基苯磺酰胺,不需添加對(duì)羥基苯甲酸,形成哌嗪環(huán)后去保護(hù)基條件比較溫和,簡(jiǎn)化了操作程序,左旋4-氯二苯甲基哌嗪純度可達(dá)99%,產(chǎn)率84.2%。
作者參照文獻(xiàn)[2~5],以L-(+)-酒石酸為拆分劑對(duì)4-氯二苯甲胺(Ⅰ)進(jìn)行拆分,制得左旋4-氯二苯甲胺(Ⅱ);再參照文獻(xiàn)[3]的方法以N,N-二氯乙基-4-甲氧基苯磺酰胺與化合物Ⅱ反應(yīng),得到左旋4-氯二苯甲基哌嗪(Ⅳ);左旋4-氯二苯甲基哌嗪乙醇(Ⅴ)、左旋西替利嗪二鹽酸鹽(Ⅵ)的縮合和成鹽反應(yīng)參照文獻(xiàn)[2~7]進(jìn)行,其合成路線見(jiàn)圖1。

圖1 左旋西替利嗪二鹽酸鹽的合成路線
其中,N,N-二氯乙基-4-甲氧基苯磺酰胺的合成路線如下:

1 實(shí)驗(yàn)
1.1 試劑與儀器
集熱式磁力攪拌器;SHZ-D(Ⅲ)型循環(huán)水式真空泵;DZ-1BC型真空干燥箱;電子天平(精確度0.01 g);PTHW型電熱套;RE52CS型旋轉(zhuǎn)蒸發(fā)儀;Prostar230型高效液相色譜儀,美國(guó)Varian公司;254 nm紫外分光儀;核磁共振波譜儀,德國(guó)Bruker公司;SGWX-4型顯微熔點(diǎn)儀;NEXUS 470型傅立葉紅外分光光度儀,美國(guó)Nicolet公司;旋光儀,上海亞榮生化儀器廠。
1.2 方法
1.2.1 目標(biāo)化合物的合成
(1)左旋4-氯二苯甲胺(Ⅱ)的合成
取6.4 g(0.043 mol)L-(+)-酒石酸溶于30 mL水中,攪拌下加入9.0 g(0.041 mol)混旋4-氯二苯甲胺鹽酸鹽(NaOH中和去除鹽酸),攪拌加熱至全溶后冷至常溫,有白色固體析出,抽濾,水洗;在濾餅中加入90 mL水、2.5 g活性炭,加熱攪拌回流1 h,冷至80 ℃,過(guò)濾,濾液冷卻至室溫,抽濾;濾餅再用水重結(jié)晶,抽濾,轉(zhuǎn)入燒瓶,加30 mL水?dāng)嚢璩蓾{狀,冷卻下滴加5 mL 30% NaOH水溶液,繼續(xù)攪拌約2 h;轉(zhuǎn)入分液漏斗中;用30 mL石油醚萃取3次,油層用飽和食鹽水洗滌后加無(wú)水Na2SO4干燥過(guò)夜,濾去Na2SO4,蒸出石油醚,即得化合物Ⅱ。
(2)左旋[4-(-氯苯基)苯甲基]-4-[(4-苯甲氧基)磺酰]哌嗪(Ⅲ)的合成
取30.0 gN,N-二異丙胺、13.0 gN,N-二氯乙基-4-甲氧基苯磺酰胺、8.1 g化合物Ⅱ置于500 mL燒瓶中,升溫至127 ℃,回流10 h,反應(yīng)完畢,降溫至80~90 ℃,加入30 mL甲醇,再降溫至0~5 ℃,繼續(xù)攪拌30~60 min,抽濾,濾餅用10 mL甲醇洗滌,將甲醇蒸去一半后冷卻結(jié)晶,50~60 ℃真空干燥,即得化合物Ⅲ。
隨著高校教育事業(yè)的迅速發(fā)展,高校畢業(yè)生每年都在不斷增長(zhǎng),高校培養(yǎng)出的優(yōu)秀畢業(yè)生正在走向社會(huì),越來(lái)越多的高校教師順應(yīng)市場(chǎng)的需求也出現(xiàn)人才流動(dòng),教師在工作中取得的科研成果也正在被轉(zhuǎn)化成產(chǎn)能應(yīng)用到社會(huì)的各個(gè)領(lǐng)域。高校檔案館在這場(chǎng)變革中應(yīng)該積極發(fā)揮檔案館的作用,不能停留在傳統(tǒng)的服務(wù)功能上,而要提升創(chuàng)新服務(wù)的能力,不斷滿足師生對(duì)高校檔案資源的新需求,實(shí)現(xiàn)高校檔案館更高的服務(wù)價(jià)值。
(3)左旋4-氯二苯甲基哌嗪(Ⅳ)的合成
將10.0 g化合物Ⅲ緩慢地加到飽和HCl的冰醋酸中,加熱至70~75 ℃,反應(yīng)3 h后,冷至25~35 ℃,加水52 g,攪拌15~20 min,反應(yīng)混合物用甲苯(2×30 mL)洗滌,將水層冷卻至0~5 ℃,用40%的NaOH溶液調(diào)水層pH值至11~12,用甲苯(2×30 mL)萃取有機(jī)層,用純凈水洗滌,濃縮,濃縮物加入50 mL水,于25~35 ℃下攪拌2~4 h,抽濾,濾餅再用少量水洗滌,于30~35 ℃下真空干燥,即得化合物Ⅳ。
(4)左旋4-氯二苯甲基哌嗪乙醇(Ⅴ)的合成
取14.3 g(0.050 mol)化合物Ⅳ、70 mL干燥的甲苯、6 mL(0.089 mol)氯乙醇、15 mL三乙胺加入到250 mL燒瓶中,加熱攪拌回流12 h,降至室溫,抽濾,用少量甲苯洗滌,再依次用稀鹽酸(2×40 mL)、飽和食鹽水(3×40 mL)、水(2×40 mL)洗滌,有機(jī)層加無(wú)水Na2SO4干燥過(guò)夜,濾去Na2SO4,蒸去甲苯,即得化合物Ⅴ。
(5)左旋西替利嗪二鹽酸鹽(Ⅵ)的合成
取70 mL經(jīng)干燥處理的叔丁醇加入到150 mL三口燒瓶中,加入8.0 g(0.051 mol)叔丁醇鉀,攪拌讓其完全反應(yīng)形成均勻溶液,加入9.5 g(0.028 mol)化合物Ⅴ,加熱攪拌回流1 h;然后加入3.5 g(0.029 mol)氯乙酸鈉,回流2 h,再加入1.8 g(0.019 mol)氯乙酸鈉;1 h后再加入0.90 g(0.009 mol)氯乙酸鈉,反應(yīng)10 h;停止加熱,減壓蒸去叔丁醇;殘留物加100 mL水,于50 ℃攪拌數(shù)分鐘,加36%鹽酸約28 mL調(diào)pH值至10~12;用乙醚(3×30 mL)萃取,分出水相;加36%鹽酸約25 mL調(diào)pH值約為2~3;用二氯甲烷(2×30 mL)萃取,合并二氯甲烷層,用飽和食鹽水(2×30 mL)洗滌,無(wú)水Na2SO4干燥,濃縮,向殘留物中加入94 mL乙醇、1.4 g活性炭,加熱回流1.5 h,冷至室溫,過(guò)濾,減壓蒸去乙醇,得到微黃色透明粘稠油狀物約6.3 g,取33 mL36%鹽酸,攪拌使之溶解,減壓蒸干,得到微黃色固體,將其加入到68 mL丁酮中,攪拌加熱回流3 h,冷至室溫,抽濾,濾餅用丁酮(2×13 mL)洗滌,于50 ℃真空干燥4 h,得目標(biāo)化合物Ⅵ。
1.2.2N,N-二氯乙基-4-甲氧基苯磺酰胺的合成
N,N-二氯乙基-4-甲氧基苯磺酰胺無(wú)市售產(chǎn)品,因此,本實(shí)驗(yàn)以苯甲醚與氯磺酸合成了甲氧基苯磺酰氯,再與雙氯乙基胺鹽酸鹽反應(yīng)制備了N,N-二氯乙基-4-甲氧基苯磺酰胺,總收率67.4%。
(1)甲氧基苯磺酰氯的合成
取苯甲醚81 mL溶于300 mL CHCl3中,冰浴降至-8 ℃;取98 mL氯磺酸滴加到上述配好的溶液中,保持溶液溫度低于0 ℃,在0.5 h內(nèi)滴加完畢;移去冰浴,升溫至20 ℃左右,繼續(xù)攪拌約1 h后,倒入冰水中,用 150 mL氯仿萃取2次;減壓蒸去大部分氯仿,留少量液體冷凍結(jié)晶后抽濾,濾餅真空干燥,即得甲氧基苯磺酰氯。
(2)N,N-二氯乙基-4-甲氧基苯磺酰胺的合成
取雙氯乙基胺鹽酸鹽89.25 g(0.5 mol)、CH2Cl2650 mL、三乙胺145 mL,置于反應(yīng)瓶中;1 h內(nèi)將其慢慢滴加到300 mL含95 g甲氧基苯磺酰氯的CH2Cl2溶液中,滴加完畢,升溫至40~43 ℃,反應(yīng)6 h,蒸除溶劑,即得N,N-二氯乙基-4-甲氧基苯磺酰胺。
2 結(jié)果與討論
2.1 中間體及目標(biāo)化合物的結(jié)構(gòu)表征
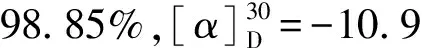
化合物Ⅲ:白色固體,16.8 g,收率85.2%。1HNMR(CDCl3,300 MHz),δ:2.47(t,4H,3位-CH2CH2-),3.01(t,4H,2位-CH2CH2-),3.92~4.22(m,3H,4位-OCH3),4.22(s,1H,1位),7.72~7.03(m,13H,ArH)。IR(KBr),ν,cm-1:3030(m,Ar的C-H),2968(m,C-H),1594、1493(m,Ar骨架),1452(s,N-CH2),1341(w,CH-),1262~1022(s,CH3O-),756(m,C-Cl)。
化合物Ⅳ:白色固體,5.8 g,收率88.5%,純度95.9%。1HNMR(CDCl3,300 MHz),δ:2.36(s,4H,2位-CH2CH2-),2.90(s,4H,3位-CH2CH2-),4.21(s,1H,1位),7.38~7.20(m,9H,ArH),1.609(水峰)。IR(KBr),ν,cm-1:3303(m,N-H),3067(m,Ar-H),2953~2749(m,CH2),1596、1486(s,Ar骨架),1181~1005(s,C-H面內(nèi)),841~695(w,C-H面外),750~715(m,Ar-H相鄰)。
化合物Ⅴ:淺黃色透明粘稠物,13.8 g,收率89%,純度99.3%(文獻(xiàn)值[3]:收率90.5%,純度97.8%)。1HNMR[8](CDCl3,300 MHz),δ:2.28~2.37(s,4H,2位-CH2CH2-),2.43(s,4H,3位-CH2CH2-),2.56(m,2H,4位),3.60(m,2H,5位),4.22(s,1H,1位),7.37~7.21(m,9H,ArH),1.609(水峰)。
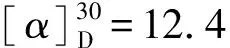
2.2 N,N-二氯乙基-4-甲氧基苯磺酰胺的結(jié)構(gòu)表征
甲氧基苯磺酰氯:白色固體,125.1 g,收率81.8%,m.p.39~42 ℃。
N,N-二氯乙基-4-甲氧基苯磺酰胺:微黃色固體,127 g,收率82.4%。1HNMR(CDCl3,300 MHz),δ:2.47(s,4H,5位-CH2CH2-),3.01(s,4H,4位-CH2CH2-),3.92~4.22(m,3H,3位-OCH3),7.72~7.06(m,4H,1,2位ArH-2,3,5,6)。IR(KBr),ν,cm-1:2968(m,C-H),1594、1493(Ar骨架),1452(m,N-CH2-),1341(s,C-N),1262~1022(m,CH3O-),833~656(C-H面外),756(m,Ar-H相鄰),756~620(m,C-Cl)。
3 結(jié)論
以混旋4-氯二苯甲胺為原料,經(jīng)化學(xué)拆分制得左旋4-氯二苯甲胺(Ⅱ),進(jìn)而制備左旋4-氯二苯甲基哌嗪(Ⅳ)、左旋4-氯二苯甲基哌嗪乙醇(Ⅴ)和目標(biāo)化合物左旋西替利嗪二鹽酸鹽(Ⅵ),并對(duì)中間體及目標(biāo)化合物進(jìn)行了結(jié)構(gòu)表征。結(jié)果表明,化合物Ⅱ收率為33.2%,純度為98.85%;化合物Ⅳ收率為88.5%,純度為95.9%;化合物Ⅴ收率為89%,純度為99.3%;化合物Ⅵ收率為73.5%,純度為99.1%;總收率為19.08%。其中,采用N,N-二氯乙基-4-甲氧基苯磺酰胺與化合物Ⅱ反應(yīng),形成哌嗪環(huán)后去保護(hù)基所生成的化合物Ⅳ收率高、純度好。該方法具有操作簡(jiǎn)便、反應(yīng)條件溫和、反應(yīng)時(shí)間短、對(duì)環(huán)境友好等優(yōu)點(diǎn)。
參考文獻(xiàn):
[1] Corey E J,Helal C J.Catalytic enantioselective synthesis of the second generation histamine antagonist cetirizine hydrochloride[J].Tetrahedron Letters,1996,37(28):4837-4840.
[2] 王玉玲,高乾善,周偉,等.左旋西替利嗪鹽酸鹽的合成[J].食品與藥品,2005,7(9):33-35.
[3] Rajan S T,Rao U V B,Prabhakar A S,et al.Processes for preparing levocetirizine and pharmaceutically acceptable salts thereof [P].WO 2009 062 036,2009-05-14.
[4] 王立升,王天文,朱紅元,等.左西替利嗪的合成[J].廣西大學(xué)學(xué)報(bào)(自然科學(xué)版),2007,32(4):384-386.
[5] 劉慶彬,張福平,張占輝.左旋西替利嗪鹽酸鹽的一種合成方法[P].CN 101 100 462,2008-01-09.
[6] 劉補(bǔ)娥.鹽酸西替利嗪合成工藝的改進(jìn)[J].廣東化工,2008,35(9):66-67.
[7] 鄒志紅,王其遠(yuǎn),王偉.左旋鹽酸西替利嗪的制備研究進(jìn)展[J].東南大學(xué)學(xué)報(bào)(醫(yī)學(xué)版),2009,28(4):352-357.
[8] 李茜,沈文斌,鄒巧根.鹽酸西替利嗪的NMR研究[J].藥學(xué)學(xué)報(bào),2003,38(10):767-770.
[9] 王其遠(yuǎn),鄒志紅.左旋鹽酸西替利嗪的合成工藝改進(jìn)[J].中國(guó)藥物化學(xué)雜志,2008,18(4):273-275.

