AE3通過NO通路參與心肌細胞缺氧預適應的保護作用
廖章萍,劉 丹,王淑霞,李文娟,陳和平,何 明
(1.南昌大學藥學院藥理學與分子治療學教研室,江西南昌 330006;2.江西省人民醫院,江西南昌 330046)
各種原因造成的心肌組織血液灌注量減少可使細胞發生缺血性損傷,恢復血液再灌注后,缺血性損傷不但沒有緩解,反而進一步加重,這種現象稱為心肌缺血/再灌注損傷。1986年 Murry等[1]發現,如預先反復短暫的缺血/再灌注則可延緩或減輕隨后較長時間缺血所致的心肌損傷,并把此現象稱之心肌缺血預適應。
心肌缺血/再灌注損傷會引起心肌細胞內pH值的變化,pH可調節多種細胞事件,包括離子通道傳導、鈣離子內環境穩態等,在心肌中,鈣離子穩態及鈣對肌絲的敏感性都受pH變化影響,pH也調節縫隙連接及心肌細胞電生理偶聯。陰離子交換蛋白(anion exchanger,AEs)在調節細胞內酸堿平衡,維持細胞內pH值的穩定起著非常重要的作用。AEs是一種多功能嵌膜蛋白,具有Cl-/HCO3-交換功能,泵出 HCO3-,同時泵入 Cl-,使細胞內酸化[2]。
激活此離子交換系統,一方面,使細胞內Cl-濃度增加,另一方面,可使細胞內pH發生改變[3]。AEs包括AE1、AE2、AE3和AE4四個亞型,其中AE3在心肌中表達豐度最高。目前,關于AEs蛋白在心肌急性損傷病理生理過程的變化及其功能的研究很少,而有關AEs是否是通過細胞內某些信號轉導途徑發揮作用更是缺乏深入探討。NO通路是近年來心肌細胞信號傳導通路的研究熱點,大量研究都已證實NO[4-6]參與了心肌細胞缺血缺氧預適應保護作用。故本實驗采用Spraguer-Dawley(SD)乳鼠原代培養的心肌細胞,建立缺氧/復氧(A/R)和缺氧預適應(APC)模型,觀察AE3蛋白在心肌細胞缺氧預適應保護中的意義及與NO信號轉導通路的關系。
1 材料與方法
1.1 動物 SD新生大鼠(1~3 d),♀♂不拘,由南昌大學醫學院醫學實驗動物科學部提供。
1.2 藥品與主要試劑 MEM培養基(Gibco),胎牛血清(杭州四季青生物工程材料有限公司),LNAME(L-N-Nitro-Arginine Methyl Ester):Sigma公司;MTT:Ameresco公司;乳酸脫氫酶(LDH)、肌酸磷酸酶(CPK)試劑盒:Beckman公司;引物合成:上海生工生物工程技術服務有限公司;AE3抗體、β-actin抗體及相應二抗均購自Santa Cruz;總蛋白提取試劑盒:普利來公司。其余化學試劑均為國產分析純。
1.3 心肌細胞的分離培養 參照陳杰等[7]方法。取出生1~3 d的SD大鼠,消毒后開胸取出心臟,分離心室組織,用0.1%胰酶消化分離心肌細胞,再加入含15%胎牛血清的MEM培養基混懸后置CO2培養箱(5%CO2,37℃)培養2 h,利用差速貼壁法去除成纖維細胞,將懸浮的心肌細胞用200目不銹鋼網過濾,接種于相應的培養板內,于5%CO2,飽和濕度及37℃條件下培養,隔天更換培養液。
1.4 心肌細胞缺氧/復氧(anoxia/reoxygenation,A/R)模型建立 心肌細胞生長接近融合狀態時,對培養心肌細胞換用預先經95%N2和5%CO2混和氣體飽和過的模擬缺氧缺糖溶液(mmol·L-1,NaH2PO40.9,NaHCO36.0,CaCl21.8,MgSO41.2,HEPES 20,NaCl 98.5,KCl 10.0,pH 6.8,37℃),置于持續95%N2-5%CO2平衡的A/R裝置(37℃)中缺氧孵育3 h后,再換用模擬再灌注溶液(mmol·L-1,NaCl 129.5,KCl 5.0,NaH2PO40.9,NaHCO320,CaCl21.8,MgSO41.2,glucose 55,HEPES 20,pH 7.4),37℃于95%O2-5%CO2復氧孵育2 h。
1.5 心肌細胞缺氧預適應(anoxia preconditioning,APC)模型建立 心肌細胞換預先經95%N2和5%CO2混和氣體飽和過的模擬缺氧液,將細胞置于95%N2-5%CO2持續通氣的缺氧密閉容器中(37℃)30 min,再換模擬再灌注液,以95%O2和5%CO2混合氣體進行復氧孵育30 min(37℃),重復3次。
1.6 實驗分組 心肌細胞培養4 d后隨機分組進行實驗。實驗共分4組,每組重復8次。① Control組:棄培養液,換用正常 Tyrode溶液置于培養箱(5%CO2、95%空氣,37℃)孵育3 h后,再換上模擬再灌注溶液置于培養箱(5%CO2、95%空氣,37℃)孵育2 h;②A/R組:棄培養液,換用模擬缺氧缺糖溶液將培養板置于持續95%N2、5%CO2平衡的缺氧密閉容器中(37℃)3 h,再換上模擬再灌注液,以95%O2、5%CO2混合氣體進行復氧孵育 2 h(37℃);③ APC組:棄培養液,換用模擬缺氧缺糖液置于培養箱(5%CO2、95%空氣,37℃)孵育30 min,再換模擬再灌注液,以95%O2和5%CO2混合氣體進行復氧孵育30 min(37℃),重復3次;然后進行A/R處理;④ L-NAME組:在APC處理前用終濃度為50 μmol·L-1NO合成酶抑制劑L-NAME與細胞孵育30 min后,余同APC組。
1.7 心肌細胞AE3 mRNA的檢測 用TRIzol裂解心肌細胞提取RNA,經逆轉錄成cDNA,加入AE3和β-actin特異引物進行PCR擴增。AE3上、下游引物分別為:5'-AGGTCATGGAGCCCAATGG-3',5'-GAACTTGATCCAGCGTG-3'。β-actin上下游引物分別為:5'-AAGGATTCCTATGTGGGC-3',5'-CATCTCTTGCTCGAAGTC-3'。PCR產物經1.5%瓊脂糖凝膠電泳,通過Image Tool圖像分析軟件讀取目的電泳條帶的密度掃描值,以各組β-actin條帶的掃描值標化其相應組的AE3的mRNA表達量。
1.8 心肌細胞AE3蛋白的檢測 按蛋白提取試劑盒的方法提取心肌細胞總蛋白,Bradford法蛋白定量后分裝,-20℃保存。取上述細胞蛋白提取液上清進行聚丙烯酰胺凝膠電泳(SDS-PAGE,15%分離膠),將電泳分離后的蛋白質電轉移至硝酸纖維素膜上,經封閉、洗脫后加入AE3抗體(1∶500)或βactin抗體(1∶200),放置4℃過夜,洗膜后以相應的二抗孵育1 h,再洗膜,加ECL化學發光試劑,置暗室中曝光、顯影、定影膠片。將X線膠片掃描后,在Image Tool醫學圖形分析軟件上進行分析。將所得AE3蛋白帶的綜合密度分別除以β-actin相對應樣本的綜合密度。
1.9 細胞存活率檢測 采取MTT比色法檢測。培養于96孔培養板的H9c2心肌細胞,接種密度為104cells·well-1。實驗處理后每孔加入MTT溶液(5 g·L-1)20 μl,孵育 4 h;每孔加入 150 μl DMSO振蕩10 min,選擇490 nm波長,在酶聯免疫檢測儀上測定各孔光吸收值。設不加細胞,只加孵育液的空白對照,記錄結果。細胞存活率/%=(實驗組光吸收值/對照組光吸收值)×100%。
1.10 生化檢測 實驗結束后各組分別取孵育液200 μl,美國Beckman生化自動分析儀測定LDH和CPK活性。
2 結果
2.1 不同處理組對AE3 mRNA表達的影響 以各組β-actin條帶的掃描值標化其相應組的心肌細胞AE3的 mRNA表達量,Control組、A/R組、APC組、L-NAME 組分別為 0.27±0.08、0.40±0.06、1.44±0.10、0.45±0.08。A/R 組 AE3 mRNA 轉錄較Control組增加(P<0.05)。APC組心肌細胞AE3 mRNA不僅均較Control組轉錄明顯上調,而且較A/R組也明顯上調(P<0.01)。但預先加入NO合成酶抑制劑L-NAME則抑制了APC處理時AE3 mRNA轉錄的增強(P<0.01)(Fig 1)。
2.2 不同處理組對AE3蛋白表達的影響 以各組β-actin條帶的掃描值標化其相應組的心肌細胞AE3的蛋白表達量,Control組、A/R組、APC組、LNAME組分別為 0.23±0.06、0.36±0.08、1.16±0.10、0.39±0.06。A/R組AE3蛋白表達較Control組增加。APC組心肌細胞AE3蛋白與A/R組比較也明顯上調(P<0.01)。而L-NAME則抑制了APC組AE3蛋白的上調(P<0.01)。這一結果與上述心肌細胞AE3 mRNA的變化基本吻合(Fig 2)。
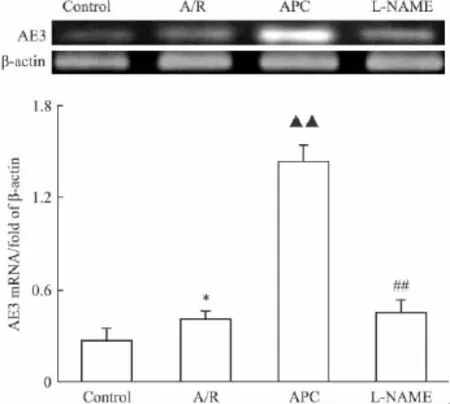
Fig 1 Effect of various treatments on expression of AE3 mRNA of cultured cardiomyocytes
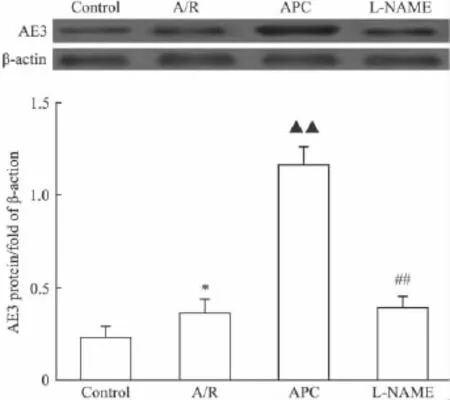
Fig 2 Effect of various treatments on expression of AE3 protein of cultured cardiomyocytes
2.3 不同處理組對心肌細胞A/R損傷后LDH、CPK活性的影響 如Fig 3所示,與Control組比,A/R組細胞懸液中LDH及CPK活性分別增加至4.5、4倍(P<0.01)。經APC處理則能降低 LDH及CPK活性(P<0.01);但加入L-NAME則可取消APC的保護作用,LDH及CPK活性與A/R組無差異。
2.4 不同處理組對心肌細胞A/R損傷后細胞存活率的影響 MTT結果(Fig 4)顯示,經A/R處理后,H9c2心肌細胞嚴重受損,細胞存活率較Control組降低47%;APC則能防止細胞損傷,細胞存活率上升至88%,較A/R組增高;而L-NAME可取消APC的心肌保護作用。
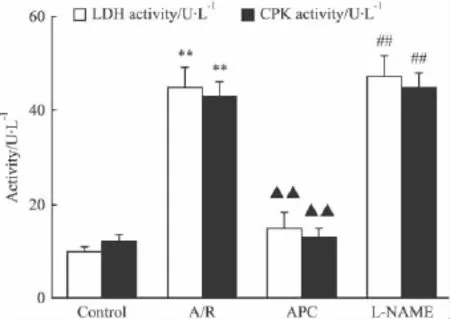
Fig 3 Effect of various treatments on LDH and CPK activity in cultured cardiomyocytes subjected to A/R injury
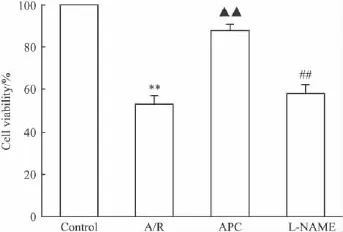
Fig 4 Effect of various treatments on cell viability in cultured cardiomyocytes subjected to A/R injury
3 討論
大量研究發現心肌缺血/再灌注損傷、缺血預適應保護作用與心肌細胞內的Na+、K+、Ca2+等陽離子穩態的變化密切相關,然而,對于陰離子轉運的有關研究卻很少。心肌細胞內的陰離子包括 Cl-、SO4
2-、HPO4
2-、有機酸根離子等,其中 Cl-為主要通透性的陰離子,參與了細胞多種活動和功能調節過程,如細胞電活動調節、容積調節、細胞內pH值調節等,且在細胞免疫應答、細胞遷移、細胞增殖和分化及細胞凋亡中發揮一定的作用[8]。
本實驗室前期研究發現Cl-在心肌細胞缺氧/復氧損傷中發揮重要作用,使用氯離子通道阻斷劑SITS可對抗心肌細胞缺氧/復氧損傷,有明顯的保護作用[7]。心肌缺血/再灌注時Cl-濃度的變化與細胞內pH值變化密切相關。AEs蛋白既是心肌細胞pH調節的主要方式之一,也是細胞內的Cl-濃度調節的重要通道蛋白之一。AEs具有雙向轉運Cl-/HCO-的功能,正常情況下其將細胞內HCO-33排出,同時將胞外Cl-移入胞內,使細胞酸化[9];反之,也可反向轉運Cl-和HCO3-[10]。心臟 AEs的膜性分布允許心肌細胞精確調節細胞內pH,防止代謝性CO2水化產生的HCO3-局部聚集,這對于心肌細胞維持正常的興奮-收縮偶聯及心臟舒縮功能具有非常重要的意義。新近研究亦證明,在肥厚性心肌病模型上,AE3蛋白的缺失可迅速導致失代償及心力衰竭[11]。
本實驗發現經缺氧預處理后,AE3 mRNA轉錄和蛋白表達均明顯上調,提示AE3可能參與了預適應保護,是一種內源性保護蛋白。我們認為,當心肌細胞經過短暫的缺氧處理后,導致心肌細胞內ATP不足、ADP積聚、pH值降低,可能通過某種途徑激活AE3蛋白,AE3蛋白發揮其雙向轉運功能,反向轉運Cl-和HCO3-,減輕心肌細胞內的酸中毒,使心肌細胞的酸堿緩沖容量擴大,調節細胞內pH值在相對恒定的范圍,以維持心肌收縮力。
本實驗中,在心肌缺氧預處理前給予NO合成酶抑制劑L-NAME可抑制AE3 mRNA和蛋白表達的上調,并且取消了缺氧預處理的保護作用,說明預適應引起的AE3表達增加與NO通路有關。大量研究表明,NO在缺血預適應中發揮著重要的作用。短暫多次的缺血/再灌注可通過提高NO合成酶活性,從而促使NO合成增加,激活PKC,導致內源性保護基因轉錄的增加以及蛋白表達的上調,從而發揮調節微血管舒張、減輕氧化應激,減少心律失常發生的心肌保護作用[6]。給予NO受體激動藥同樣也能產生類似缺血預適應的保護作用[12],而抑制NO的合成釋放則可取消預適應保護[13]。
因此,結合本實驗結果,我們推測AE3可能就是預適應保護物質的一種。缺氧預處理通過激活NO通路,使得AE3表達增加,AE3蛋白發揮其雙向轉運功能,反向轉運Cl-和HCO3-,減輕心肌細胞的酸中毒,發揮心肌保護作用。
[1] Murry C E,Jennings R B,Reimer K A.Preconditioning with ischemia:a delay of lethal cell injury in ischemic myocardium[J].Circulation,1986,74(5):1124 -36.
[2] van den Akker E,Satchwell T J,Williamson R C,Toye A M.Band 3 multiprotein complexes in the red cell membrane;of mice and men[J].Blood Cells Mol Dis,2010,45(1):1 -8.
[3] Chiappe de Cingolani G E,Ennis I L,Morgan P E,et al.Involvement of AE3 isoform of Na+-independent Cl-/HCO3-exchanger in myocardial pH(i)recovery from intracellular alkalization[J].Life Sci,2006,78(26):3018 -26.
[4] Liao Z,Yin D,Wang W,et al.Cardioprotective effect of sasanquasaponin preconditioning via bradykinin-NO pathway in isolated rat heart[J].Phytother Res,2009,23(8):1146 -53.
[5] Talukder M A,Yang F,Shimokawa H,Zweier J L.eNOS is required for acute in vivo ischemic preconditioning of the heart:effects of ischemic duration and sex[J].Am J Physiol Heart Circ Physiol,2010,299(2):H437 -45.
[6] Weerateerangkul P,Chattipakorn S,Chattipakorn N.Roles of the nitric oxide signaling pathway in cardiac ischemic preconditioning against myocardial ischemia-reperfusion injury[J].Med Sci Monit,2011,17(2):RA44 -52.
[7] 陳 杰,劉 丹,陳和平,等.氯離子參與心肌細胞缺氧復氧損傷機制的研究[J].中國藥理學通報,2007,23(6):724 -9.
[7] Chen J,Liu D,Chen H P,et al.Mechanisms of chloride in anoxiareoxygenation injury of cultured rat ventricular myocytes[J].Chin Pharmacol Bull,2007,23(6):724 -9.
[8] Zifarelli G,Pusch M.CLC chloride channels and transporters:a biophysical and physiological perspective[J].Rev Physiol Biochem Pharmacol,2007,158:23 -76.
[9] Bonar P T,Casey J R.Plasma membrane Cl-/HCO3-exchangers:structure,mechanism and physiology[J].Channels(Austin),2008,2(5):337 -45.
[10] Ohana E,Yang D,Shcheynikov N,Muallem S.Diverse transport modes by the solute carrier 26 family of anion transporters[J].J Physiol,2009,587(Pt 10):2179 -85.
[11] Al Moamen N J,Prasad V,Bodi I,et al.Loss of the AE3 anion exchanger in a hypertrophic cardiomyopathy model causes rapid decompensation and heart failure[J].J Mol Cell Cardiol,2011,50(1):137-46.
[12] Cohen M V,Yang X M,Liu Y,et al.Cardioprotective PKG-independent NO signaling at reperfusion[J].Am J Physiol Heart Circ Physiol,2010,299(6):H2028 -36.
[13] Pagel P S,Krolikowski J G,Pratt P F Jr,et al.The mechanism of helium-induced preconditioning:a direct role for nitric oxide in rabbits[J].Anesth Analg,2008,107(3):762 -8.

