人胎腦神經干細胞的體外分離、培養與鑒定
方 慶 朱慶豐 尹國才 陳新生
1.安徽醫科大學附屬安慶醫院神經外科,安徽 安慶 246003;2.安慶師范學院生命科學系,安徽 安慶 246003
中樞神經系統的許多疾病都存在不同程度和方式的神經細胞缺失或變性死亡,并由此引起神經功能的損害。傳統的治療效果多不顯著,神經干細胞(NSCs)的發現與移植研究為其治療帶來了新的思路和方法。本研究旨在探索人胎腦神經干細胞的體外分離培養條件,從而在體外大量增殖神經干細胞,并觀察神經干細胞增殖和分化的特點。
1 材料與方法
1.1 材料
水囊引產的14周妊娠胎兒1例,由臨床科室提供,孕婦自愿捐獻,對其使用遵守醫學倫理原則并經醫院倫理委員會批準。
1.2 主要試劑
DMEM/F12(1:1)培養基、B27、N2、堿性成纖維生長因子(bFGF)(Gibco 公司)、 表皮生長因子 (EGF)(Invitrogen 公司)、鼠抗人巢蛋白(Nestin)單克隆抗體、FITC標記的山羊抗小鼠IgG(Bdbioscience公司)、鼠抗人神經特異烯醇化酶(NSE)單克隆抗體、鼠抗人膠質纖維酸性蛋白(GFAP)單克隆抗體(Neomarkers公司)。
1.3 實驗方法
1.3.1 取材及原代細胞培養 取14周水囊引產的人胚胎,無菌條件下取海馬組織,用D-Hanks液漂洗,剪成1 mm3大小的組織塊,經0.25%胰蛋白酶消化15 min,用200目不銹鋼細胞篩,去除大塊組織,離心后收集沉淀細胞,將其重懸于含B27(1∶50)、N2(1∶100)、EGF(20 ng/mL)、bFGF(20 ng/mL)的DMEM/F12培養液中。記數細胞活力后,按2×105/mL接種密度于T25細胞培養瓶,37℃、5%CO2靜置培養,每天觀察細胞的生長狀況,3 d半量換液1次。
1.3.2 細胞傳代培養 傳代時,將神經細胞球收集于離心管經0.125%胰酶2 min,1000 r/min離心5 min后加入新鮮的全培養基,用移液器吹打10~15次,計數并以2×105個/mL細胞密度接種于T25細胞培養瓶中,37℃、5%CO2繼續培養,每3~4 d換半液1次,7~10 d傳代1次,方法同前。
1.3.3 神經球細胞爬片的制備及誘導分化 收集培養3~4代的“神經球”,接種于含有10%胎牛血清的24孔培養板中(內置經多聚賴氨酸涂片的載玻片),37℃、5%CO2,貼壁培養約4 h,取出部分載玻片。將未取出的附著在載玻片上的“神經球”誘導分化3~5 d,取出載玻片。取出的載玻片經4%多聚甲醛固定后-20℃保存備用。
1.3.4 免疫熒光細胞化學鑒定 取出3~4代的“神經球”細胞爬片,行Nestin免疫熒光染色鑒定。另將上述經10%胎牛血清誘導分化后的細胞爬片行NSE、GFAP免疫熒光單標染色,同時做陰性對照。室溫下,正常山羊血清作用阻斷非特異性結合位點,濕盒下孵育一抗和熒光二抗,熒光倒置顯微鏡下觀察和記錄照相。
2 結果
2.1 原代、傳代活細胞形態學觀察
初分離的細胞懸浮于培養液中,為圓形亮球狀,周圍有清晰的光暈,內部背景清晰;經錐蟲藍染色計數,活細胞在95%以上。2~3 d后,分裂形成多個細胞組成的懸浮生長細胞團,形狀不規則,大小不一,細胞之間結合較為松散(圖1)。6~7 d后,可見達數十個細胞構成的細胞團,呈球形或卵圓形,鏡下細胞團周邊細胞較亮,中心區細胞密度高,透光性差,有細胞溶解死亡現象(圖2),此時需及時傳代。在傳代過程中,第2~6代的神經干細胞生長迅速。形成的神經球內細胞結合相當緊密,不易分開(圖3)。
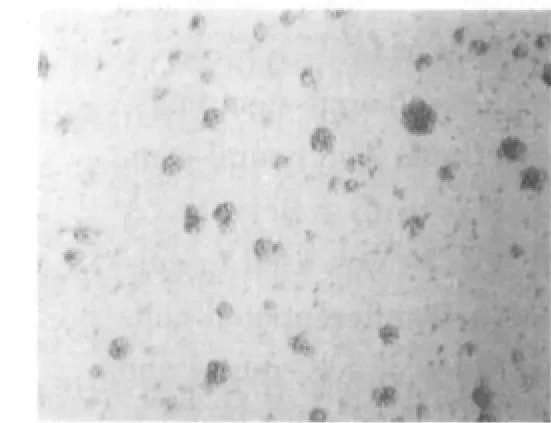
圖1 原代培養3 d的細胞團(×200)
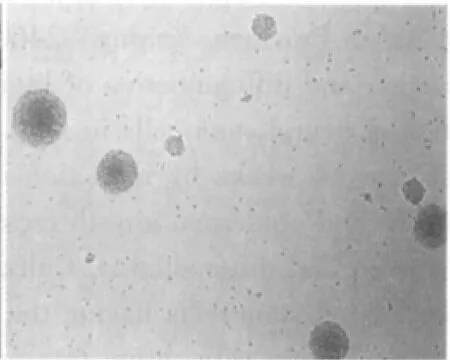
圖2 原代培養6 d的細胞團(×200)
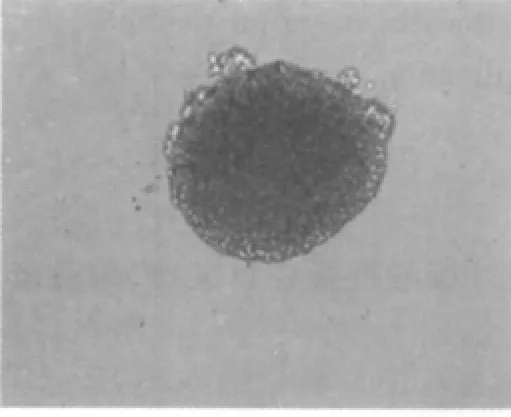
圖3 第3代的神經干細胞球(×200)
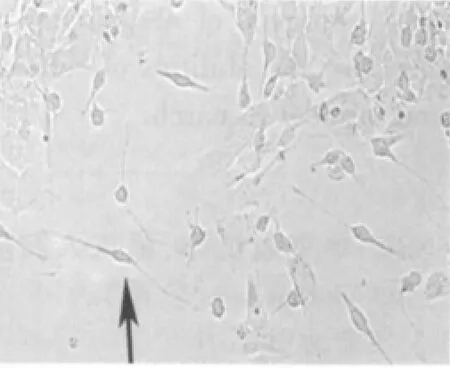
圖4 誘導分化5 d后,神經元樣細胞(×100)
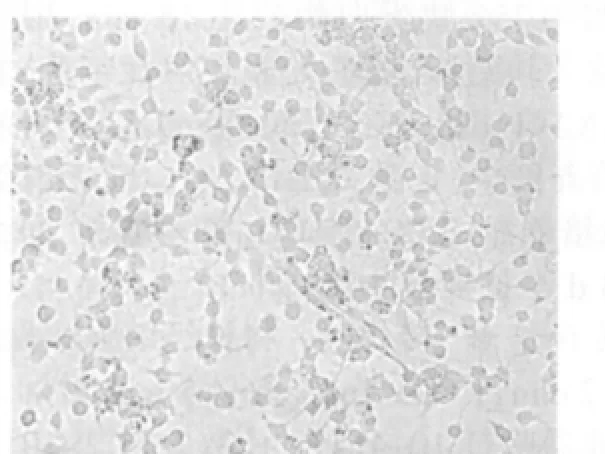
圖5 誘導分化后5 d,星形膠質細胞樣細胞(錐蟲藍×100)
2.2 誘導分化的活細胞觀察
神經球3~4 h后很快貼壁,培養24 h后可見單個細胞從“神經球”內爬出。2 d后突起不斷增粗和伸長,形態不規則,與周圍細胞互相聯接。5 d后分化出細胞逐漸增多,形成較大的冠面,根據細胞形態主要分為三種類型:①神經元樣細胞(圖4);②星形膠質細胞樣細胞(圖5);③少突膠質細胞樣細胞。
2.3 細胞標志物的鑒定
3~4代后,細胞球中大多數細胞免疫熒光染色呈陽性反應,表達NSC的特征性標志抗原Nestin(圖6)。10%胎牛血清培養基誘導后NSE或GFAP免疫熒光染色結果顯示部分細胞胞漿呈綠色熒光,即為NSE和GFAP陽性表達(圖7、8)。
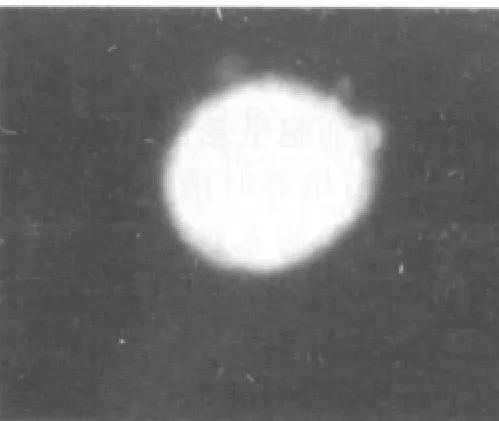
圖6 神經球Nestin免疫熒光染色陽性(×200)
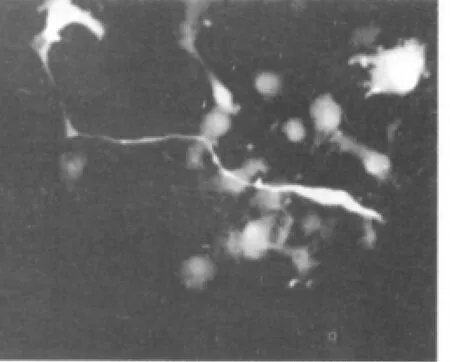
圖7 誘導分化5 d后,免疫熒光染色呈NSE陽性的神經元(×400)
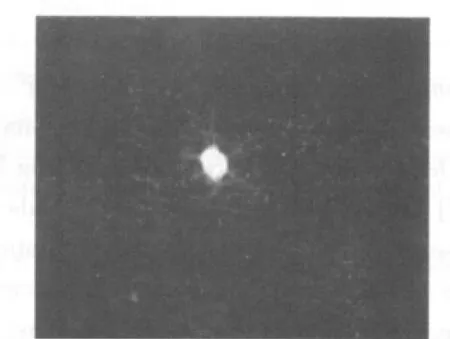
圖8 誘導分化5 d后,免疫熒光染色呈GFAP陽性的星形膠質細胞(×400)
3 討論
原代取材是進行組織培養的第一步。比較從胚胎期、新生兒期、嬰幼兒期及成年期尸體分離培養的神經干細胞,胚胎期分離的神經干細胞具有更強的增殖能力[1-3],并且成體神經干細胞在體外培養的傳代能力有限,長期體外培養也不能產生足夠數量的神經元[4]。在人胎腦的研究方面,國內學者通過研究同一胎齡不同部位來源的神經干細胞,得出以下結論:在人胎腦的海馬、室下區、紋狀體、額葉、顳葉、頂葉、枕葉7個部位均存在神經干細胞且數量依次逐漸減少[5-6]。在本研究中,筆者取材于14周人胎腦海馬區的神經干細胞,經培養后細胞數目明顯增多,且能夠在體外培養條件下連續分裂增殖。
生長因子在無血清培養基中對于維持神經干細胞生長與增殖是不可或缺的[7-8]。bFGF和EGF是在神經干細胞基礎研究中用于其培養最多見的兩種神經生長因子[9]。它們主要是作為神經干細胞有絲分裂中的分裂原而產生作用的,大量研究證明,EGF主要是在體外培養的早期為神經干細胞所需,bFGF主要是在神經干細胞增殖過程中發揮作用,它們共同作用以維持神經干細胞體外有絲分裂以及增殖[10-12]。
傳代操作對于培養的成功與否是至關重要的。文獻報道中主要包括機械分離和胰酶消化兩種。研究證實,單純吸管吹打無論從分離細胞的數量或存活率方面均不及酶消化結合吸管吹打的方法,這主要由于吸管吹打的機械切割作用使細胞活性受到一定影響且不利于分離組織內的細胞[13]。培養過程中,一般以神經球的大小作為判斷傳代時機的標志,筆者的經驗是神經球的直徑在0.6~0.8 mm時進行傳代是最適合的,神經球過大或過小都對傳代后神經干細胞的活性造成損害[14]。
神經干細胞免疫化學鑒定標記物中最常用的為Nestin。該蛋白只在多潛能的神經外胚層細胞表達,隨著神經上皮的分化成熟逐漸消失,其功能現在尚未完全明確,可能具有機構和信息傳遞的功能。神經干細胞的鑒定,還應看是否能分化成神經元、膠質細胞及是否能分裂增殖。本研究中筆者分別用Nestin單抗標記神經干細胞,用NSE單抗標記神經元,用GFAP單抗標記星形膠質細胞,利用免疫熒光技術觀察到了綠色熒光,證明從人胎腦海馬獲得了NSCs,且其具有自我更新能力和多向分化的潛能,為進一步用于基礎及臨床研究奠定了基礎。
[1]Palmer TD,Schwartz PH,Taupin P,et al.Cell culture.Progenitor cells from human brain after death[J].Nature,2001,411(6833):42-43.
[2]Schwartz PH, Bryant PJ,Fuja TJ,et al.Isolation and characterization of neural progenitor cells from post-mortem human cortex [J].J Neurosci Res,2003,74(6):838-851.
[3]Xu Y,Kimura K,Matsumoto N,et al.Isolation of neural stem cells from the forebrain of deceased early postnatal and adult rats with protracted post-mortem intervals[J].J Neurosci Res,2003,74(4):533-540.
[4]Galvin KA,Jones DG.Adult human neural stem cells for cell-replacement therapies in the central nervous system[J].Med J Aust,2002,177(6):316-318.
[5]尹曉娟,巨容,封志純.32周胎齡人胎腦神經干細胞發育狀態的研究[J].中國小兒急救醫學,2006,13(5):457-458.
[6]尹曉娟,封志純.36周胎齡人胎腦不同部位神經干細胞的變化特征研究[J].臨床兒科雜志,2006,24(10):838-840.
[7]Dietus C,Tronnier V,Unterberg A,et al.Comparative analysis of in vitro conditions for rat adult neural progenitor cells[J].J Neurosci Methods,2007,161(2):250-258.
[8]Hulspas R,Tiarks C,Reilly J,et al.In vitro cell density-dependent clonal growth of EGF-responsive murine neural progenitor cells under serum-free conditions[J].Exp Neurol,1997,148(1):147-156.
[9]Israsena N,Hu M,Fu W,et al.The Presence of FGF2 signaling determines whether Beta-catenin exerts effects on proliferation or neuronal differentiation of neural stem cells[J].Dev Biol,2004,268(l):220-231.
[10]Taupin P,Ray J,Fischer WH,et al.FGF-2-responsive neural stem cell proliferation requires CCg,a novel autocrine/paracrine cofactor[J].Neuron,2000,28(2):385-397.
[11]Vseeovi AL,Parati EA,Gritti A,et al.Isolation and cloning of mutipotential stem cells from the embryonic human CNS and establishment of transplantable neural Stem cells lines by epigenetic stimulation[J].Exp Neurol,1999,156(1):71-83.
[12]Alvarez-Buylla A,Garcia-Verdugo JM.Neurogenesis in adult subventricular zone[J].J Neurosci,2002,22(3):629-634.
[13]任萍,關云謙,張愚.人胚皮層神經干細胞培養方法的探討(簡報)[J].分子細胞生物學報,2007,40(1):79-83.
[14]孫鵬,董愷,董朝軒,等.人胚額葉皮層和海馬干細胞的自主分化研究[J].中華神經外科雜志,2006,22(10):620-623.

