地塞米松對慢性肺源性心臟病中心肌自身抗體的干預對比
喬可宏 楊清和 王 萍 王 虹
上世紀末在擴張性心肌病中發現了抗M2受體的自身抗體的重要作用,后來在多種心臟疾病患者血清中都發現了心肌自身抗體,其中抗M2受體和β1受體的自身抗體研究最多,因而很多學者認為,自身免疫在心肌損傷中扮演了一個很重要的角色[1]。那么作為以右心功能不全為主要表現的慢性肺源性心臟病(chronic cor pulmonale,CCP)的病因,單用缺氧導致肺動脈高壓來解釋尚存很多質疑,本研究的目的旨在探討自身免疫機制是否參與作用CCP的發生。
材料與方法
一、研究材料
1.研究對象:收集2010年1月至2010年12月,太原市中心醫院呼吸科及老年病科,年齡18~80歲的慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)急性加重期組患者。CCP組包括急性加重期組和臨床緩解期組患者;正常對照組,為太原市中心醫院體檢中心體檢正常者。自2010年1月至2010年10月每組收集符合條件的以上病例數均達20例。
2.實驗材料
(1)試劑:地塞米松片(山西同達藥業有限公司,國藥準字H14023304);生物素化羊抗人IgG單克隆抗體(北京中山生物技術有限公司提供);辣根酶標記鏈親和素(北京中山生物技術有限公司提供);底物2,2’-連氮-雙(3-乙基苯并噻唑-6-磺酸)(ABTS)(上海生工生物工程公司進口分裝);抗原肽段由北京賽百盛基因技術有限公司參照相關序列合成,受體抗原肽段(按照以下序列合成):
①M2膽堿能受體細胞外第二環功能表位肽段序列169-193位氨基酸殘基
V-R-T-V-E-D-G-E-C-Y-I-Q-F-F-S-N-A-A-V-T-F-G-T-A-I-C
②M3膽堿能受體細胞外第二環功能表位肽段序列18-36位氨基酸殘基
S-S-W-I-H-S-P-S-D-A-G-L-P-P-G-T-V-T-H
③AT1血管緊張素II受體細胞外第二環功能表位肽段序列165-191位氨基酸殘基
I-H-R-N-V-F-F-I-E-N-T-N-I-T-V-C-A-F-H-Y-E-S-Q-N-S-T-L
④α1腎上腺素能受體細胞外第二環功能表位肽段序列192-218位氨基酸殘基
G-W-K-E-P-V-P-P-D-E-R-F-C-G-I-T-E-E-A-G-Y-A-V-V-F-S-S
⑤β1膽堿能受體細胞外第二環功能表位肽段序列197-222位氨基酸殘基
H-W-W-R-A-E-S-D-E-A-R-R-C-Y-N-D-P-K-C-C-D-F-V-T-N-R
⑥β2膽堿能受體細胞外第二環功能表位肽段序列172-197位氨基酸殘基
H-W-Y-R-A-T-H-Q-E-A-I-N-C-Y-A-N-E-T-C-C-D-F-F-T-N-Q-C
⑦β3膽堿能受體細胞外第二環功能表位肽段序列176-202位氨基酸殘基
Q-W-W-R-V-G-A-D-A-E-A-Q-R-C-H-S-N-P-R-C-C-A-F-A-S-N-M-P-V)。
(2)儀器:DG3022型酶聯免疫檢測儀(Molecular Devices Corp,Menio Park,CAUSA)
(3)實驗場所:太原市中心醫院內科實驗室
二、研究方法
1.分組標準
(1)COPD組(20例):參照衛生部統編第七版內科學教材中診斷標準。
(2)CCP組:收集患者主要為確診COPD10年以上,病程遷延發展,明確診斷為CCP者。其中分為急性加重期組(20例)和臨床緩解期組(20例),參照衛生部統編第七版內科學教材中診斷標準。
(3)正常對照組(20例):我院體檢中心體檢正常者(體檢項目包括:常規生命體征,血壓、血糖、血脂、肝腎功能、血常規、尿常規、便常規、胸片、心電圖、腹部彩超,均在正常范圍)。
(4)入組過程中排除外左心系統疾病,如冠狀動脈粥樣硬化性心臟病、風濕性心臟病、支氣管擴張、間質性肺疾病、支氣管哮喘、肺血管疾病、結締組織病及其他可能影響心功能、肺通氣及換氣功能、免疫因素的疾病。
2.采血及血清的提取:于受試者明確診斷后1~2 d及口服地塞米松片10 mg干預治療后提取清晨空腹肘靜脈血,經2000 r/min離心10 min后提取血清,每管20 μl分裝,-80℃保存。
3.入組后治療及剔除標準:入組患者的住院及門診治療均采用呼吸科常規治療方法,包括:抗生素、支氣管擴張劑、化痰、吸入糖皮質激素、改善心功能及對癥支持治療。
剔除標準:(1)試驗過程中發生其他影響心肺功能及免疫系統的疾病,例如:急性心肌梗死、肺栓塞等(本次試驗剔除5例);(2)試驗過程中發現診斷錯誤(本次試驗剔除1例);(3)患者中途退出(本次試驗剔除10例);(4)患者試驗過程中死亡(本次試驗剔除3例);(5)試驗過程中靜脈使用糖皮質激素、免疫抑制劑等干擾試驗數據的因素(本次試驗剔除6例)。
4.指標檢測:采用SA-ELISA方法進行心肌自身抗體的測定,同時進行心電圖、超聲心動圖(右室流出道內徑、右室內徑及左右室內徑比值)、血氣分析(動脈血氧分壓、動脈血二氧化碳分壓)檢查。
5.數據分析:①抗體定性判定:以(標本光密度值-空白光密度值)/(陰性光密度值-空白光密度值),即P/N值≥2.1為陽性,P/N值≤1.5為陰性。②抗體效價判定:將血清標本從1︰20起連續倍比稀釋,以出現P/N值≥2.1的最高稀釋度作為該標本的效價。
6.免疫干預:采用小劑量激素地塞米松10 mg/d,口服,共2周,作為免疫抑制劑干預治療,再次采血并復查各項指標。
三、統計學方法
結 果
1.各干預前后自身抗體陽性率的變化比較(分別以 M2、M3、AT1、α1、β1、β2、β3表示血清中 M2、M3、AT1、α1、β1、β2、β3相應自身抗體的陽性率):參照前文受體抗體陽性率計算方法,通過對各組干預治療后數據分析可見,COPD急性加重期組、正常對照組干預前后數據無明顯差異,肺心病急性加重期組中M3、AT1、α1、β1均有明顯差異,臨床緩解期組干預前后僅β1有明顯差異,但總體CCP急性加重期組、臨床緩解期組在干預后數值均有下降的趨勢,見表1。
2.超聲心動圖(右室流出道內徑、右室內徑及左右室內徑比值)結果比較:通過超聲心電圖比較可見COPD急性加重期組和正常對照組干預前后無明顯差異,但CCP組干預后右室流出道內徑、右室內徑及左右室內徑比值明顯減少,見表2。
3.血氣分析(動脈血氧分壓以PaO2表示、動脈血二氧化碳分壓以PaCO2表示)結果比較:通過血氣分析指標測定可見,干預前后COPD急性加重期組和CCP組經過干預治療后,動脈血氧分壓明顯升高、動脈血二氧化碳分壓明顯下降,考慮干預治療能有效改善血氣分析指標,見表3。
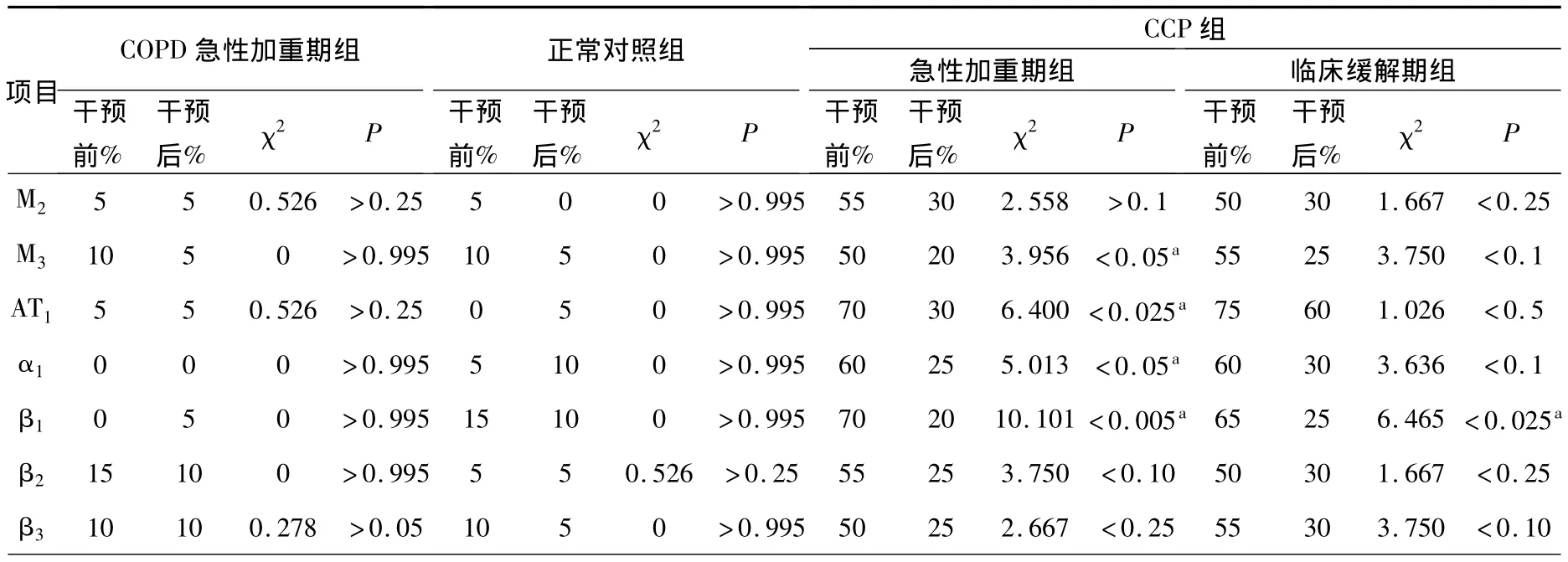
表1 干預前后自身抗體陽性率的變化比較Table 1 Comparison of positive rate of antoantibody before and after intervention
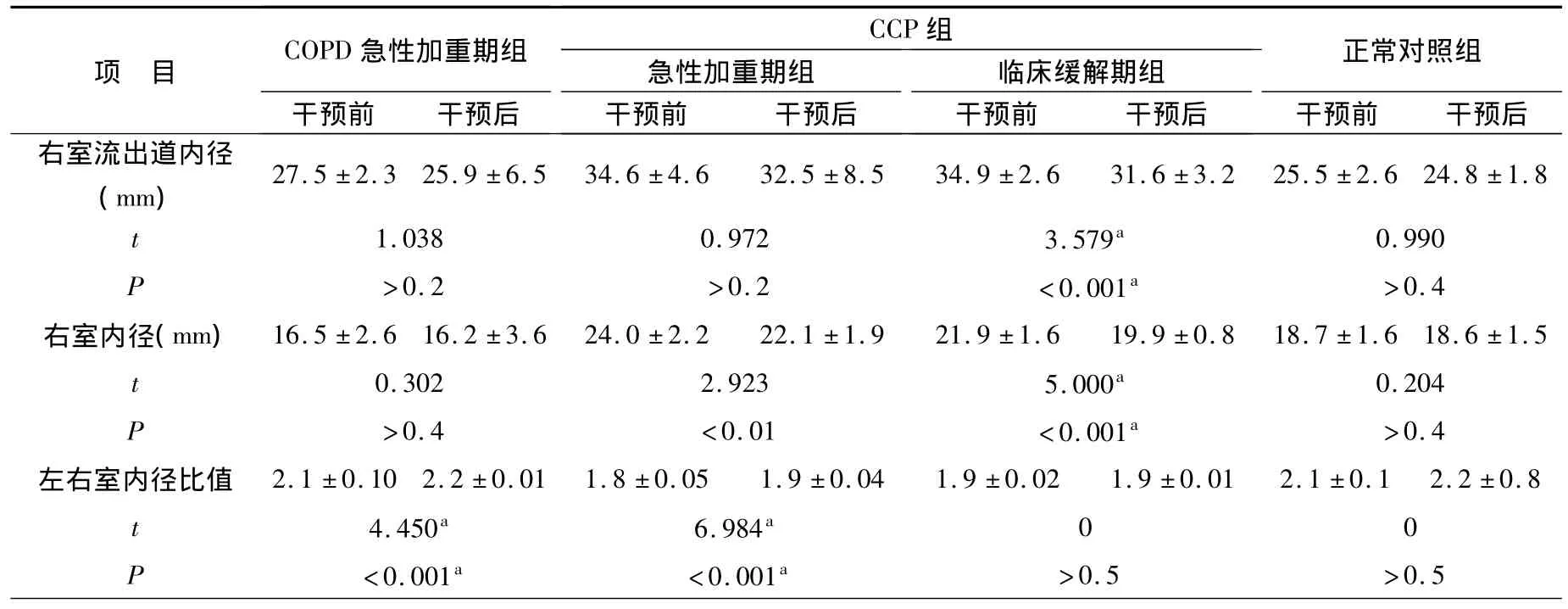
表2 干預前后超聲心動圖結果比較Table 2 Comparison of ultrasonic cardiogram before and after intervention
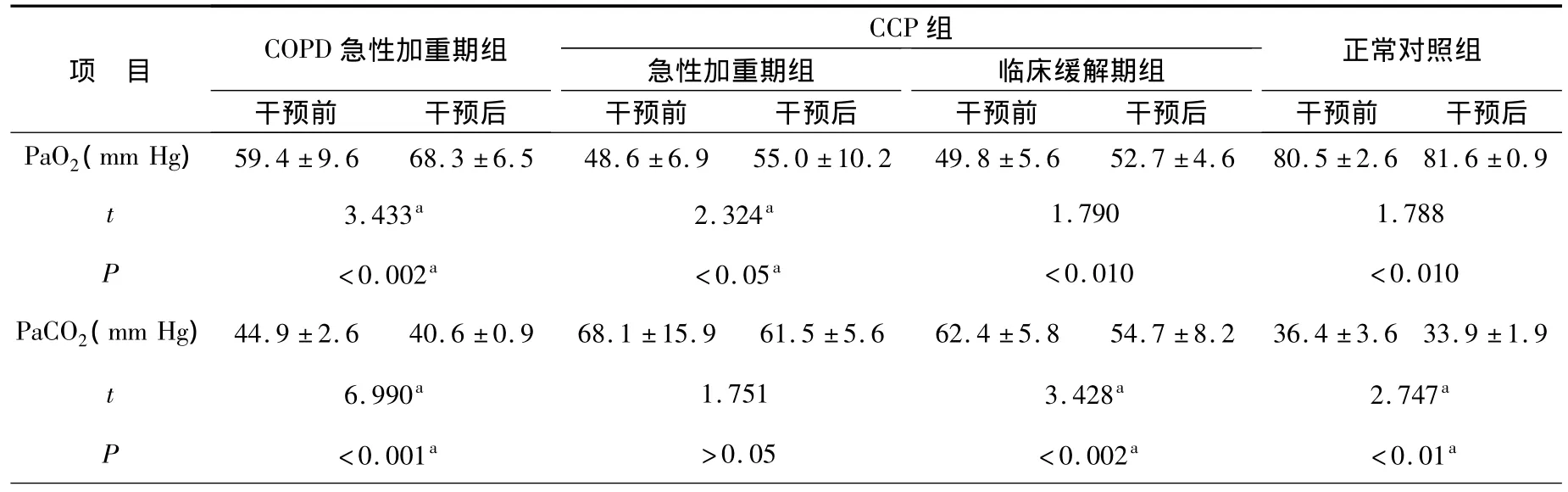
表3 干預前后血氣分析結果比較Table 3 Comparison of blood gas analysis before and after intervention
討 論
長期以來CCP的研究主要集中在缺氧導致肺動脈高壓這一主要機制上,但近年眾多研究提示,CCP的發病中免疫因素同樣起著重要作用[1-2]。許多心臟疾病患者血清中都發現多種抗心肌自身抗體,已證實這些抗心肌自身抗體在心臟可以與其受體結合產生類激動劑樣作用,并且脫敏時間延長,它的持續存在造成心肌損害[3-5]。臨床中對嚴重擴心病患者采用免疫吸附去除自身抗體或采用免疫抑制劑治療后,也可使患者病情改善[1]。因此它們與心肌的結構和功能改變可能有關,但是其中眾多抗體作用相拮抗,它們對心臟是否起到損害作用尚不清楚,我們就此入手,對多種心肌自身抗體進行研究。
心肌中存在多組相拮抗的受體,之間相互平衡而發揮作用,研究顯示在心臟發揮作用的主要受體如下:①腎上腺素受體分為α、β兩種,α中α1少量存在于心臟組織,主要引起血管平滑肌的收縮,β1-受體在心臟產生正性變時、變力、變傳導作用,導致腎素分泌增加致血壓升高;而β3-受體主要存在于脂肪組織,心臟含量甚微,高濃度方可激動,但有研究顯示,對β1-受體、β2-受體均抑制之后,仍有激動作用,而產生負性變時,變力,變傳導,考慮為心臟的保護性受體[7];②乙酰膽堿受體中對心臟有影響的主要為M2和M3受體,M2受體在心臟,主要起負性變時,變力,變傳導作用,但有研究顯示可以導致心肌細胞凋亡,而M3受體,主要存在于血管、平滑肌、腺體等,導致血管平滑肌舒張;③而血管緊張素Ⅱ受體分為AT1和AT2受體,其中AT1主要存在于心臟的竇房結和傳導束,起主導作用,促進心肌、平滑肌收縮,導致血管平滑肌和心肌肥厚,而AT2受體胚胎中含量高,出生后濃度銳減,考慮為保護性抗體。
本研究顯示在COPD、CCP的發生發展過程中,心肌自身抗體水平逐步升高,其中AT1組、β1組增高明顯,β3組、M3組增高較低,可能隨著CCP的發生發展,心肌自身抗體水平逐漸增高,在阻塞性肺氣腫組已有增高趨勢,并在CCP組達最高峰。我們認為在CCP的發生、發展中,心肌自身抗體水平升高,其中可能存在持續正性作用,即正性變時、變力、變傳導,從而導致心肌肥厚。雖然存在心肌的保護性抗體,如β3受體抗體,但結合本研究,導致心肌損害的自身抗體無論從數量上還是濃度上均占主導作用。我們認為在心肌自身抗體對心臟的損害作用中,α1、β1、β2、M3、AT1受體抗體均可導致心肌受體的持續激動作用,脫敏延遲,心肌肥厚,導致或加劇心肌損害、心衰產生;從而超過了β3、M2受體抗體的保護性與上述拮抗作用。
而地塞米松作為臨床常用的免疫抑制劑,小劑量使用有抑制免疫的作用,干預后發現自身抗體水平下降,臨床指標好轉,考慮在免疫抑制時,損害心肌的抗體被抑制,而保護性抗體同樣被抑制,但后者數量小,作用相對弱,總體效果表現為臨床指標的好轉。對于以上抗體的研究可以對CCP的診斷治療提供依據,探索某種抗體是否可以作為CCP的疾病嚴重程度評價指標,而干預治療中是否應趨利避害,則應分別對待,本研究目前尚處于實驗室階段,尚有待進一步臨床研究證實。
通過我們的研究考慮:①COPD、CCP的發生發展過程中,心肌自身抗體水平逐步升高,其中AT1組、β1組增高明顯,β3組、M3組增高較低,但隨著CCP的發生發展,心肌自身抗體水平逐漸增高;②通過小劑量激素地塞米松抑制自身免疫反應后,抗體水平有不同程度的下降,CCP急性加重期組中M3、AT1、α1、β1均有明顯差異,具有統計學意義,臨床心臟彩超、血氣分析指標改善,臨床觀察患者癥狀明顯改善,考慮為抑制免疫反應后,患者癥狀及臨床指標改善,抗體水平下降。
1 喬可宏,劉學軍.大鼠缺氧致肺心病模型和M2受體主動免疫模型心肌結構的比較研究[J].中華老年醫學雜志,2010,29(7):605-608.
2 喬人立.重新認識慢性阻塞性肺疾病與肺源性心臟病[J].中華結核和呼吸雜志,2011,34(4):246-248.
3 Stavrakis S,Kem DC,Patterson E,et al.Opposing cardiac effects of autoantibody activation of beta-adrenergic and M2 muscarinic receptors in cardiac-related diseases[J].Int J Cardiol,2010,1(1):5.
4 Yu X,Patterson E,Stavrakis S,et al.Development of cardiomyopathy and atrial tachyarrhythmias associated with activating autoantibodies to beta-adrenergic and muscarinic receptors[J].J Am Soc Hypertens,2009,3(2):133-140.
5 Jahns R,Boivin V,Hein L,et al.Direct evidence for β1-adrenergic receptor-directed autoimmune attack as a cause of idiopathic dilated cardiomyopathy[J].J Clin Invest,2004,113(10):1419-1429.
6 陳 瑾,胡大一,張 麟,等.卡維地洛對心臟β-1、β-2和α-1受體自身抗體及心功能的影響[J].中華心血管病雜志,2005,33(6):498-501.
7 Freedman NJ,Lefkowitz RJ.Anti-β1-adrenergic receptor antibodies and heart failure:causation,not just correlation[J].Clin Invest,2004,113(10):1379-1382.
8 Nussinovitch U,Shoenfeld Y.The clinical and diagnostic significance of anti-myosin autoantibodies in cardiac disease[J].Clin Rev Allergy Immunol,2011,1(5):8299.
9 Niu X,Watts VL,Cingolani OH,et al.Cardioprotective effect of Beta-3 adrenergic receptor agonism:role of neuronal nitric oxide synthase[J].J Am Coll Cardiol,2012,29(6):1979-1987.
10 馬秀瑞,王敬萍,劉慧榮.抗β_3腎上腺素能受體自身抗體對心衰大鼠心臟的保護作用[J].中國病理生理雜志,2010,(10):105-107.
11 Pan Z,Guo Y,Qi H,et al.M3 subtype of muscarinic acetylcholine receptor promotes cardioprotection via the suppression of miR-376b-5p[J].PLoS One,2012,7(3):e32571.
12 Kruse AC,Hu J,Pan AC,et al.Structure and dynamics of the M3 muscarinic acetylcholine receptor[J].Nature,2012,2(22):552-556.

