胃蛋白酶前處理對大豆蛋白酶解特性的影響*
趙謀明 張遠紅 崔春 源博恩
(華南理工大學輕工與食品學院,廣東廣州510640)
大豆蛋白是一種營養豐富的優質植物蛋白,是食品工業中重要的蛋白質資源.大豆蛋白食品消費量逐年增長,提高其營養價值的有效利用和加工性能一直是大豆蛋白深加工領域發展的主題.研究表明,大豆蛋白酶解可產生一系列具有生理活性的多肽,從而達到提高大豆蛋白營養價值的效果[1].
大豆蛋白主要由 β-伴球蛋白(7S)和球蛋白(11S)組成.7S是由非共價鍵穩定的三聚體糖蛋白,研究表明,7S熱不穩定且易被酶水解[2].11S是由二硫鍵連接酸性亞基和堿性亞基而成的六聚體,分子高度壓縮、結構緊密,對蛋白酶的酶解作用具有較強的抵抗力[3-4],是限制大豆蛋白酶解效率的關鍵因素.因此,必須考慮對大豆蛋白的11S組分進行前處理,使其致密的結構變得松散,以利于高效酶解[5].前處理手段一般包括物理手段、化學手段和酶法手段.有研究發現,11S組分在酸性條件下會發生亞基解離[6],緊密結構展開,從而有利于酶解的進行[7].基于胃蛋白酶作用最適 pH 值為 1.5 ~2.2,對11S具有選擇性優先水解的獨特效果[7-8],文中結合化學法和酶法對大豆蛋白進行前處理,先采用胃蛋白酶處理大豆蛋白,然后用堿性蛋白酶和復合蛋白酶進行酶解,針對酶解產物的十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)、蛋白回收率、水解度、抗氧化性以及分子質量分布進行了一系列的分析,以期為功能性大豆肽的生產提供理論和方法上的指導.
1 材料與方法
1.1 主要原料
主要原料如下:低溫脫脂豆粕,山東禹王實業有限公司產品;胃蛋白酶(酶活600~1000 U/mg),北京鼎國生物技術有限公司產品;堿性蛋白酶,奧博星生物技術有限公司提供(測定酶活33.6萬U/g);復合蛋白酶,諾維信公司提供(測定酶活17.3萬U/g);熒光物質Sodium Fluorescein、自由基產生劑AAPH,美國Sigma公司產品.電泳試劑為電泳級,其他試劑均為分析純.
1.2 儀器與設備
主要儀器與設備如下:320-S數顯pH計,瑞士梅特勒-托利多公司生產;DYY-Ⅲ28A電泳槽,北京六一儀器廠生產;紫外可見分光光度計,上海精密科學儀器有限公司生產;KDN-40消化爐,上海新嘉電子有限公司生產;KDN-2C型蛋白質測定儀,上海纖檢儀器有限公司生產;Amersham蛋白質分析純化系統,Amersham中國有限公司生產;Varioskan Flash多功能酶標儀,芬蘭Thermo Scientific公司生產.
1.3 實驗方法
1.3.1 大豆蛋白溶液的制備
采用堿溶酸沉法[9]提取大豆蛋白.稱取一定量的低溫脫脂豆粕與去離子水按1∶15(體積比)的比例混合,用2mol/L NaOH調節pH值至7.5,浸提1h后在6000r/min下離心10min去除殘渣,以2mol/L的HCl溶液調節pH值至4.5,酸沉后6000r/min下離心10min,所得沉淀加5倍體積的去離子水復溶,配成大豆蛋白溶液,備用.
1.3.2 酶解方法
將上述配好的大豆蛋白溶液平均分成兩份.一份先用胃蛋白酶在pH=2.0、37℃、加酶量3‰(酶/底物)條件下酶解到最適時間后立即調節pH值至8.5,穩定30 min后,加1%的堿性蛋白酶在50℃下酶解;另一份則不經過胃蛋白酶前處理,直接調節pH值至8.5,加1%的堿性蛋白酶在50℃下酶解,酶解過程中用2 mol/L NaOH維持pH值恒定.取樣時間為 0、1、2、4、8、12、22、24 h,酶解至終點時將酶解液置于100℃水浴中加熱10 min滅酶,冷卻至室溫后于10000r/min下離心20min,將所得上清液稱重后冷凍以備檢測.按照相同步驟,用復合蛋白酶代替堿性蛋白酶,酶解溫度為50℃,pH值為8.0,測定復合蛋白酶的酶解效果.
1.3.3 SDS-PAGE 分析
SDS-PAGE 參照 Laemmli[10]的方法.分離膠質量分數為12%,濃縮膠質量分數為5%.電泳前將已和樣品緩沖液混合的樣品煮沸5min,并在10000r/min下離心5min,取15μL上清液進樣.凝膠電泳于恒流下進行,濃縮膠中電流為40 mA,進入分離膠后增至80mA,凝膠染色及脫色后,于凝膠成像系統進行成像處理.
1.3.4 蛋白質回收率的測定
用凱氏定氮法測定大豆蛋白酶解上清液中蛋白氮含量[11],按下式計算蛋白回收率:

式中:X1為大豆蛋白酶解上清液蛋白含量,%;X2為大豆蛋白溶液蛋白含量,%;m為大豆蛋白酶解上清液質量,g;M為大豆蛋白酶解液質量,g.
1.3.5 水解度的測定
水解度(DH)的測定采用OPA法[12]:
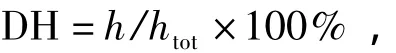
其中,h為斷裂肽鍵數,總肽鍵數htot(大豆蛋白)=7.8.
1.3.6 酶解液抗氧化活性評價
酶解液抗氧化活性評價采用ORAC值法.ORAC 值的測定參照 Hernández等[13]的方法.將待測樣品溶于75mmol/L磷酸鹽緩沖液中配成質量濃度為0.1 g/L的溶液,取20 μL加入96孔熒光板微孔中,再添加20μL磷酸鹽緩沖溶液(75 mmol/L)及20μL熒光溶液(70 nmol/L),在37℃下預置15 min后,加入12mmol/L AAPH 140μL啟動反應,以激發波長485nm、發射波長538nm進行測定,每2min測定一次熒光強度,測定時間設定在熒光衰減呈基線后為止,即設為2 h.ORAC值是將熒光衰退曲線的保護面積與標準抗氧化物質(Trolox)的保護面積相比得出,以每克肽中的Trolox當量(μmol)表示.
1.3.7 酶解液的分子質量分布測定
采用Amersham蛋白質分析純化系統測定大豆蛋白酶解液分子質量分布.凝膠滲透色譜(GPC)條件如下:Superdex-peptide,10/300-GL玻璃柱,洗脫液為0.25mmol/L NaCl,pH=7.2 的磷酸鹽緩沖液,流速為0.5mL/min,檢測波長為214nm.標準肽樣品與洗脫液體積擬合方程為lgG=-0.0578V+4.6289(r2=0.99),式中lgG為標準肽相對分子質量的常用對數,V為洗脫液體積.
1.4 數據統計與分析
數據均為3次測定的平均值,并使用Origin Pro 8.0 作圖.
2 結果與分析
2.1 SDS-PAGE 圖譜分析
圖1所示為不同酶解時間下的SDS-PAGE圖譜.從圖1中可以看出:隨著酶解的進行,大豆蛋白11S組分的亞基條帶逐漸消失,到2 h時完全消失,表明此時11S組分全部被胃蛋白酶酶解;而隨著酶解時間的延長,7S亞基條帶變化不明顯,說明胃蛋白酶對7S敏感性較低.因此,實驗中選用胃蛋白酶酶解2h作為前處理條件.

圖1 胃蛋白酶酶解大豆蛋白不同時間下的SDS-PAGE圖譜Fig.1 SDS-PAGE patterns of soy protein hydrolysates hydrolyzed by pepsin with different time
圖2所示為大豆蛋白酶解產物的SDS-PAGE圖譜.從圖2中可以看出,胃蛋白酶酶解2 h后,11S亞基條帶亮度顯著減弱,而7S亞基條帶變化不明顯.這與圖1的結果相符.從條帶7-10和16-19可以看出,單獨使用堿性蛋白酶酶解時,酶解主要作用在7S和11S的酸性亞基上,酶解速度很快,酶解1h已經降解幾乎全部的目標亞基,但對堿性亞基作用較弱,酶解24h后依然有堿性亞基存在,酶解產物分子質量最大在20ku左右;而單獨使用復合蛋白酶酶解時,酶解速度較慢,酶解主要作用于7S,對11S的酸性亞基有較弱作用.使用胃蛋白酶酶解2h作為前處理,在很大程度上提高了這兩種蛋白酶的酶解效率.從條帶3-6和12-15可以看出,堿性蛋白酶酶解產物分子質量最大在14ku左右,酶解24h后幾乎所有的亞基被酶解;而復合蛋白酶酶解時,不僅7S被酶解,11S也被酶解完全,酶解8h后,幾乎所有的大豆蛋白亞基被分解.因此,胃蛋白酶前處理可以提高大豆蛋白的酶解效果,特別是對堿性蛋白酶的協同作用較強.
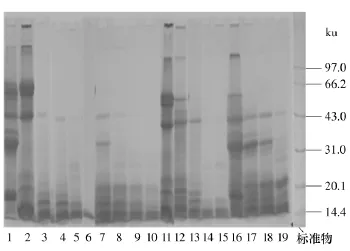
圖2 大豆蛋白酶解產物的SDS-PAGE圖譜Fig.2 SDS-PAGE patterns of soy protein hydrolysates
2.2 胃蛋白酶前處理對大豆蛋白回收率的影響
圖3給出了不同酶解處理對大豆蛋白回收率的影響.由圖3(a)可知,胃蛋白酶酶解2h的樣品蛋白回收率達到了56.8%,這是因為在酸性條件下,大豆蛋白發生亞基解離,蛋白緊密結構展開,在胃蛋白酶的作用下11S被迅速分解.繼續用堿性蛋白酶水解,隨著酶解時間的延長,蛋白回收率不斷提高,24h時達到95.4%,與單酶酶解相比,蛋白回收率提高了39.9%.圖3(b)中復合蛋白酶單獨酶解1h的樣品由于水解程度比較低,在滅酶后離心分離時未能離心出上清液,因而,無法準確測得其蛋白回收率.圖3(b)中復合蛋白酶酶解亦有與圖3(a)相同的趨勢,24h時回收率達到72.2%,蛋白回收率與單酶水解相比提高了19.4%.這表明,胃蛋白酶前處理可顯著提高這兩種酶的作用效果,特別是對堿性蛋白酶作用效果的增強更為明顯.
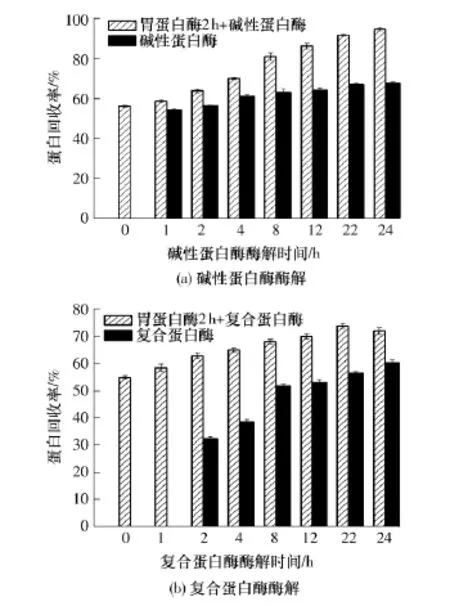
圖3 不同酶解處理對大豆蛋白回收率的影響Fig.3 Effect of different enzymatic treatment on soy protein recovery
2.3 胃蛋白酶前處理對大豆蛋白水解度的影響
圖4給出了不同酶解處理對大豆蛋白水解度的影響.從圖4可以看出,經過胃蛋白酶處理2 h后大豆蛋白水解度達到2.8%,說明胃蛋白酶酶解過程中大豆蛋白部分肽鍵斷裂,釋放出一些肽段或游離氨基酸,這與Kong等[14]的研究結果相似.從圖中還可以看出,隨著酶解時間的延長,蛋白水解度不斷增大.單獨使用堿性蛋白酶和復合蛋白酶對大豆蛋白酶解24h后,水解度分別達到17.0%和11.3%.而經過胃蛋白酶處理2 h后再用這兩種蛋白酶進行酶解,可提高大豆蛋白水解度,分別達到23.1%和12.2%,與未使用胃蛋白酶前處理相比分別提高了35.9%和8.0%;其中復合蛋白酶酶解水解度提高不顯著,這可能與該酶作用的特異性有關.胃蛋白酶前處理后水解度提高的原因是:pH=2.0條件下,大豆蛋白發生亞基解離,在胃蛋白酶作用下,部分肽鍵斷開,分子結構展開,暴露出更多的酶作用位點,從而有利于大豆蛋白的進一步酶解,增強了酶解效率和酶解敏感性.對比圖4(a)和4(b)可知,堿性蛋白酶的作用效果明顯優于復合蛋白酶.
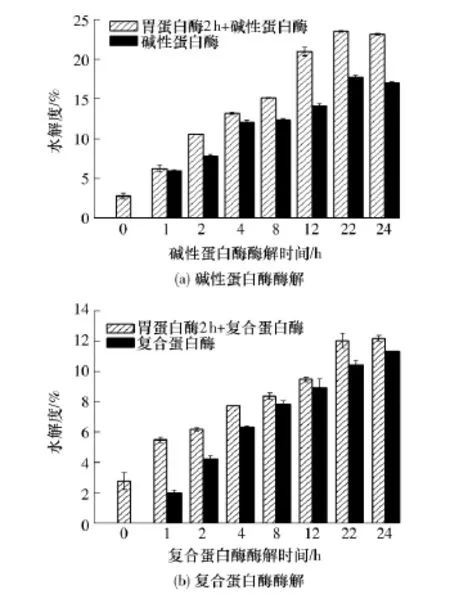
圖4 不同酶解處理對大豆蛋白水解度的影響Fig.4 Effect of different enzymatic treatment on degree of hydrolysis of soy protein
2.4 胃蛋白酶前處理對大豆蛋白抗氧化活性的影響
ORAC值法測定抗氧化活性的作用原理是一種經典的通過抑制氫轉移反應過程終止自由基鏈式反應.ORAC值法具有高度的靈敏性[15-16],其自由基來源為偶氮類化合物AAPH熱分解產生的過氧自由基,這些自由基與生命現象中的自由基具有高度的一致性.文中利用ORAC值法評價酶解產物的抗氧化活性.
圖5所示為不同酶解處理對大豆蛋白酶液抗氧化活性的影響.從圖5中可以看出,酶解產物的抗氧化能力均隨著酶解時間的延長呈現先上升后降低的趨勢.這是因為酶解過程中某分子質量段的肽段具有較強的抗氧化能力,酶解前期隨著這部分分子質量的肽段不斷增多,抗氧化性提高,而酶解后期隨著這部分分子質量的肽段逐漸被降解成更低分子質量的肽段或游離氨基酸,抗氧化性下降.這與任嬌艷等[17]的研究結果相似.未經酶解處理的大豆蛋白的ORAC值只有165.2,而經過胃蛋白酶處理2 h后的樣品,其ORAC值分別提高到431.7和407.4(見圖5).這說明胃蛋白酶處理所得產物具有一定的抗氧化活性.使用堿性蛋白酶和復合蛋白酶進行單酶酶解的樣品,抗氧化能力最強時都出現在12 h左右,分別達到778.5和715.4.而經過胃蛋白酶前處理后再用這兩種蛋白酶進行酶解,產物ORAC值都比未經過前處理的要高,最大值出現在8h處,達到1078.6和794.6,與單酶水解相比分別提高了38.5%和11.1%,這說明胃蛋白酶前處理可以提高大豆蛋白酶解產物的抗氧化性.同時,堿性蛋白酶酶解產物抗氧化性要高于復合蛋白酶的酶解產物,這可能與酶作用的特異性有關.因此,選擇堿性蛋白酶進一步酶解對增加大豆蛋白抗氧化性具有較好效果.
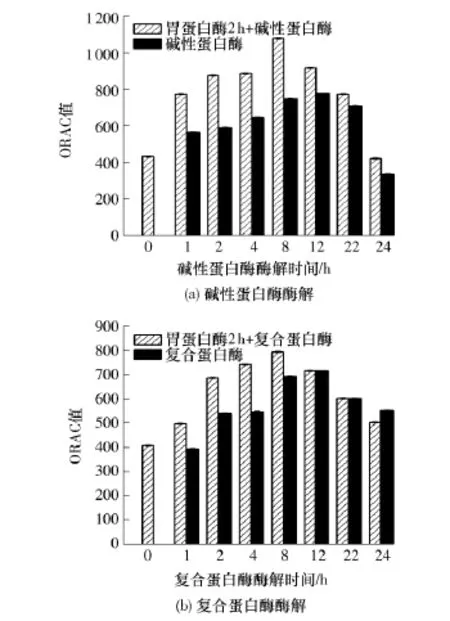
圖5 不同酶解處理對大豆蛋白酶解液抗氧化活性的影響Fig.5 Effect of different enzymatic treatment on ORAC value of soy protein hydrolysates
2.5 大豆蛋白酶解液的分子質量分布
從表1可以看出,隨著水解時間的延長,大分子組分(分子質量大于10ku)逐漸減少,小分子組分(分子質量小于5ku)逐漸增多;且經過胃蛋白酶前處理的樣品,其低分子質量肽段的含量明顯高于單酶酶解的樣品.表1中復合蛋白酶單酶水解1h的產物由于未分離出上清液而未測得其分子質量分布.胃蛋白酶水解2h后分子質量小于5ku的組分含量達到44.1%,這是因為在酸性條件下胃蛋白酶水解了11S,產生了一定量的小分子組分.繼續用堿性蛋白酶和復合蛋白酶酶解,大分子組分(分子質量大于10ku)含量不斷減少,從29.1%分別下降到5.5%和9.0%,而小分子組分(分子質量小于5ku)逐漸增多,在24h時含量分別達到85.4%和78.6%.這說明,用這兩種酶繼續酶解可使大豆蛋白進一步降解.同時,與單酶酶解相比,經過胃蛋白酶前處理的產物中分子質量大于10ku的組分明顯降低,而分子質量小于5 ku的組分顯著增加(在24h時分別增加了7.6%和17.6%).這表明,胃蛋白酶前處理能促進大豆蛋白的進一步酶解.
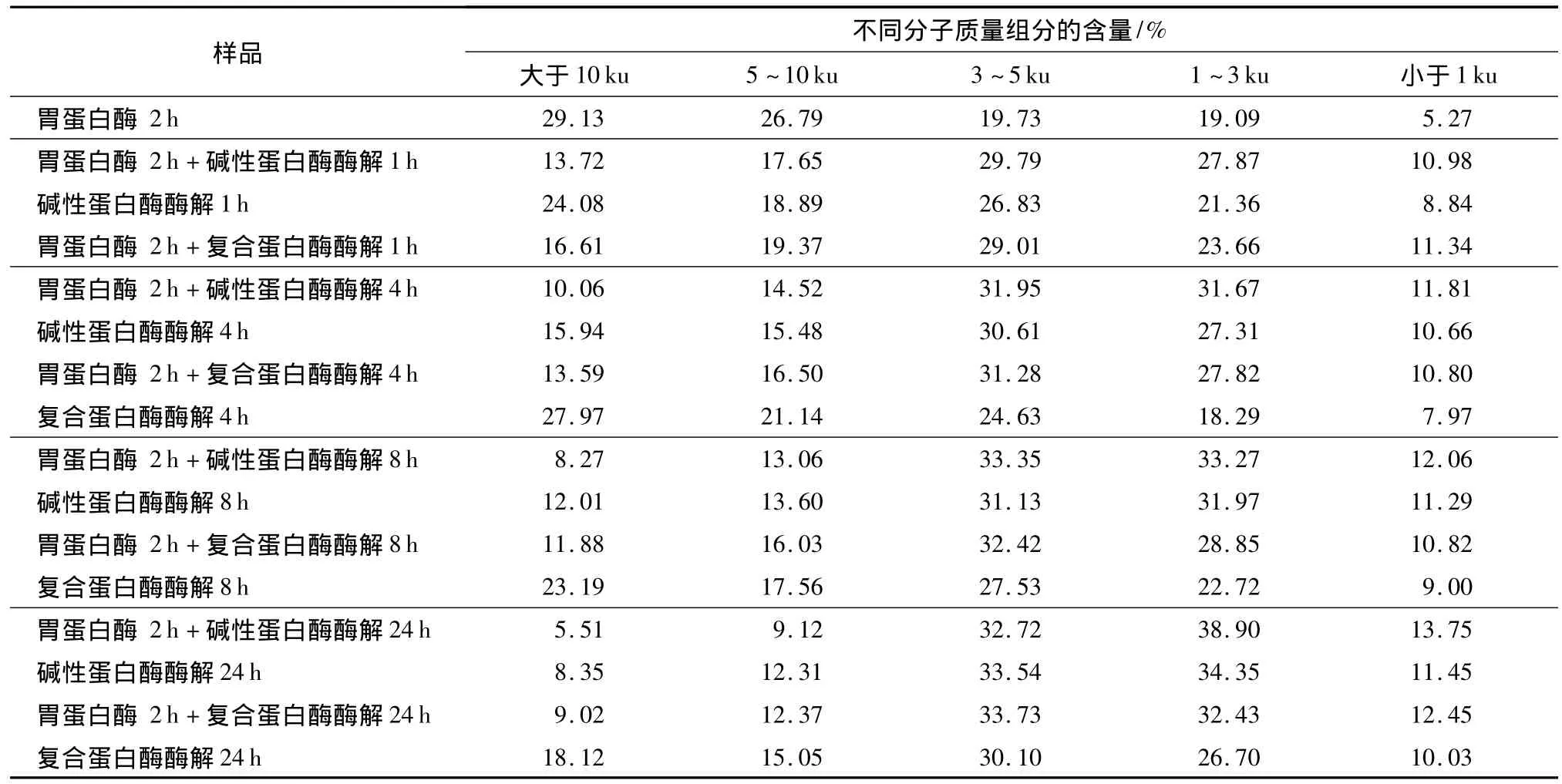
表1 不同酶解處理產物的分子質量分布Table 1 Molecular weight distribution of hydrolysates by different enzymatic treatment
3 結論
(1)胃蛋白酶前處理可使大豆蛋白回收率和水解度顯著增加,提高大豆蛋白對堿性蛋白酶、復合蛋白酶的酶解敏感性,這說明胃蛋白酶與堿性蛋白酶和復合蛋白酶具有協同增效作用,特別是對堿性蛋白酶的提高效果更明顯.
(2)胃蛋白酶前處理后的酶解產物ORAC值(即抗氧化值)得到提高,最高可達到1078.6,這說明,胃蛋白酶前處理可提高酶解產物中大豆肽的抗氧化活性.
(3)對酶解產物的SDS-PAGE凝膠電泳分析和分子質量分布分析可知,胃蛋白酶前處理可加快酶解過程,有利于小分子肽的生成.
[1]李榮和.大豆新加工技術原理與應用[M].北京:科學技術文獻出版社,1999:40-57.
[2]Iwabuchi S.Thermal denaturation of β-conglycinin [J].Journal of Agricultural and Food Chemistry,1991,39(1):27-32.
[3]胡愛軍,鄭捷.大豆蛋白酶解技術比較[J].精細化工,2005,22(6):461-463.Hu Ai-jun,Zheng Jie.Comparison of enzymatic hydrolysis technologies of soybean protein [J].Fine Chemical Engineering,2005,22(6):461-463.
[4]Fisher A V.A review of the technique of estimating the composition of livestock using the velocity of ultrasound[J].Computers and Electronics in Agriculture,1997,17(10):217-231.
[5]Tang S H,Navam S.Protein extraction from heat-stabilized defatted rice bran.1 physical processing and enzyme treatments[J].Journal of Agricultural and Food Chemistry,2002,50(25):7444-7448.
[6]源博恩,趙強忠,趙謀明.酸性條件下高壓均質對大豆蛋白結構與功能特性的影響[J].食品工業科技,2012,33(8):79-82.Yuan Bo-en,Zhao Qiang-zhong,Zhao Mou-ming.Effects of high-pressure homogenization in acid condition on the structure and functional properties of soybean proteins[J].Science and Technology of Food Industry,2012,33(8):79-82.
[7]Kazunobu T.Improvement of the physicochemical properties of soybean proteins by enzymatic hydrolysis[J].Food Science and Technology Research,2009,15(4):381-388.
[8]劉曉毅,薛文通,胡小蘋,等.酶解法專一性去除大豆7S球蛋白中的 α-亞基[J].食品科技,2005,8(8):16-18.Liu Xiao-yi,Xue Wen-tong,Hu Xiao-ping,et al.Special removal α-subunit of 7S globulin from soybean by enzymatic hydrolysis[J].Food Technology,2005,8(8):16-18.
[9]Luo Donghui,Zhao Qiangzhong,Zhao Mouming,et al.Effect of limited proteolysis and high-pressure homogenisation on structural and functional characteristics of glycinin [J].Food Chemistry,2010,122(1):25-30.
[10]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J].Nature,1970,227(5259):680-685.
[11]趙新淮,馮志彪.蛋白質水解物水解度的測定[J].食品科學,1994,1(11):65-67.Zhao Xin-huai,Feng Zhi-biao.The measurement of the degree of protein hydrolysates[J].Food Science,1994,1(11):65-67.
[12]Nielsen P M,Petersen D,Dambmann C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66(5):642-646.
[13]Hernández L B,Amigo L,Recio I,et al.ACE-inhibitory and radical-scavenging activity of peptides derived from beta-lactoglobulin f(19-25).Interactions with ascorbic acid[J].Journal of Agricultural and Food Chemistry,2007,55(9):3392-3397.
[14]Kong Xiangzhen,Zhou Huiming,Qian Haifeng.Enzymatic preparation and functional properties of wheat gluten hydrolysates[J].Food Chemistry,2007,101(2):615-620.
[15]Prior R L,Wu X L,Schaich K.Standardized methods for the determination of antioxidiant capacity and phenolics in foods and dietary supplements[J].Journal of Agricultural and Food Chemistry,2005,53(10):4290-4302.
[16]續潔琨,姚新生,栗原博.抗氧化能力指數(ORAC)測定原理及應用[J].中國藥理學通報,2006,22(8):1015-1021.Xu Jie-kun,Yao Xin-sheng,Li Yuan-bo.Oxygen radical absorbance capacity assay and its application [J].Chinese Pharmacological Bulletin,2006,22(8):1015-1021.
[17]任嬌艷,鄭賽晶,劉百戰,等.花生抗氧化肽的制備及其在卷煙濾嘴中的應用[J].現代食品科技,2011,27(9):1084-1089.Ren Jiao-yan,Zheng Sai-jing,Liu Bai-zhan.Preparation of antioxidant peptides from peanut protein and their application as cigarette tip additives[J].Modern Food Science and Technology,2011,27(9):1084-1089.

