低營養產絮菌Rheinheimera aquimaris P6的分離篩選及其絮凝特性研究
劉春爽,趙東風,國亞東,蔡 蕓,張云波
(中國石油大學化學化工學院,山東 青島 266555)
生物絮凝劑作為一種安全、高效、無二次污染、易生物降解的新型藥劑,在水處理領域應用前景廣闊[1],但存在生產成本高、用量大的缺點,難以實現規模化應用[2]。因此,分離篩選高效的產絮菌種成為降低生物絮凝劑生產成本的重要途徑。
目前,人們已分離篩選出多種產絮菌,如Bacillussp. F19[3]、ProteusmirabilisTJ-1[4]、Bacillusfirmus[5]等均具有較高的產絮能力,所產絮凝劑的絮凝率在90%以上。然而,這些產絮菌的產絮條件大都為富營養條件,如Bacillussp.F19所需底物為20 g·L-1蔗糖、2.5 g·L-1酵母膏;ProteusmirabilisTJ-1所需底物為10 g·L-1葡萄糖、1.0 g·L-1蛋白胨;Bacillusfirmus所需底物為20 g·L-1葡萄糖、5.0 g·L-1蛋白胨,這無形中增加了生物絮凝劑的生產成本。若能分離篩選低營養條件下的高效產絮菌,優化其產絮條件,從源頭降低絮凝劑生產成本,對于推動我國生物絮凝劑的工業化應用具有非常重大的理論價值和現實意義。
基于此,作用采用低營養培養基從海洋底泥中分離篩選高效產絮菌株,優化產絮條件,并通過紫外光譜、蛋白和糖顯色反應、紅外光譜等手段分析低營養條件下所得絮凝劑的組成及結構特征,擬為降低生物絮凝劑的生產成本提供參考。
1 實驗
1.1 產絮菌的分離篩選
采用平板劃線分離法,以海洋底泥為接種物、以低營養培養基為篩選培養基,經多次純化后得到高效產絮菌。
低營養培養基:葡萄糖0.5 g·L-1,淀粉0.5 g·L-1,酵母膏0.5 g·L-1,蛋白胨0.5 g·L-1,酪蛋白0.5 g·L-1,K2HPO40.3 g·L-1,MgSO4·7H2O 0.05 g·L-1,NaCl 10 g·L-1,pH值7.6。
1.2 生物絮凝劑樣品的制備
將制取的生物絮凝劑發酵液在12 000 r·min-1、4 ℃下離心20 min。取上清液濃縮至體積減半,加入3 BV 4 ℃預冷的無水乙醇,振蕩至出現白色絮體。常溫、5000 r·min-1離心15 min,用無水乙醇洗滌沉淀,溶于少量蒸餾水中,加入3 BV 4 ℃預冷的無水乙醇,振蕩后于5000 r·min-1、常溫離心15 min,反復2次,將沉淀于40 ℃真空干燥得生物絮凝劑樣品。
1.3 絮凝效果的測定
絮凝效果采用高嶺土評價方法[6]測定,用絮凝率(μ)表征:
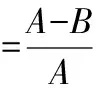
式中:A為空白水樣上清液的濁度;B為待測水樣上清液的濁度。
1.4 分析檢測
生物絮凝劑的紫外光譜分析、蛋白和糖顯色反應分析參照文獻[7,8]。
生物絮凝劑的紅外光譜分析:取1 mg生物絮凝劑樣品與150 mg KBr粉末放入瑪瑙研缽中在紅外燈下輕輕研磨,經壓片機壓成薄片,上機測定,在500~4000 cm-1掃描。
水中油含量:采用萃取-紅外分光光度法(GB/T 16488-1996)[9]測定。
2 結果與討論
2.1 產絮菌的分離篩選
采用低營養培養基,經過多次稀釋平板分離和平板劃線純化,從海洋底泥中篩選出絮凝率在80%以上的菌株7株,其中一株命名為P6的菌株菌落特征為橙黃色、圓形、光滑,發酵液特別粘稠,絮凝效果較好,絮凝率在85%左右。因此,選擇此菌株進行進一步實驗,研究其發酵產絮特性。該菌為球狀,革蘭氏陰性,屬好氧細菌。經PCR擴增后,將16S rDNA測序結果與Genbank數據庫里的序列進行比對,發現與Rheinheimeraaquimaris相似度最高,達99%。因此,P6菌株和其所產絮凝劑被分別命名為RheinheimeraaquimarisP6和 MBF-P6。
2.2 影響Rheinheimera aquimaris P6產絮的關鍵因素
2.2.1 培養基組成
不同的碳源和氮源對RheinheimeraaquimarisP6產絮能力有不同的影響。分別以葡萄糖、淀粉、蔗糖、檸檬酸三鈉、乙酸鈉、果糖、乳糖、木糖、乙醇作為碳源,以尿素、NH4Cl、NaNO3、酵母膏、蛋白胨、酪蛋白作為氮源,經相同條件發酵后,測定絮凝率,結果見圖1。
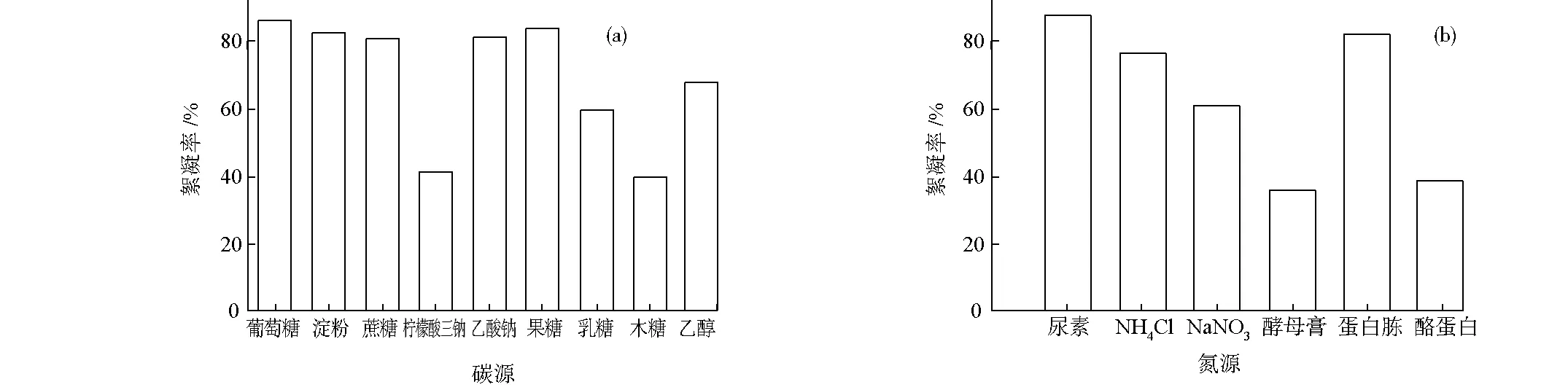
圖1 不同碳源(a)和氮源(b)對Rheinheimera aquimaris P6產絮效果的影響
由圖1可看出,價格低廉的葡萄糖作為碳源、尿素作為氮源時所產絮凝劑的絮凝效果最好。
碳氮比對RheinheimeraaquimarisP6產絮效果的影響見圖2。
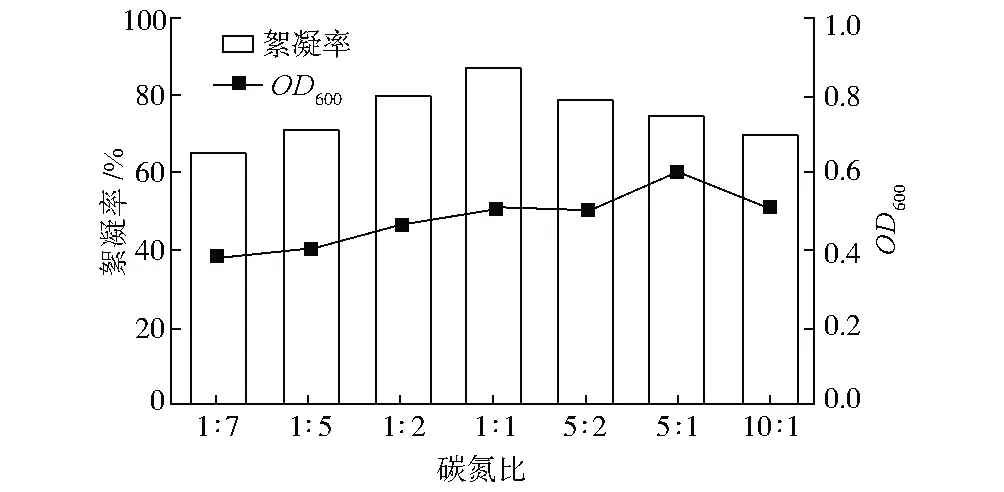
圖2 碳氮比對Rheinheimera aquimaris P6產絮效果的影響
由圖2可看出,碳氮比為1∶1時,RheinheimeraaquimarisP6的絮凝率最高,產絮效果最好;碳氮比高于或低于1∶1都會導致絮凝效果變差。由圖2還可看出,當碳氮比為5∶1(葡萄糖10 g·L-1,尿素2 g·L-1)時細胞生長最好,但絮凝效果較差。
RheinheimeraaquimarisP6在含有1.5 g·L-1葡萄糖和1.5 g·L-1尿素的培養基中培養48 h后絮凝率達到最高,為87.32%。與現有產絮菌Bacillussp.F19[3]、ProteusmirabilisTJ-1[4]、Bacillusfirmus[5]相比,RheinheimeraaquimarisP6的產絮成本(培養基費用)降低50%~80%。
2.2.2 初始pH值
以1.5 g·L-1葡萄糖作為碳源、1.5 g·L-1尿素作為氮源,調整初始pH值為3~10,考察其對RheinheimeraaquimarisP6產絮效果的影響,結果見圖3。
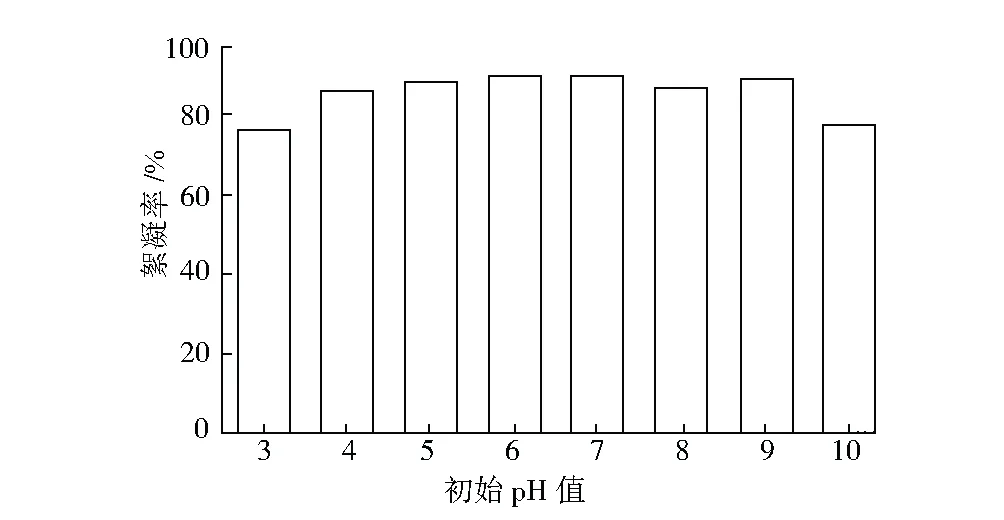
圖3 初始pH值對Rheinheimera aquimaris P6產絮效果的影響
由圖3可看出,培養基初始pH值為4~9時,發酵液的絮凝率均在85%以上;當pH值為7時,絮凝率達到最高,為89.39%;過低或過高的pH值均對RheinheimeraaquimarisP6產絮有抑制作用。表明RheinheimeraaquimarisP6對環境中pH值要求不嚴格,易于培養。
2.2.3 金屬離子
0.2 g·L-1的Ca2+、Ba2+、Mg2+、Mn2+、Fe2+、Al3+、Zn2+、Cu2+對RheinheimeraaquimarisP6產絮效果的影響見圖4。
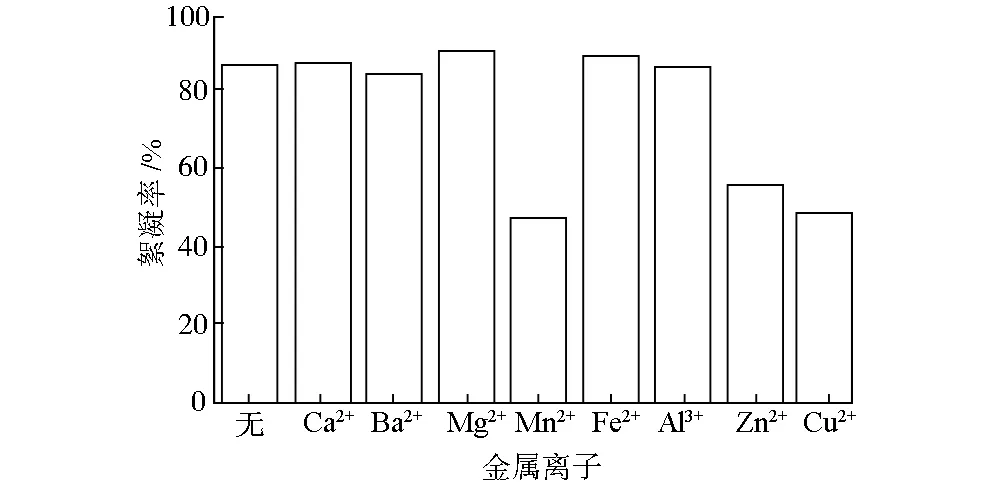
圖4 金屬離子對Rheinheimera aquimaris P6產絮效果的影響
由圖4可看出,不同的金屬離子對RheinheimeraaquimarisP6產絮效果的影響不同。Mg2+、Fe2+對菌株RheinheimeraaquimarisP6產絮能力有促進作用,而Mn2+、Zn2+、Cu2+則有明顯的抑制作用。這可能是由于,Mg2+是構成細菌體內某些酶的活性成分,并對微生物細胞結構如核糖體、細胞膜等的穩定性起著重要作用,Mg2+的加入有助于促進胞外聚合物中多糖的生成,從而增加絮凝劑產量[10];Fe2+是微生物生長所必需的元素,是細胞色素、細胞色素氧化酶和過氧化氫酶的活性基及鐵卟啉的組成部分,Fe2+濃度適宜時,酶合成效果較好,從而使得絮凝劑產量明顯增加;而Mn2+、Zn2+、Cu2+是重金屬,對微生物具有毒害作用,抑制絮凝劑的產生。
2.2.4 最佳產絮效果
在1.5 g·L-1葡萄糖為碳源、1.5 g·L-1尿素為氮源、培養基初始pH值為7、投加0.2 g·L-1Fe2+的最佳培養條件下,RheinheimeraaquimarisP6所產絮凝劑的絮凝率達到90.2%。可見RheinheimeraaquimarisP6是一株產絮性能穩定的高效產絮菌株。
2.3 生物絮凝劑的組成及結構特征
提取RheinheimeraaquimarisP6發酵液粗產品,在200~600 nm范圍內進行紫外掃描。結果表明,紫外掃描曲線在260 nm處無吸收峰,但在280 nm和200 nm處有吸收峰,這說明絮凝劑中幾乎不含核酸,但含有蛋白質和糖類。因此可以定性判斷該絮凝劑的有效成分是蛋白質和糖類。
經茚三酮、蒽酮等顯色劑進行生化反應分析,進一步確定RheinheimeraaquimarisP6所產絮凝劑中含有蛋白質和多糖。
生物絮凝劑樣品的紅外光譜見圖5。

圖5 Rheinheimera aquimaris P6所產生物絮凝劑的紅外光譜
由圖5可看出,3414.46 cm-1處寬而強的特征吸收峰是由O-H鍵的伸縮振動引起的,可知該絮凝劑結構中必然含有大量的-OH;2960.87 cm-1和2930.73 cm-1處的2個吸收峰是由飽和C-H鍵的伸縮振動引起的,并且同時存在-CH3和-CH2-;1700~1600 cm-1間的強吸收峰是由C=O鍵伸縮振動引起的;1000 cm-1附近出現的強吸收峰是由C-O鍵伸縮振動引起的,由此可判定該絮凝劑結構中存在-COOH;1026.09 cm-1和1069.82 cm-1處出現2個吸收峰,判斷還存在另外一種C-O鍵,應為C-O-C中的C-O鍵伸縮振動引起的。因此,可以確定RheinheimeraaquimarisP6所產絮凝劑的活性成分中含有多糖物質。
用考馬斯亮蘭、蒽酮法測定發酵液粗產品中多糖和蛋白質含量。結果表明,RheinheimeraaquimarisP6所產絮凝劑含47.9%蛋白質、47.3%糖,約為1∶1。
3 結論
(1)利用低營養培養基從海洋底泥中篩選到一株高效產絮菌株P6,經16S rDNA鑒定其為Rheinheimeraaquimaris菌屬。
(2)RheinheimeraaquimarisP6 產絮最適碳氮源為1.5 g·L-1葡萄糖和1.5 g·L-1尿素,最佳初始發酵pH值為7,在添加0.2 g·L-1Fe2+的條件下,所產絮凝劑的絮凝率達90.2%,與現有產絮菌株相比,絮凝劑生產成本降低50%~80%。
(3)菌株RheinheimeraaquimarisP6所產絮凝劑含有-OH、C-H、C-O和C=O鍵,由蛋白質和多糖組成,含量分別為47.9%、47.3%,蛋白質和多糖比例約為1∶1。
(4)本研究為從源頭降低絮凝劑生產成本、推動我國生物絮凝劑的工業化應用提供了重要的信息。
參考文獻:
[1] He N,Li Y,Chen J.Production of a novel polygalacturonic acid bioflocculant REA-11 byCorynebacteriumglutamicum[J].Bioresource Technology,2004,94(1):99-105.
[2] 馬放,張惠文,李大鵬,等.以稻草秸稈為底物制取復合型生物絮凝劑的研究[J].中國環境科學,2009,29(2):196-200.
[3] Zheng Y,Ye Z L,Fang X L,et al.Production and characteristics of a bioflocculant produced byBacillussp.F19[J].Bioresource Technology,2008,99(16):7686-7691.
[4] Xia S Q,Zhang Z Q,Wang X J,et al.Production and characterization of a bioflocculant byProteusmirabilisTJ-1[J].Bioresource Technology,2007,99(14):6520-6527.
[5] Salehizadeh H,Shojaosadati S A.Removal of metal ions from aqueous solution by polysaccharide produced fromBacillusfirmus[J].Water Research,2003,37(17):4231-4235.
[6] 朱艷彬,馬放,黃君禮,等.生物絮凝劑絮凝特性與絮凝條件優化研究[J].中國給水排水,2006,22(3):4-8.
[7] Salehizadeh H,Shojaosadati S A.Extracellular biopolymeric flocculants.Recent trends and biotechnological importance[J].Biotechnology Advances,2001,19(5):371-385.
[8] Oh H M,Lee S J,Park M H,et al.Harvesting ofChlorellavulgarisusing a bioflocculant fromPaenibacillussp.AM49[J].Biotechnology Letters,2001,23(15):1229-1234.
[9] 劉倩倩,李小明,楊麒,等.Mg2+對SBR 中好氧顆粒污泥培養的影響研究[J].中國給水排水,2008,24(17):31-35.
[10] 馬濤,趙朝成,劉芳,等.循環冷卻水水質對生物粘泥活性的影響研究[J].中國給水排水,2011,27(1):88-91.

