光譜法研究Zn(Ⅱ)存在下環丙沙星與DNA的相互作用
付彩霞,劉明鷺,張懷斌,高宗華
(濱州醫學院化學教研室,山東 煙臺 264003)
DNA是重要的生物大分子,是體內抗癌藥物的主要作用標靶。藥物與DNA作用能不同程度地影響DNA的復制和合成,從而抑制癌細胞的惡性生長。因此,通過研究藥物與DNA的作用,可獲得更方便的檢測方法,使藥物的初步篩選更加有效。DNA和金屬配合物及藥物分子的相互作用研究是近年來活躍的前沿研究領域之一[1]。
由于喹諾酮藥物可能產生長期的遺傳毒性,喹諾酮藥物與真核生物DNA間相互作用的研究已受到廣泛的重視[2]。環丙沙星(CPFX)為合成的第三代喹諾酮類抗菌藥物,具廣譜抗菌活性,殺菌效果好。Zn2+是存在于人體中的重要生物離子。雖然環丙沙星與金屬的配位行為和生物活性已有研究[3,4],但對Zn(Ⅱ)存在下環丙沙星與DNA的結合研究相對較少。作者在此用紫外光譜法和熒光光譜法研究了模擬生理條件下、Zn(Ⅱ)存在下環丙沙星與鯡魚精DNA的相互作用,擬為研究環丙沙星的作用機理及可能產生的毒副作用提供參考依據。
1 實驗
1.1 試劑與儀器
鯡魚精DNA、三羥甲基氨基甲烷(Tris,分析純),北京拜爾迪生物技術有限公司;環丙沙星,中國藥品生物制品檢定所。
用0.05 mol·L-1pH值7.4的Tris-HCl緩沖溶液(內含0.1 mol·L-1NaCl維持離子強度)配制濃度為1.0×10-5mol·L-1鯡魚精DNA儲備溶液;環丙沙星配制成1.0×10-6mol·L-1的儲備溶液;其它試劑均為分析純;實驗用水為二次蒸餾水,無熒光雜質。
pH-3C型酸度計,上海逸龍科技有限公司;電熱恒溫水浴鍋,上海實驗儀器廠有限公司;KQ-500B型超聲波清洗器,昆山超聲儀器有限公司;AR1140型電子分析天平,美國奧豪斯電子天平公司;LS-55型熒光分光光度計,美國PE公司;TU-1901型雙光束紫外可見分光光度計,北京普析通用儀器有限責任公司。
1.2 方法
1.2.1 紫外吸收光譜的測定
固定CPFX的濃度為1.0×10-6mol·L-1,用微量注射器加入1.0×10-5mol·L-1DNA與1.0×10-4mol·L-1Zn2+溶液各50 μL,記錄待測溶液在200~400 nm的紫外吸收光譜。以空白試劑為參比。
1.2.2 熒光發射光譜的測定
在1 cm比色皿中加入3.00 mL CPFX溶液,用微量注射器逐次加入1.0×10-5mol·L-1的DNA溶液進行滴定,搖勻,靜置5 min,在21 ℃下掃描熒光發射光譜,激發波長為280 nm。
將DNA在沸水浴中加熱15 min后迅速放入冰水浴中冷卻15 min,同上掃描熒光發射光譜。
固定CPFX和Zn2+的濃度,改變DNA的濃度,同上掃描熒光發射光譜。
2 結果與討論
2.1 Zn2+和DNA存在下環丙沙星的紫外吸收光譜
加入Zn2+后,CPFX和CPFX-DNA的紫外吸收光譜如圖1所示。

1~4:CPFX,CPFX+DNA,CPFX+Zn2+,CPFX+DNA+Zn2+ cCPFX=1.0×10-6mol·L-1,cDNA=1.6×10-7mol·L-1,cZn2+=1.6×10-6mol·L-1
由圖1可知,CPFX在270 nm和320 nm處有最大吸收,Zn2+的加入對CPFX與鯡魚精DNA的結合反應有很大的影響,最大吸光度增大,最大吸收波長紅移(特別是320 nm處)。說明DNA與CPFX-Zn2+之間的結合不符合靜電式結合,應為嵌入式或溝槽式結合[5]。
2.2 Zn2+和DNA存在下環丙沙星的熒光發射光譜(圖2)
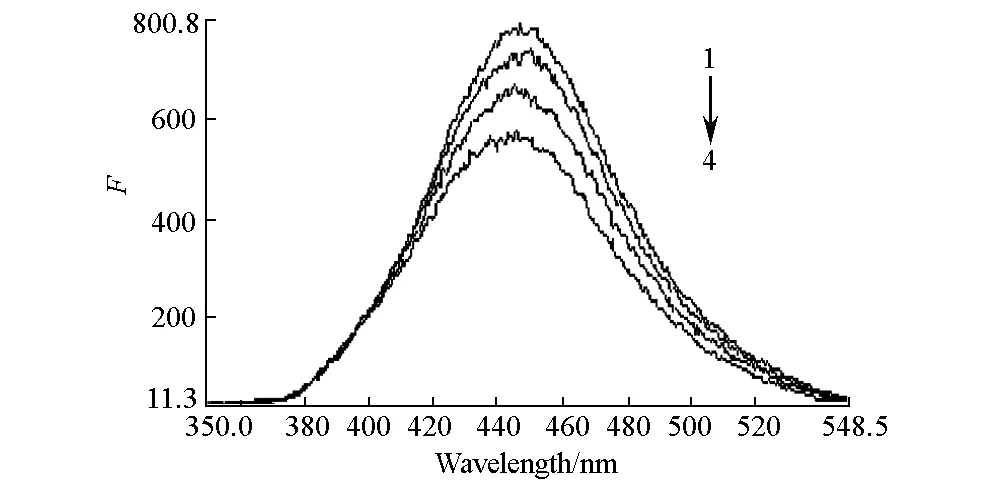
1~4:CPFX,CPFX+DNA,CPFX+Zn2+,CPFX+DNA+Zn2+ cCPFX=1.0×10-6mol·L-1,cDNA=1.6×10-7mol·L-1,cZn2+=1.6×10-6mol·L-1
由圖2可知,CPFX的熒光峰在447 nm處,分別加入Zn2+和相同濃度的DNA后,CPFX的熒光峰位置不變,但是熒光強度明顯降低。說明CPFX與DNA、Zn2+均發生了相互作用;當Zn2+和DNA同時存在時,CPFX熒光強度降低的程度更大,表明Zn2+和DNA 對CPFX熒光具有協同猝滅作用,可以推斷CPFX、Zn2+和DNA之間形成了三元絡合物。
2.3 DNA對CPFX的熒光猝滅機理
熒光猝滅可由Stern-Volmer方程[6,7]表示:
F0/F=1+KSVcDNA
式中:F和F0為有無DNA時的熒光強度;cDNA為DNA濃度;KSV為猝滅常數。
DNA對CPFX熒光強度的影響見表1。
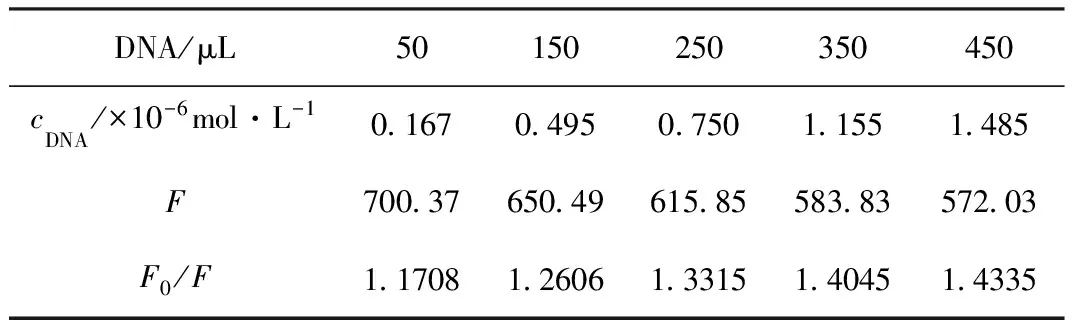
表1 DNA對CPFX熒光強度的影響
由表1可知,隨著CPFX中DNA的加入,F0/F的數值不斷增大,即CPFX的最大熒光發射峰強度逐漸降低,表明DNA的加入對CPFX有熒光猝滅作用。
以F0/F為縱坐標、cDNA為橫坐標作圖,結果如圖3所示。
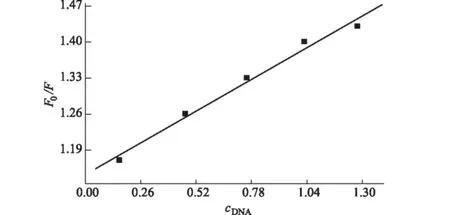
圖3 F0/F與cDNA的關系圖
由圖3可知,曲線線性關系良好,相關系數為0.9929,由曲線斜率計算得KSV=2.07×105L· mol-1。
熒光猝滅的機理很多,常見的有由于猝滅劑與熒光物質之間的碰撞引起的動態猝滅及形成基態復合物而引起的靜態猝滅等。如果按動態猝滅處理,則猝滅方程可由下式表示:F0/F=1+Kqτcq,式中:Kq為雙分子猝滅過程速率常數,τ為猝滅劑不存在時熒光分子的平均壽命,約為10-8s,cq為猝滅劑的濃度。計算得到DNA對CPFX的速率常數Kq為2.07×1013L· mol-1·s-1,遠大于小分子與生物大分子之間最大的擴散控制的碰撞常數2×1010L· mol-1·s-1。由此判斷DNA對CPFX的猝滅作用不是動態猝滅,而是形成基態復合物的靜態猝滅。
2.4 CPFX-DNA、CPFX-Zn2+二元絡合物的組成及結合常數
根據靜態猝滅理論和lg[(F0-F)/F]=lgKA+nlgcq(KA為CPFX與猝滅劑之間的結合常數,n為結合位點數),分別作出CPFX-DNA、CPFX-Zn2+體系的雙倒數關系圖,并通過斜率和截距求出CPFX與猝滅劑之間的結合常數和結合位點數,見表2。

表2 CPFX與DNA或Zn(Ⅱ)的結合常數和結合位點數KA
由表2可知,CPFX-DNA、CPFX-Zn2+的結合常數和結合位點數均較小,說明CPFX與DNA、CPFX與Zn2+相互作用都很微弱,但Zn2+存在時可能會對CPFX與DNA體系產生不可忽略的影響。
2.5 熱變性DNA 對環丙沙星熒光強度的影響
將DNA在沸水浴中加熱15 min后迅速放入冰水浴中冷卻15 min,變性得到的單鏈(ssDNA)對CPFX的熒光猝滅程度通常有所減小。這是因為熱變性能破壞DNA結構中堿基對的有序排列,并導致DNA解旋[8],但由于ssDNA是以線團狀形式存在于溶液中,在線團的表面形成了可以與小分子發生氫鍵作用的許多凹點,變性得到的ssDNA與dsDNA仍在一定濃度范圍內對CPFX-Zn2+的熒光強度有線性猝滅的作用。本實驗中變性DNA與CPFX反應,變性DNA和天然DNA對CPFX的作用能力幾乎一致。這進一步表明DNA與CPFX-Zn2+配合物是通過溝槽作用相互結合[9]。
2.6 Zn2+存在下DNA與環丙沙星的結合作用
為了進一步探討Zn2+對CPFX與DNA結合作用的影響,研究了在兩種不同濃度Zn2+的存在下,CPFX與DNA之間的結合常數KA和結合位點數n的變化情況。以lg[(F0-F)/F]對lgcDNA作圖,并通過斜率和截距求出CPFX與猝滅劑之間的結合常數和結合位點數,見表3。

表3 不同濃度Zn2+存在下CPFX與DNA的結合常數及結合位點數
由表3可知,當Zn2+存在時,導致了CPFX與DNA強烈作用,生成穩定的基態絡合物;并且隨Zn2+濃度的增大,環丙沙星與DNA的作用變得稍弱,即Zn2+在一定的濃度范圍內對CPFX與DNA的結合具有促進作用。
3 結論
在模擬生理條件下,用紫外光譜法和熒光光譜法研究了Zn(Ⅱ)存在下DNA與CPFX的相互作用及其作用機理,發現Zn(Ⅱ)在一定濃度范圍內對DNA與環丙沙星的結合具有促進作用。DNA與CPFX-Zn2+配合物之間的結合應為溝槽式結合。
參考文獻:
[1] 李來生,王麗蘋,黃偉東,等.熒光法研究金屬絡合物與脫氧核糖核酸相互作用[J].分析化學,2002,30(6):675-679.
[2] 童裳倫,張曉翔.氧氟沙星和左氧氟沙星與DNA的相互作用研究[J].光譜學與光譜分析,2010,30(2):481-485.
[3] 史維維,陳威,雷群芳,等.氧氟沙星鋅配合物的結構、光譜性質與抗菌活性[J].浙江大學學報(理學版),2011,38(1):68-77.
[4] 孫春燕,平紅,李宏坤,等.釔(Ⅲ)環丙沙星配合物的熒光性質及其應用[J].發光學報,2010,31(5):646-650.
[5] 劉煒,畢和平,張連華.環丙沙星與Fe3+及DNA相互作用的光譜研究[J].海南師范大學學報(自然科學版),2009,22(1):45-48.
[6] 陳國珍,黃賢智,鄭朱梓,等.熒光分析法(第二版)[M].北京:科學出版社,1990:64-86.
[7] 楊曼曼,席小莉,楊頻.變溫下熒光猝滅和加強理論公式合理性的比較[J].化學學報,2006,64(14):1437-1445.
[8] 鄭朝華,葉寶芬,杜迎翔,等.左氧氟沙星與小牛胸腺DNA相互作用的熒光光譜法研究[J].中國醫藥工業雜志,2004,35(12):740-743.
[9] 鐘學智,倪永年,林黛琴.諾氟沙星-Cu(Ⅱ)-DNA三元絡合物的光譜[J].南昌大學學報(理科版),2007,31(4):345-350.

