從大量鉬酸鹽溶液中分離微量鎢的研究
郭金亮,馬高峰,白宏斌,王偉,李偉,謝亞寧,王子川,馮寶奇
(西部鑫興金屬材料有限公司,陜西洛南726100)
鉬是一種不可再生的戰(zhàn)略性資源,具有許多優(yōu)良的物理和化學(xué)性能,廣泛應(yīng)用于鋼鐵、化工、有色冶金、機(jī)械加工、航天航空、生物醫(yī)藥、農(nóng)業(yè)等領(lǐng)域。鉬的物理和化學(xué)性能很大程度上取決于其純度。鉬和鎢應(yīng)受“鑭系收縮”的影響,其結(jié)構(gòu)和化學(xué)性質(zhì)極為相似,在礦物中常伴生存在,難以實(shí)現(xiàn)相互分離。長(zhǎng)期以來(lái),國(guó)內(nèi)外科學(xué)家圍繞鎢鉬分離做了大量的研究工作,分離方法可概括有沉淀法、萃取法、離子交換法等。
現(xiàn)在研究最多且行之有效的無(wú)機(jī)物分離提純方法之一是離子交換法。鉬、鎢都是兩性元素,因此在溶液中的存在形式,隨著pH值的變化而發(fā)生很大的變化。這些離子的結(jié)構(gòu)隨溶液中pH值變化而變化,所帶的電荷數(shù)量與符號(hào)也不相同。由于目前離子交換樹(shù)脂種類繁多,完全可以在特定pH值條件下通過(guò)多組篩選性實(shí)驗(yàn)找出一種對(duì)微量鎢有足夠高吸附容量同時(shí)對(duì)鉬吸附容量很小的離子交換樹(shù)脂;同時(shí),鎢開(kāi)始聚合的pH值高于鉬,而聚合的陰離子通常比單體陰離子更容易被吸附,并且含多個(gè)有機(jī)配體的鎢絡(luò)合物的穩(wěn)定性比鉬絡(luò)合物好。因此,采用離子交換法分離鉬溶液中的微量鎢成為可能。
目前,利用鎢鉬化合物性質(zhì)的差異,從鉬酸鹽溶液中分離微量鎢仍處于實(shí)驗(yàn)研究階段,在生產(chǎn)實(shí)踐中獲得成功應(yīng)用的還很少。但是隨著科學(xué)技術(shù)的不斷發(fā)展進(jìn)步,科學(xué)家以及廣大科研工作者的共同努力,會(huì)涌現(xiàn)出越來(lái)越多且更加成熟可靠的鉬酸鹽溶液中除去微量鎢的工藝。
在目前所研究從鉬酸鹽溶液中分離微量鎢的方法中,吸附沉淀法操作最簡(jiǎn)單,但是除鎢效果差,達(dá)不到理想要求。萃取法不僅操作復(fù)雜而且有機(jī)相不穩(wěn)定,不利于工業(yè)生產(chǎn)。離子交換法,特別是陰離子樹(shù)脂吸附除鎢,效果較好,鉬酸鹽溶液不需特別處理,在特定的pH值條件下便能實(shí)現(xiàn)對(duì)鎢酸根離子的優(yōu)先吸附,且解吸徹底,樹(shù)脂能重復(fù)使用,解吸的鎢鉬混合物可方便地予以回收利用,因此,是一種最有工業(yè)應(yīng)用前景的方法。
1 沉淀法
日本一家公司研制出從三氧化鉬中去除鎢的方法。這種方法首先將含有鎢雜質(zhì)的三氧化鉬用氨水溶解至澄清透明(pH值為6.5~7.5)得到每升含三氧化鉬200~500 g的溶液;將上述溶液調(diào)節(jié)pH值至2.5~3,將溶液加溫至50℃;溶液中緩慢析出的鉬酸銨晶體幾乎不含鎢[1]。該方法主要利用pH值在2.5~4.0范圍內(nèi)鎢轉(zhuǎn)化為水溶性大的偏鎢酸鹽,溶解在酸性溶液中,鉬生成溶解度較小的多鉬酸銨晶體析出,通過(guò)過(guò)濾,實(shí)現(xiàn)鎢鉬分離。
2 吸附法
2.1 新生態(tài)氫氧化鐵膠體吸附法
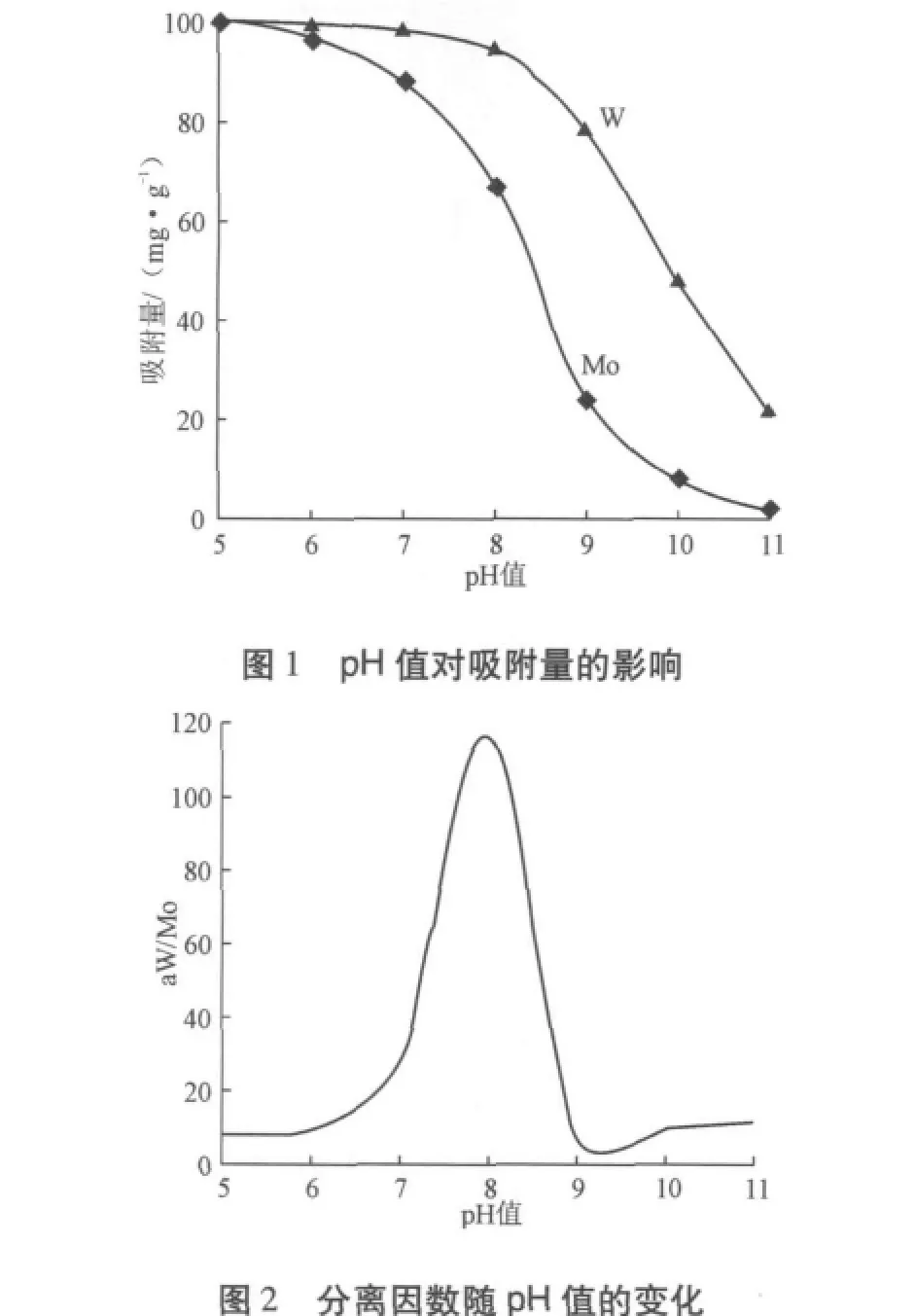
河南大學(xué)的黃普選等[2]研究了新生態(tài)氫氧化鐵從弱堿性鉬酸鹽溶液中吸附微量鎢,具體做法是,含有微量鎢的鉬酸鹽溶液,經(jīng)pH值調(diào)整至6.5~8.0,加入定量的FeCl3,利用新生成的Fe(OH)3膠體吸附溶液中的鎢。研究結(jié)果表明,影響除鎢效果的關(guān)鍵是吸附劑的用量、溶液pH值以及鉬酸銨溶液中的鎢鉬含量比。溶液pH值的影響見(jiàn)圖1和圖2,從圖中可看出:溶液最佳pH值控制在7.5~8.0之間,其鎢鉬分離系數(shù)可達(dá)到100以上。
2.2 水合氧化物吸附法
在pH值為7.0~8.0的中性或弱堿性介質(zhì)中,鉬酸鹽溶液中低濃度的鎢基本上為聚合物,而鉬酸鹽仍舊以單分子形式存在,多價(jià)金屬[Sn4+,Ti,Zr,Al]水合氧化物,可從高濃度鉬酸鹽溶液中選擇性地吸附鎢。鎢主要以水合離子形式被吸附。
在中性或弱堿性介質(zhì)中,水合氧化錫穩(wěn)定,因此錫不會(huì)對(duì)最終產(chǎn)品造成污染。據(jù)報(bào)導(dǎo),水合氧化物吸附和陰離子交換樹(shù)脂AH-106吸附聯(lián)合使用,可達(dá)到甚佳的除鎢效果。鉬酸銨溶液中鎢含量按離子發(fā)射光譜分析數(shù)據(jù),能夠從0.1%降低到0.001% (質(zhì)量分?jǐn)?shù),按氧化鉬計(jì)算得出)。
3 離子交換法
現(xiàn)在研究最多且行之有效的無(wú)機(jī)物分離提純方法之一是離子交換法。鉬、鎢都是兩性元素,因此在溶液中的存在形式,隨著pH值的變化而發(fā)生很大的變化。這些離子的結(jié)構(gòu)隨溶液中pH值變化而變化,所帶的電荷數(shù)量與符號(hào)也不相同。由于目前離子交換樹(shù)脂種類繁多,完全可以在特定pH值條件下通過(guò)多組篩選性實(shí)驗(yàn)找出一種對(duì)微量鎢有足夠高吸附容量同時(shí)對(duì)鉬吸附容量很小的離子交換樹(shù)脂;同時(shí),鎢開(kāi)始聚合的pH值高于鉬,而聚合的陰離子通常比單體陰離子更容易被吸附,并且含多個(gè)有機(jī)配體的鎢絡(luò)合物的穩(wěn)定性比鉬絡(luò)合物好。因此,采用離子交換法分離鉬溶液中的微量鎢成為可能。
3.1 陰離子交換樹(shù)脂分離鎢鉬
俄羅斯圣彼得堡國(guó)立化工學(xué)院的A.A.布洛辛等人通過(guò)多次探索性實(shí)驗(yàn)比較了不同種類樹(shù)脂的吸附性能,對(duì)鎢的選擇吸附性能最好的是陰離子交換樹(shù)脂AH-106。當(dāng)鉬酸銨溶液pH值在7.5~7.7之間,鉬濃度在80~160 g/L范圍內(nèi)變化時(shí),陰離子交換樹(shù)脂AH-106對(duì)鎢吸附容量變化不大,最高約為637.5 mgW/mL樹(shù)脂。圖3為3種陰離子交換樹(shù)脂動(dòng)態(tài)吸附鎢性能的比較。含有鎢鉬混合溶液通過(guò)裝有AH-106和AH-20離子交換樹(shù)脂的交換柱時(shí),通過(guò)樹(shù)脂床的前10~15倍體積的流出液中,鎢已基本除盡;含有鎢鉬混合溶液通過(guò)AM-П離子交換樹(shù)脂時(shí),前面幾倍樹(shù)脂體積的流出液,鎢就已穿漏。吸附完畢后,用氨水作解吸液很容易從陰離子交換劑上將鎢解吸下來(lái)。離子交換法從鉬酸銨溶液中除去微量鎢已在俄羅斯用于工業(yè)生產(chǎn)。制取低鎢高純仲鉬酸銨工藝包括以下步驟:
①工業(yè)仲鉬酸銨按規(guī)定pH值和鉬濃度制備鉬酸銨溶液;
②鉬酸銨溶液通過(guò)裝有AH-106樹(shù)脂的交換柱,選擇性吸附鎢;
③凈化液沉淀四鉬酸銨;
④四鉬酸銨用氨溶液溶解,并結(jié)晶制備高純仲鉬酸銨。
生產(chǎn)實(shí)踐證明,至鎢穿透時(shí),1 m3AH-106樹(shù)脂能處理不少于25倍樹(shù)脂體積(NH4)4MoO4溶液(鉬120~170 g/L,鎢含量為鎢與鉬的質(zhì)量百分比(0.08%~0.15%)。凈化后所得仲鉬酸銨晶體中鎢的質(zhì)量百分比為0.001%~0.003%(據(jù)中子活化分析),通過(guò)該工藝所得高純度仲鉬酸銨中鎢的含量降低了30~150倍,同時(shí),其他有色金屬雜質(zhì)(銅、鎳、鈷、錳等)及鐵雜質(zhì)的含量也有所降低。用一定濃度的氨水溶液解吸后的溶液中鎢濃縮了20~30倍。與鎢同時(shí)被吸附所造成的鉬損失(可回收)不超過(guò)原料液中鉬含量的4%。
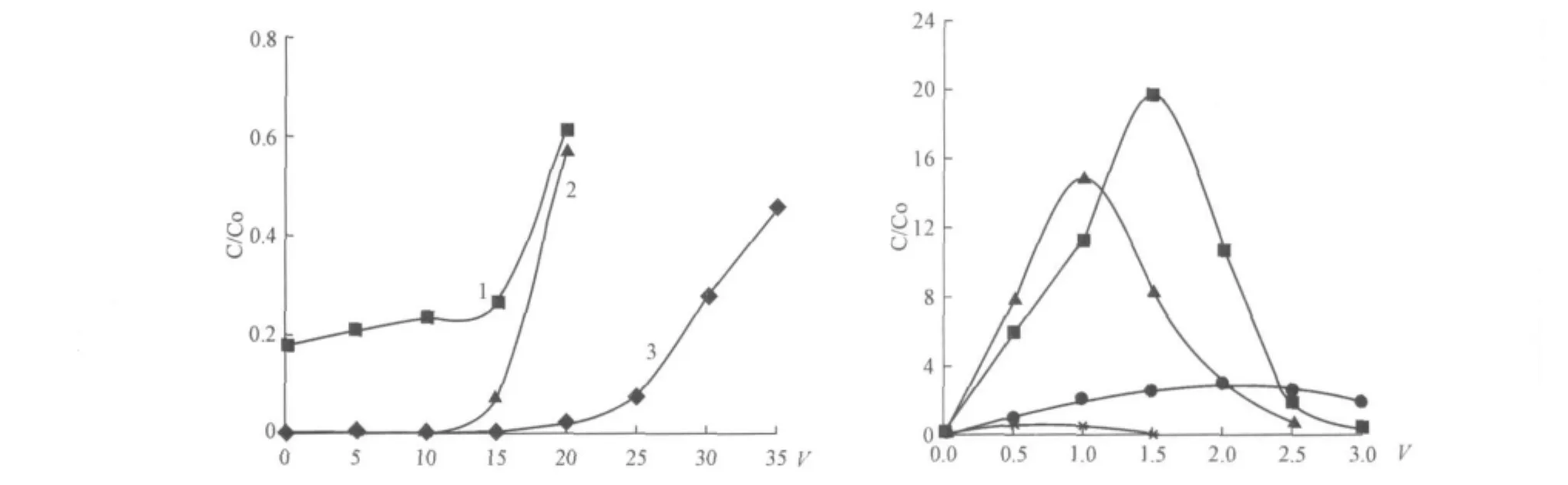
圖3 鉬濃度為150 g/L,鎢濃度為0.5 g/L的鉬酸銨溶液中鎢吸附流出曲線圖和12%氨水溶液解吸鎢的解吸曲線圖
3.2 鄰苯二酚基陽(yáng)離子交換樹(shù)脂分離鎢鉬
A.A.布洛辛等人還試驗(yàn)了用H+型鄰苯二酚基陽(yáng)離子交換樹(shù)脂除去鉬酸銨溶液中的微量鎢。樹(shù)脂上的鄰苯二酚基能與鉬和鎢絡(luò)合,生成絡(luò)合物,且鎢的苯酚絡(luò)合物比鉬的苯酚絡(luò)合物更加穩(wěn)定,這是該樹(shù)脂能吸附分離鎢鉬的關(guān)鍵。
溶液的pH值能影響鉬和鎢的形態(tài),陽(yáng)離子樹(shù)脂ПК-C鄰苯二酚的解離程度,及其與鉬和鎢形成絡(luò)合物的能力,是影響該樹(shù)脂吸附分離鎢鉬的最關(guān)鍵因素。
在特定的pH值范圍內(nèi),鄰苯二酚基陽(yáng)離子樹(shù)脂(ПК-C)對(duì)鉬和鎢的吸附作用是不一樣的,并且其開(kāi)始吸附鎢(VI)的pH值比吸附鉬的pH值高,因此,有可能在有大量鉬存在條件下吸附鎢。如圖4所示:在pH值為9時(shí),鎢的吸附量達(dá)到最大值。此時(shí)溶液中鉬和鎢分別為和形式的單體,其吸附作用的反應(yīng)式為:
A r(OH)2++2H+=A rO2MO2+2H2O
其中,A r為苯環(huán),M為鉬或鎢。根據(jù)上述反應(yīng)式,溶液進(jìn)行進(jìn)一步酸化為鉬(Ⅵ)、鎢(Ⅵ)與苯酚絡(luò)合創(chuàng)造了有利條件。由于鎢與苯酚絡(luò)合的起始pH值高于鉬,從而樹(shù)脂開(kāi)始吸附鎢的pH值高于鉬,在pH值較高時(shí)首先被吸附的是鎢。當(dāng)溶液pH降至某一定值時(shí),鉬(Ⅵ)開(kāi)始與樹(shù)脂絡(luò)合,由于鉬在溶液中的濃度遠(yuǎn)大于鎢(Ⅵ),高濃度的鉬開(kāi)始將鎢從陽(yáng)離子交換樹(shù)脂中置換出來(lái)。此外,當(dāng)溶液酸化至pH<8時(shí),開(kāi)始形成鎢鉬雜多酸根。因此,隨著pH值的降低,陽(yáng)樹(shù)脂對(duì)鎢的吸附量下降。動(dòng)態(tài)試驗(yàn)結(jié)果如圖5所示,通過(guò)使用該離子交換樹(shù)脂,使鎢在溶液中的濃度下降了至少100倍。但是陽(yáng)離子交換樹(shù)脂ПК-C和大多數(shù)陽(yáng)離子凝膠樹(shù)脂一樣,在堿性溶液中不穩(wěn)定。用NaOH溶液解吸時(shí),由于陽(yáng)離子樹(shù)脂的降解,溶液產(chǎn)生了棕黃色染色現(xiàn)象,而用氨溶液解析又不完全,因此需找出一種合適的非堿性解吸劑才可使該樹(shù)脂得到廣泛應(yīng)用。
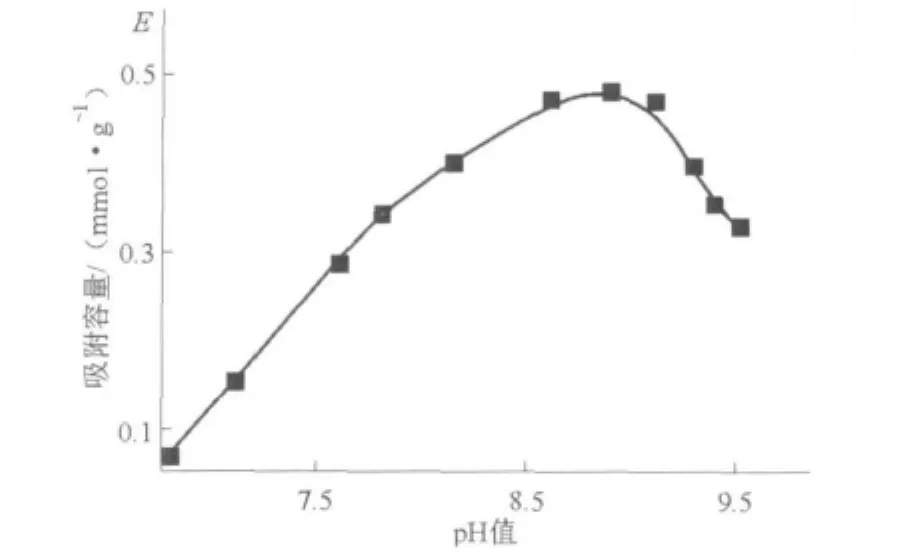
圖4 在1M鉬酸銨溶液中ПК-C對(duì)鎢(Ⅵ)的吸附容量與pH值變化的關(guān)系
4 溶劑萃取法
目前除鉬的研究都是在高鎢低鉬的條件下進(jìn)行的,對(duì)于高鉬低鎢的溶液鎢鉬分離目前還沒(méi)有成熟的工藝。選擇高效萃取劑,采用溶劑萃取法進(jìn)行鎢鉬分離,仍然是工業(yè)生產(chǎn)中一種有效的鎢鉬分離手段。
中國(guó)科學(xué)院化工冶金研究所的喻克寧、于淑秋等[3-5]就胺類萃取劑在中性和弱堿性條件下從高鉬低鎢的鉬酸鈉溶液中萃取分離鎢、鉬進(jìn)行了初探。實(shí)驗(yàn)采用配制溶液(含Mo 91.87 g/L、W 89.2 mg/L),比較了伯、仲、叔胺對(duì)鎢、鉬的萃取分離效果,發(fā)現(xiàn)伯胺具有最佳分離效果。在中性和弱堿性介質(zhì)中,伯胺萃取鎢、鉬按溶劑化原理進(jìn)行,必須加酸才能萃取鎢、鉬。研究結(jié)果表明,萃取反應(yīng)可表示為:
2H++=H2WO4
4RNH2+3H2WO4=(RNH2)4·(H2WO4)3
加酸量以加入氫離子的克當(dāng)量數(shù)RH+與水相中克分子鎢mW(IV)的比值R(R=RH+/mW (IV))表示。R=30時(shí),鎢萃取率最高,大約為50%。當(dāng)水相中鉬、鎢濃度都固定時(shí),伯胺濃度取值一般在伯胺克分子數(shù)與鎢克原子數(shù)之比為50~100的范圍內(nèi),可獲得最佳分離效果。圖6是N1923-1%正辛醇 -煤油溶液從鉬酸鈉溶液(Mo 91.87 g/L,W 89.2 mg/L),R=30,萃取W、Mo的結(jié)果。
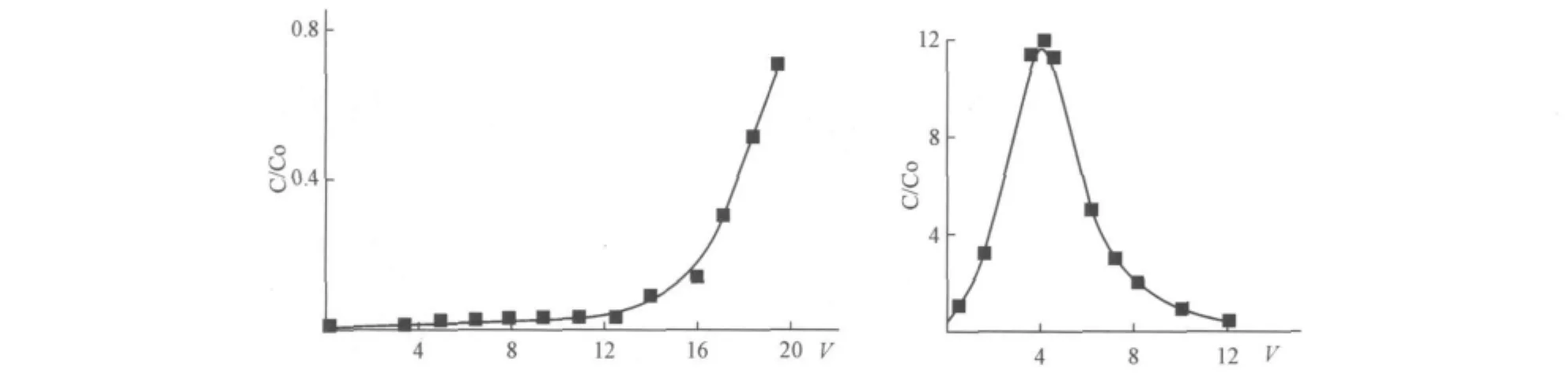
圖5 ПК-C陽(yáng)離子樹(shù)脂從鎢濃度為0.1 g/L、1 M鉬酸銨溶液中吸附鎢(Ⅵ)的流出曲線圖和0.5 M的NaOH溶液解吸鎢(Ⅵ)的流出曲線圖
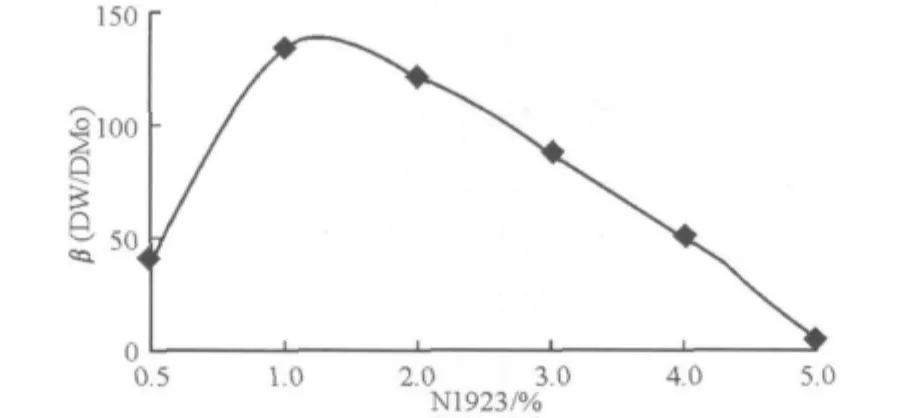
圖6 鉬、鎢萃取分離系數(shù)與伯胺濃度的關(guān)系
在胺類溶劑化萃取中,加入醇,其活性氫原子的增加,可增加溶劑化能力,能起到協(xié)同萃取的作用,有利于鎢的萃取。該研究證明:采用1%N1923-1%正辛醇-煤油,從含Mo 51.0 g/L,W 91.2 mg/L,pH=9.33的鉬酸鈉溶液中萃取W(R=40),萃取率可大于70%。
按此結(jié)果推算,經(jīng)過(guò)3級(jí)錯(cuò)流萃取,鎢的萃取率大于95%,鉬的萃取率在5%左右,其分離系數(shù)接近700,可基本實(shí)現(xiàn)除鎢的目的。值得注意的是,負(fù)載有機(jī)相久置有沉淀生成,且隨溫度升高,生成沉淀的時(shí)間明顯縮短,筆者認(rèn)為原因是萃合物中氫鍵結(jié)構(gòu)發(fā)生了某種變化。
5 結(jié)論
目前,利用鎢鉬化合物性質(zhì)的差異,從鉬酸鹽溶液中分離微量鎢仍處于實(shí)驗(yàn)研究階段,在生產(chǎn)實(shí)踐中獲得成功應(yīng)用的還很少。但是隨著科學(xué)技術(shù)的不斷發(fā)展進(jìn)步,科學(xué)家以及廣大科研工作者的共同努力,會(huì)涌現(xiàn)出越來(lái)越多且更加成熟可靠的鉬酸鹽溶液中除去微量鎢的工藝。
在目前所研究從鉬酸鹽溶液中分離微量鎢的方法中,吸附沉淀法操作最簡(jiǎn)單,但是除鎢效果差,達(dá)不到理想要求。萃取法不僅操作復(fù)雜而且有機(jī)相不穩(wěn)定,不利于工業(yè)生產(chǎn)。離子交換法,特別是陰離子樹(shù)脂吸附除鎢,效果較好,鉬酸鹽溶液不需特別處理,在特定的pH值條件下便能實(shí)現(xiàn)對(duì)鎢酸根離子的優(yōu)先吸附,且解吸徹底,樹(shù)脂能重復(fù)使用,解吸的鎢鉬混合物可方便地予以回收利用。因此,是一種最有工業(yè)應(yīng)用前景的方法。
[1]李惠萍.制取三硫化鉬的新方法[J].中國(guó)鉬業(yè),2003,27(3):33-34
[2]黃普選,范薇.新生態(tài)氫氧化鐵分離鎢鉬的工藝研究[J].吉林化工學(xué)院學(xué)報(bào),2001,18(3):18-20.
[3]于淑秋,陳家鏞.胺類萃取過(guò)渡金屬時(shí)鹽析效應(yīng)與萃取機(jī)理的關(guān)系[J].金屬學(xué)報(bào),1984,20(6):B342-B349.
[4]伍志春,于淑秋,陳家鏞.叔胺-醇混合體系溶劑化協(xié)同萃鎢的研究[J].金屬學(xué)報(bào),1988,24:SB1-SB10.
[5]戴各生,蘇元復(fù).萃取法在稀鹽酸溶液中分離鎢鉬的研究[J].稀有金屬,1985,4(2):31-32.

