印記基因對胎盤發育的影響
尹秋丹,張林波,田見暉*
(1.吉林農業大學 生命科學學院生物制藥創新實驗室,吉林 長春130118;2.中國農業大學 動物科學技術學院/農業部動物遺傳育種與繁殖重點實驗室,北京100193)
印記基因是一類具有父母雙方來源的等位基因,但是只表達其中一方的遺傳信息,而另一方處于沉默狀態的基因。其中父源表達、母源沉默的基因稱為母源印記基因,反之則稱為父源印記基因。在哺乳動物基因組中,印記基因成串出現在富含CpG 核苷酸的DNA 序列簇中,這些特殊的區域,稱為印記控制區域[1]。目前,哺乳類動物基因組中大約存在100 ~200 個印記基因,在鼠類和人類基因組中已確定的約80 種。印記基因對于胎兒的生長發育與行為,特別是胎盤的發育都極其重要,印記基因的異常表達會導致許多疾病的發生[2]。
胎盤是懷孕期間形成的第一個器官,雖然短暫,卻對胎兒發育起著至關重要的作用,例如胎兒的新陳代謝和營養控制、氣體和代謝物的交換以及控制內分泌。一個功能正常的胎盤是哺乳動物存活與生長的重要保障之一[3]。胎盤是印記基因活動最重要的器官之一,盡管胎盤的形成顯示出不同物種間的差異,但是在真亞綱哺乳動物中,尤其是靈長類、嚙齒類和反芻動物中的基因印記活動是保守的。
印記作用被認為是在胚胎發育時期母體營養資源分配過程中,父源基因組和母源基因組沖突假說理論的應答變體。沖突假說,即父源表達基因促進胎盤發育并為胎兒提供更多營養,促進胎兒迅速生長,以期獲得強壯個體; 母源表達基因則是為了自己的終身繁殖能力,限制胎兒生長速度和體重,節省和平均各胎次的繁殖資源[4]。胎盤是胎兒生長所需營養的主要資源,印記基因通過調節胎盤發育和營養物的轉運,就可以影響母體-胎兒資源分配和胎盤對周圍環境改變的應激反應,以及及時變更子宮內養分有效性。同時這些作用影響子宮內組織的發育編程,并與成人以后的一些疾病的發病率息息相關[5]。因此,印記基因通過調節胎盤生長發育,從而影響胎兒發育,具有十分重要的作用。
1 印記基因的表觀調控方式
印記基因的“印記”機理是印記一方的基因調控序列DNA(一般認為是啟動子) 被甲基化和組蛋白被甲基化,其中DNA 甲基化是關鍵[6]。DNA 甲基化是已知最早被發現的與基因抑制相關的表觀遺傳機制。在哺乳動物中,它發生于CpG 二核苷酸。甲基化DNA 在基因組上的分布表明它們集中出現在非編碼區和散在的重復元件區域,是在DNA甲基化酶作用下,將S- 腺苷酞甲硫氨酸(SAM) 分子上的甲基轉移到DNA 分子中胞嘧啶殘基的5 位碳原子上。胞嘧啶被甲基化為5-甲基胞苷。此時該等位基因將被關閉,不再表達。另一方等位基因的調控序列未被甲基化等修飾,在轉錄復合體作用下可以正常進行mRNA 轉錄。在哺乳動物生命周期中,性原細胞階段,DNA 分子甲基化被清除。配子階段,重新建立DNA 甲基化。對于非印記基因,隨后出現去甲基化,在受精后父源基因組DNA 去甲基化過程是主動的,母源基因去甲基化過程是被動的[7]。基因印記區域甲基化DNA 的存在導致胎盤類哺乳動物中母源或父源等位基因的沉默,包括X染色體失活。這表明在進化過程中它們獨有的利用這一表觀遺傳機制來穩定沉默[8]。許多印記基因和印記調控子鄰近的序列存在有差異甲基化序列和DNA 甲基化修飾,DNA甲基化在基因組印記的維持中所充當的重要角色在遺傳學中得到了證明。
2 印記基因與胎盤發育
印記基因在胎盤中廣泛卻又短暫的表達,但其作用對于正常胎盤發育是必需的。在嚙齒類動物中,當印記基因甲基化的建立受損,這包括與其相關基因的異常表達和甲基化抑制劑的作用,都會使胎盤滋養層細胞的分化及凋亡發生異常,從而導致胎盤的異常發育而使其不能正常發揮功能。在老鼠中,通過選擇性基因敲除手段而產生的轉基因突變個體中,經常發現有異常的胎盤發育,這包括異常的胎盤重量、迷路滋養層以及成膠質細胞的發育異常(表1)[1]。在正常受孕的人類嬰兒中,異常的胎盤重量經常伴隨著混亂的印記基因表達出現,而且有報道稱,在發育遲緩或早產嬰兒中胎盤內常伴有印記基因表達異常。并且各基因在胎盤發育的不同時期有不同表達量,不是所有基因在胎盤形成初始至胎兒出生都有表達[9]。
一般來講,胎盤的正常發育需要父源印記基因和母源印記基因共同調控,通過父源基因的表達快速發育,通過母源基因的表達受到發育限制,任何一方的基因表達異常都會導致胎盤發育異常。這已通過對敲除基因突變體各項檢測得到論證,這也與沖突假說理論表述一致。例如,H19-IGF2基因位點父源表達的IGF2基因編碼生長因子IGF2,促進胎盤生長發育; 而母源表達的IGF2r 和H19 基因會直接或間接限制IGF2的表達,從而抑制胎盤發育,減少胎盤重量(表1)[10]。類似的,Phlda2 基因敲除的小鼠胎盤的重量高于平均重量,而敲除RTL1 基因的小鼠則表現為胎盤生長發育遲緩。還有一些基因,例如PEG10 和Mash2,如果敲除這些基因不僅會影響血性絨毛膜胎盤的形成,甚至會導致懷孕中期胚胎致死率的增高[11]。
在很多敲除型突變個體中,胎盤重量上的改變還常伴隨著形態學上的變化,從而直接影響胎盤對胎兒營養的供應。例如老鼠胎盤,分為3 個區域: 含有肝糖原細胞的底蛻膜區域,成膠質細胞的分界區域以及包含了3 層滋養層細胞層的迷路區域。其中成膠質細胞具有內分泌作用,而滋養層細胞則是母體-胎兒進行營養物質運輸的重要區域。當通過敲除特異印記基因使其表達異常時,這3 個區域的發育則會發生異常。尤其是迷路區域的面積,肝糖原的數目和基因位點以及在厚度和器官膜上的變化,這些都將成為母體和胎兒之間物質循環的障礙[12,13]。這些變化同樣會改變一些哺乳動物胎盤的表面積和滋養層中的多血管系統,使成膠質細胞不能正常發育,妨礙胎盤絨毛膜形成[14]。而且交界處總面積的變化和細胞成分上的變化都可以通過母體新陳代謝和對胎兒的營養物質分配直接影響胎兒生長發育,使胎盤的糖原利用和激素生成產生差異,嚴重影響胎盤正常發育與功能[15,16]。
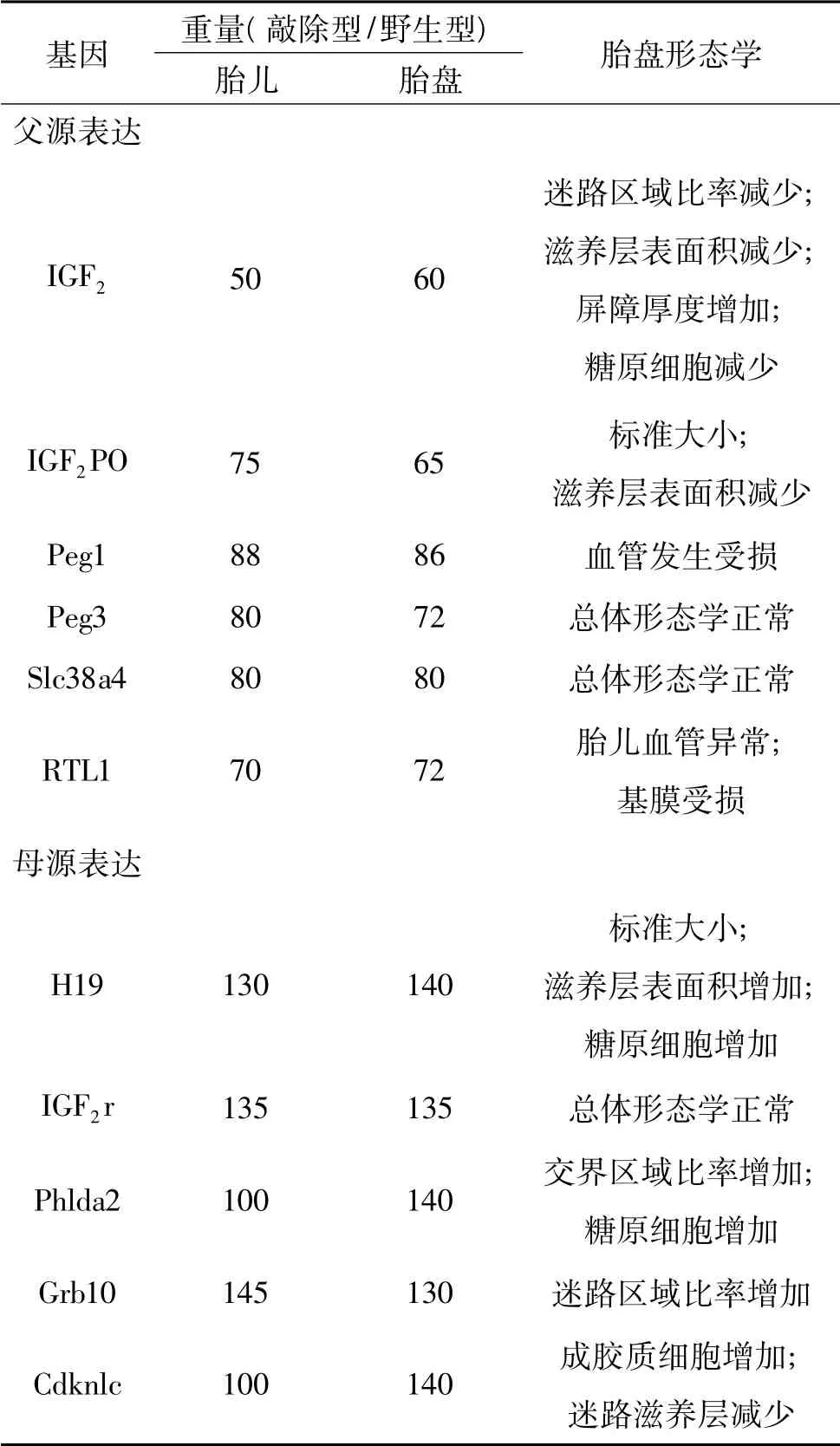
表1 在小鼠懷孕晚期,印記基因對胎兒-胎盤生長及胎盤形態學的作用[1]
3 印記基因與胎盤營養物質的運輸
測量營養物質的轉運是通過檢測在敲除印記基因或印記基因過表達的突變型個體中,胎盤所轉運物質的量。與野生型相比,IGF2PO(父源IGF2) 胎盤會轉運更多的MeAIB(α-甲氨基異丁酸)[17],它同樣轉運更多的鈣和甲基-D-葡萄糖[18]。在大多數情況下,這些營養物質運輸上的改變伴隨著胎盤上特異葡萄糖和A 系統氨基酸轉運蛋白表達的改變[17]。Sla38a4,父源印記基因,A系統氨基酸轉運子亞型,在IGF2完全失效胎盤通過這種基因的減少效應和MeAIB 轉運蛋白的正向調節,使X 和Y 氨基酸轉運子系統豐裕度減少,這也解釋了為何這些突變體宮內發育遲緩[17]。這些發現表明,印記基因在調節胎盤上營養物轉運過程中扮演著重要角色。
通常情況下,胎盤厚度上的改變會影響被動擴散性質,而胎盤的通透性則是被動擴散的標記,同時滋養層表面積的變化會影響通過簡單擴散和轉運蛋白介導轉運的營養物的運輸過程[19]。例如,在基因表達有缺陷的突變體膜上的甘露糖、EDTA(乙二胺四乙酸) 和菊糖含量減少,導致胎盤或脈管系統的表面積減少,影響物質運輸[20,21]。綜上,胎盤內印記基因的正常表達以及它們之間的互作對胎盤正常生長發育、生理功能和營養物質運輸都是至關重要的。
4 印記基因作為環境誘發表觀修飾信號
除了調節胎盤生長發育和營養物質轉運之外,胎盤內的印記基因可以迅速感應環境變化進而變更胎盤表型。研究表明,印記基因調控在胎盤環境微干擾中比胚胎或胎兒組織中表現更為敏感,尤其在胚胎植入前改變早期胚胎環境在決定以后胎盤內印記基因表達模式中顯得尤為重要[22]。而這些發現與利用體外輔助生殖技術獲得人類嬰兒的胎盤中印記基因表達混亂的結果一致[23]。
環境誘發改變的印記基因表達與胎盤生長和營養物質運輸能力改變有關。對比IGF2PO 和IGF2無效突變體表明,印記基因可以同樣對胎兒所需營養做出迅速感應[24,25]。當IGF2只在迷路區域中缺乏時,胎盤變得更加高效,并且可以提高營養物質轉運蛋白的豐富性,通過其它表達IGF2的胎兒組織幫助維護其生長[26]。當所有胎兒組織中IGF2的表達均缺乏時,胎盤氨基酸轉運蛋白豐富度降低,胎兒相關生長率降低[24]。當胎盤對胎兒正常營養物質的需要和供給不匹配時,IGF2PO 正向表達會增加MeAIB 運輸和Slc38a2 氨基酸轉運蛋白的表達,這樣胎盤會對胎兒生長供給更多,進而可在懷孕后期保證胎兒正常生長率。同樣,在Phlda2 過表達的胎盤中,相似的營養供求機制也可以促進正向調節營養物質表達和離子轉運蛋白,以保證胎兒生長發育。反過來,在懷孕后期孕體過生長時,胎盤減少的被動通透性和MeAIB 的運輸可能反射母源信號,抑制胎盤營養物的支配來調節胎兒生長[20]。由此可見,胎兒和胎盤間印記基因的相互影響不僅與調節營養物分配有關,同樣可以應答環境信號。
5 輔助生殖技術(ARTs)和體細胞克隆(NT)引起的胎盤印記異常
ARTs 是近年來迅速發展并已廣泛應用于人類和動物,用以嘗試校正生育能力損傷的技術,可以提高特殊物種生殖效率,包括體外受精、ICSI 等。雖然它的應用廣泛,但是這項技術的使用和體外培養條件會對胚胎造成損傷,因此具有很高的胚胎死亡率。在實驗動物中,大多數胚胎由于異常甲基化不能重編程,無法正常發育為胚胎。同時它增加了胎盤異常形態的發病率。這都與印記基因異常表達相關。
動物體細胞克隆是應用顯微操作技術將體細胞注入去核的卵母細胞中,再將重構胚移入體內培養,以期成為正常個體。該技術中的去分化和恢復全能性是成功的關鍵。雖然已經有多種動物通過克隆產生個體,但是克隆動物的存活率低,且存在大量表型異常及不同程度缺陷一直是克隆技術中存在的重要問題[27]。主要表現為克隆動物胚胎和胎盤的過度生長。而這正與許多印記基因表達失調導致的癥狀相似。體細胞克隆時,供體細胞不適當的表觀遺傳重編程,如DNA 甲基化,可能是導致體細胞克隆效率低的原因[28]。有證據表明,重編程過程中,一些印記基因會被破壞,導致基因組印記缺陷。而核移植操作和體外培養對卵母細胞和供體細胞造成的損傷及發育異常也會被帶到重構胚中,致使印記基因表達異常[29]。例如,在體外培養液中加入血清會干擾DMR 的甲基化和IGF2r 的表達[30]。而基于印記基因對于胎盤正常發育和生理功能的重要作用,在克隆動物中,胎盤及胎兒發育的異常也就不足為怪。因此這也是導致克隆效率低的一個重要因素。
6 結論與展望
不同基因在多樣的表觀遺傳修飾調控下開啟或關閉,執行各自的功能。基因組印記就是通過甲基化作用等方式實現對來源于不同親本的等位基因表達的調控,從而保證各基因的正常表達。胎盤作為對胎兒生長有決定性作用的器官,有許多特異印記基因的表達,這些基因表達調控胎盤的正常發育及結構形成,同時對于胎盤的主動運輸能力和轉運蛋白的表達有極其重要的作用。這也關系到母體-胎兒之間物質循環,充足的營養轉運是保證胎兒發育的首要因素之一。同時,這些基因可以感應周圍環境的微小變化并迅速作出反應,平衡母體和胎兒的營養供求。一旦這些基因出現表達上的異常,則會引起胎盤表型上的異常,導致其功能出現異常。因此這些印記基因的正常表達以及協同作用是保證胎盤的生長發育以及行使其生理功能的重要因素。
回顧哺乳動物發育中的幾種重要的基因印記作用,確定印記基因在功能健全和胎兒發育中的重要作用。基因印記作用的獲得和進化是基礎生物學問題之一,不斷探索各基因的功能、表達機制以及基因間的互作將成為這一問題研究的必要環節。而且這些印記基因也將成為一些遺傳類疾病的治療靶點,并且可以應用在體外輔助生殖技術中用以改良人類生育及動物繁殖中的一些問題。因此,研究胎盤內印記基因的表達和作用具有重大意義。
[1]A L Fowden,P M Coan,E Angiolini.Imprinted genes and the epigenetic regulation of placental phenotype.Progress in Biophysics and Molecular Biology.2011,281-288.
[2]Katia D,Robert F.Epigenetic regulation of mammalian genomic imprinting.Current Opinion in Genetics & Development,2004,14: 1-8.
[3]Rossant J,Cross JC.Placental development: lessons from mouse mutants.Nat Rev Genet 2001; 2: 538-48.
[4]Partidge L,Hurst L D.Sex and C on flict.Science,1998,281: 2003-2008.
[5]Barker,D.J.P..The malnourished baby and infant.Br.Med.Bull.2001,60,69-88.
[6]張守權.哺乳動物印記基因的研究進展[J].中國生物工程雜志,2003,23: 12.
[7]Dean W,Santos F,Reik W.Epigenetic reprogramming in early mammalian development and following somatic nuclear transfer.Seminars in Cell &Developmental Biology,2003,14: 93-100.
[8]Mayer W,Niveleau A,et al.Demethylation of the zygotic paternal genome.Nature,2000,403: 501-502.
[9]Kagami M,Sekita Y.Deletions and epimutations affecting human 14q32.2 imprinted region in individuals with maternal and paternal upd(14)-like phenotypes.Nat.Genet.2008 40,237-242.
[10]C onstancia M,Hemberger M,et al.Placental-specific IGF-II is a major modulator of placental and fetal growth.Nature,2002,417: 945-948.
[11]F F Bressan,T H C De Bem,F Perecin.Unearthing the Roles of Imprinted Genes in the Placenta.Placenta 30,2009,823-834.
[12]Georgiades P,Ferguson-Smith A C.Comparative developmental anatomy of the murine and human definitive placenta.Placenta,2002,23,3-19.
[13]Watson E D,Cross J C.Development of structures and transport functions in the mouse placenta.Physiology.2005,20,180-193.
[14]Georgiades P,Watkins M,Burton G J.Roles for genomic imprinting and the zyotic genome in placental development.Proc.Natl.Acad.Sci.U.S.A.2001,98,4522-4527.
[15]Lin,Coan P.Differential regulation of imprinting in the murine embryo and placenta by the Dlk1-Dio3 imprinting control region.Development 134,2007,417-426.
[16]Tunster S J,Tycko B.The imprinted Phlda2 gene regulates extraembryonic energy stores.Mol.Cell.Biol.,2010,30,295e306.
[17]Constancia M,Angiolini E.et al.Adaptation of nutrient supply to fetal demand in the mouse involves interaction between the Igf2 gene and placental transporter systems.Proc.Natl.Acad.Sci.U.S.A.2005.102,19219-19224.
[18]Dilworth M R,Kusinski L C,et al.Placental-specific Igf2 knockout mice exhibit hypoclacemia and adaptive changes in placental calcium transport.Proc.Natl.Acad.Sci.U.S.A.2010,107,3894-3899.
[19]Angiolini E,Fowden A L,et al.Regulation of placental efficiency for nutrient transport by imprinted genes.Placenta 27 (Suppl.A) ,Trophoblast Res.2006.S98eS102.,20.
[20]Coan P M,Angiolini E.et al.Adaptations in placental nutrient transfer capacity to meet fetal growth demands depend on placental size in mice.J.Physiol.2008a.586,4567e4576.
[21]Sekita Y,Wagatsuma H,et al.Role of retrotransposon-derived imprinted Rtl1,in thefeto-maternal interface of the mouse placenta.,2008.
[22]Fortier A L,Lopes F L.Superovulationalters the expression of imprinted genes in the mid gestation mouse placenta.Hum.Mol.Genet.,2008,17,1653-1665.
[23]Haycock P C,Ramsay M,Exposure of mouse embryos to ethanol during preimplantation development: effect on DNA methylation in the H19 imprinting control region.Biol.Reprod.2009,81,618e627.
[24]Constancia M,Angiolini E et al.Adaptation of nutrient supply to fetal demand in the mouse involves interaction between the Igf2 gene and placental transporter systems.Proc.Natl.Acad.Sci.U.S.A.,2005,102,19219-19224.
[25]Coan P M,Fowden A L,et al.Disproportionate effects of Igf2 knockout on placental morphology and diffusional exchange characteristics in the mouse.J.Physiol,2008,586,5023-5032.
[26]Constancia M,Hemburger M,et al.Placental-specific IGF2is a major modulator of placental and fetal growth.Nature,2002,417,945-948.
[27]Kubota C,Y amakuchi H,et al.Six cloned calves produced from adult fibroblast cells a fter long 2term culture.Proc Natl Acad Sci(USA) ,2000,97: 990-995.
[28]Dean W,Santos F,Reik W.E pigenetic reprogramming in early mammalian development and following somatic nuclear transfer.Seminars in Cell&Developmental Biology,2003,14: 93-100.
[29]侯曉軍,焦麗紅.基因組印記對個體發育及動物克隆的影響[J].遺傳學報,2005,32(5) : 550-554.
[30]Shi W,Zzkhartchenko V,Wolf E.Epigenetic reprogramming in mammalian nuclear transfer.Differentiation,2003,71(2) : 91-113.

