以結核分枝桿菌H37Rv莽草酸脫氫酶為靶點的高通量篩選模型的建立及應用
陳小娟,崔佳飛,楊延輝,關艷,張雪蓮,肖春玲
·論著·
以結核分枝桿菌H37Rv莽草酸脫氫酶為靶點的高通量篩選模型的建立及應用
陳小娟,崔佳飛,楊延輝,關艷,張雪蓮,肖春玲
目的建立以結核分枝桿菌莽草酸脫氫酶為靶點的新型抗結核藥物高通量篩選模型;用此模型篩選莽草酸脫氫酶抑制劑;進一步評價化合物對莽草酸脫氫酶活性的影響。
分枝桿菌,結核; 酶抑制劑; 基因表達;莽草酸脫氫酶
www.cmbp.net.cn 中國醫藥生物技術, 2012, 7(3):191-196
近幾年來結核病感染人數逐年攀升,2010 年全球結核病新增 880 萬例,中國感染結核的人數已達 1.34 億,位居世界第二,并且多藥耐藥結核(MDR-TB)日趨嚴重,同時結核病與艾滋病共感染現象的不斷增加,使結核病疫情的防控面臨著更為嚴峻的挑戰[1]。因此開發新型的抗結核藥物迫在眉睫。
莽草酸途徑(shikimate pathway)是細菌、真菌、藻類、高等植物等合成三種必需芳香族氨基酸的必需途徑[2],本途徑包括七步反應,最終生成分支酸(chorismic acid)。分支酸是合成 L-色氨酸,苯丙氨酸及酪氨酸的前體物質,同時也是合成其他芳香型化合物(諸如葉酸、泛酸和奎寧酸等)的前體物質[3]。莽草酸脫氫酶(shikimate dehydrogenase,SD)是莽草酸合成途徑中的關鍵酶,催化莽草酸途徑中的第四步反應,是結核分枝桿菌(mycobacterium tuberculosis,MTB)生長所必需的,SD 利用還原型輔酶 II(NADPH)催化 3-脫氫莽草酸(3-dehydroshikimate,DHS)生成莽草酸(shikimate,SKH)[4]。人體從外界環境中攝取必需芳香族氨基酸,體內不存在莽草酸途徑,因此結核分枝桿菌莽草酸脫氫酶(MtSD)是一個很有發展前景的藥物作用靶點。
本研究的目的是建立基于 MtSD 抑制劑的高通量篩選(high throughput screening,HTS)模型,并用此模型篩選莽草酸脫氫酶的抑制劑,進一步評價化合物對莽草酸脫氫酶活性的影響,為發現具有MtSD 抑制作用的先導化合物提供一種快速有效的方法。
1 材料與方法
1.1 材料
1.1.1菌株 帶有 MtSD 基因的表達工程菌BL21-pET-SD 由復旦大學王洪海實驗室提供。恥垢分枝桿菌(Mycobacterium smegmatis)mc2155、海分枝桿菌(M. marinum)ATCC BAA-535、肺炎克雷伯桿菌(Klebsiella pneumoniae)ATCC700603 均購自美國模式培養物集存庫(ATCC);大腸埃希菌(Escherichia coli)、銅綠色假單胞菌(p.aeruginosa)、摩氏摩根(Morganella morganii)耐藥菌、枯草桿菌(Bacillus subtilis)、糞腸球菌(Enterococcusfaecalis)來自本實驗室;甲氧西林耐藥金黃色葡萄球菌(MRSA)R6101、變形桿菌(proteusbacillus vulgaris)為本所武臨專老師實驗室贈與。
1.1.2儀器與材料 His trapTMHP 親和層析柱、AKTA 蛋白純化儀均為美國 GE 公司產品;PCR儀、蛋白垂直電泳槽、Gel DOC 凝膠成像系統均為美國 Bio-Rad 公司產品;EnsprireTM酶標儀為美國Perkin Elmer 公司產品;LegendTMMACH1.6/R 離心機為美國 Thermo 公司產品;細胞壓力破碎儀AH-100B 為北京恒奧德儀器儀表有限公司產品;Orion Model 828 型電子 pH 計為德國 Sartorius公司產品;MCV-B161Sb 超凈工作臺為日本SANYO 公司產品。
NADPH、NADP 購自瑞士 Roche 公司;SKH購自瑞士 Fluka 公司;異丙基-β-D-硫代吡喃半乳糖苷(IPTG)購自美國 Merck 公司;蛋白質分子量標準購自加拿大 Fermentas 公司;卡那霉素、咪唑、Tris-HCl、四甲基乙二胺(TEMED)、過硫酸銨購自美國 Sigma 公司;30% 丙烯酰胺-雙丙烯酰胺溶液、4 × 分離膠緩沖液、4 × 濃縮膠緩沖液、10 × 電泳緩沖液、R-250 考馬斯亮藍染液購自北京普利萊公司;吐溫 80 購自美國 Amresco 公司;胰蛋白胨、酵母粉購自英國 Oxoid 公司;7H9 肉湯培養基、ADC 增菌液購自美國 BD 公司;MH肉湯培養基購自北京三藥科技開發公司;氯化鈉購自北京化工廠。
1.2 方法
1.2.1MtSD 的表達與純化 將帶有 MtSD 基因的 PET28b 載體轉化入表達菌株 BL21 得到的表達工程菌 BL21-pET-SD 劃線接種到含 50 μg/ml卡那霉素的 LB 平板上,挑取單菌落于 LB 液體培養基中,37 ℃、200 r/min 過夜培養,以 1∶100 轉接于 LB 液體培養基(含 50 μg/ml 卡那霉素),培養至 OD600約為 0.6 時加入終濃度為 0.5 mmol/L 的 IPTG,37 ℃、200 r/min 誘導表達 5 h[5]。離心收集菌體。
1.2.2MtSD 的純化 在收集的菌體中加入裂解緩沖液[50 mmol/L Tris-HCl、300 mmol/L NaCl、0.1% 聚乙二醇辛基苯基醚(Triton X-100)、10 mmol/L咪唑],液氮-冰水反復凍融 5 次[6],再用細胞壓力破碎儀 800 bar(1 bar = 1 × 105Pa)下破碎菌體 3 遍,12 000 × g 離心 20 min 后收集上清,利用 Ni2+親和層析分離目的蛋白。先用洗脫緩沖液 A(50 mmol/L Tris-HCl、300 mmol/L NaCl、 50 mmol/L咪唑)和 B(50 mmol/L Tris-HCl、300 mmol/L NaCl、100 mmol/L咪唑)洗脫雜蛋白,然后用洗脫緩沖液 C(50 mmol/L Tris-HCl、300 mmol/L NaCl、150 mmol/L 咪唑)洗脫目的蛋白,純化產物用 SDS-PAGE 電泳檢測[7]。
1.2.3酶活及酶穩定性測定 酶活測定是利用莽草酸途徑中第四步反應的逆反應,即SKH以NADP為輔酶在 MtSD 作用下生成 DHS。反應于 96 孔酶標板中進行,終體積為 100 μl。酶活測定體系包括:2 mmol/L NADP,8 mmol/L SKH,100 mmol/L Tris-HCl(pH 9.0),0.3 μg SD。在 37 ℃ 下于酶標儀中檢測 340 nm 的吸收值(OD340)變化。酶穩定性測定包括:處理溫度(25、37、42、55、65、75 ℃)和每個溫度的處理時間(0、5、10、20、30、40、50、60 min)。
1.2.4篩選條件優化及高通量篩選模型的評價 優化參數包括:反應溫度(25,30,37,42,50 ℃),反應 pH 值(7 ~ 13,每隔 0.5 個 pH 取值),反應底物 SKH(16 ~ 0.0625 mmol/L,二倍稀釋)和 NADP 濃度(4 ~ 0.0625 mmol/L,二倍稀釋),酶量(7.77 ~ 0.68 U,二倍稀釋)及 DMSO 濃度(8% ~ 0.125%,二倍稀釋)。Z' 因子法是評價HTS 模型穩定性的一種重要方法。根據公式計算Z′ 因子值:Z′ = 1 - 3(SDn + SDp)/(Vn - Vp)。其中 Vn 和 SDn 分別為陰性對照孔的酶反應速率平均值和標準差;Vp 和 SDp 分別代表陽性對照孔的酶反應速率平均值和標準差。
1.2.5酶抑制劑高通量篩選 以優化后的反應條件進行篩選,每塊 96 孔酶標板上設 80 個待篩樣品孔及 4 個陽性對照孔和 4 個陰性對照孔。由于目前沒有已報道的 MtSD 酶抑制劑,本研究以加入熱變性酶(75 ℃ 處理 30 min)作為陽性對照。每孔加入待測樣品終濃度為 20 μg/ml,在 37 ℃ 條件下檢測 30 min 內反應體系 OD340的變化,計算酶的反應速率。利用反應速率計算樣品對 MtSD 的抑制率(R):R(%)=(1 - VS/VN)× 100%。其中 VS代表待測樣品孔的酶反應速率;VN代表陰性對照孔的平均酶反應速率。
根據以上條件,對本所化合物庫中的 5 萬余個化合物進行了初篩,并按照初篩的反應條件和反應方法進行復篩,根據復篩的結果確定化合物對MtSD 的抑制率。
1.2.6抑制劑半數抑制濃度(IC50)測定 采用優化后的反應條件測定,化合物濃度為 160、80、40、20、10、5、2.5、0 μg/ml,計算出抑制率后使用 origin 8.1 分析各抑制劑的 IC50。
1.2.7抑制劑 6186050 對MtSD 的動力學研究 采用優化后的反應條件,先固定 NADP 的濃度分別為 1、0.5、0.25 mmol/L,SKH 的濃度變化分別為 8、4、2、1、0.5、0 mmol/L,再固定 SKH的濃度分別為 8、4、2 mmol/L,NADP 的濃度變化分別為 1、0.5、0.25、0.125、0.0625、0 mmol/L,抑制劑 6186050 的濃度分別為 12、10、0 μg/ml,在 37 ℃ 酶標儀中連續測定。
1.2.8抑制劑對某些臨床分離菌包括耐藥菌株的最低抑菌濃度(MIC)的測定 于 96 微孔板中進行,海分枝桿菌和恥垢分枝桿菌用 7H9 培養基,其他細菌用 MH 培養基,抑制劑的終濃度分別為128.0、64.0、32.0、16.0、8.0、4.0、2.0、1.0、0.5、0.25、0.125 μg/ml,用 MH 肉湯培養基或 7H9 培養基(含 10% ADC)二倍稀釋成各種所需濃度,實驗菌的接種量約為 5 × 105 cfu/ml,稀釋菌液于15 min 內接種完畢。接種恥垢分枝桿菌和海分枝桿菌時,需在 7H9 培養基(含 10% ADC)中加入0.05% 的吐溫 80。除糞腸球菌 37 ℃ 孵育 24 h和海分枝桿菌 30 ℃ 孵育 4 d 外[8],其他菌株都是37 ℃ 孵育 18 h 觀察結果[9]。
2 結果
2.1 MtSD 的表達和純化
對表達純化得到的MtSD 蛋白進行 SDSPAGE 分析,相對分子質量約為 29 kD。雖然大部分表達的MtSD 蛋白在沉淀中,但上清經純化后在SDS-PAGE 上也看到明顯的目的條帶,并且條帶是單一的(圖 1)。
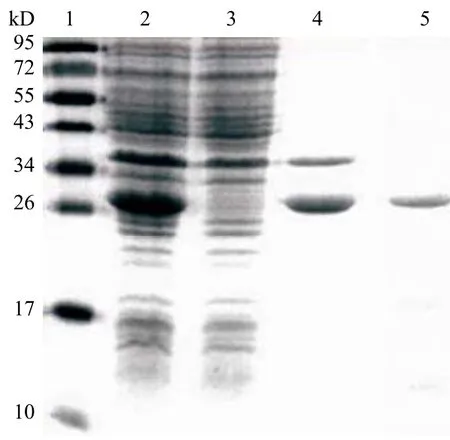
圖1 MtSD SDS-PAGE 圖譜Figure 1 SDS-PAGE of expressed and purifiedMtSD protein
2.2 酶活測定
在MtSD 的作用下 SKH 苯環上的 3 位脫去一個氫離子轉移到 NADP 上,生成NADPH,通過檢測體系中的 NADPH 的濃度來反映MtSD 的酶活。NADPH 的濃度與OD340 成線性關系(圖 2)。
MtSD 酶活力的定義:37 ℃ 條件下反應,每分鐘催化生成 1 nmol/L NADPH 的酶量設定為1 U。純化后MtSD 為 0.272 mg/ml,酶比活力為20987 U/mg。并且酶反應速率與酶量成線性關系(圖 3)。
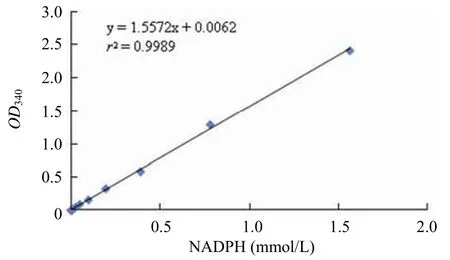
圖2 NADPH 濃度與OD340 關系Figure 2 The relationship between the concentration of NADPH andOD340
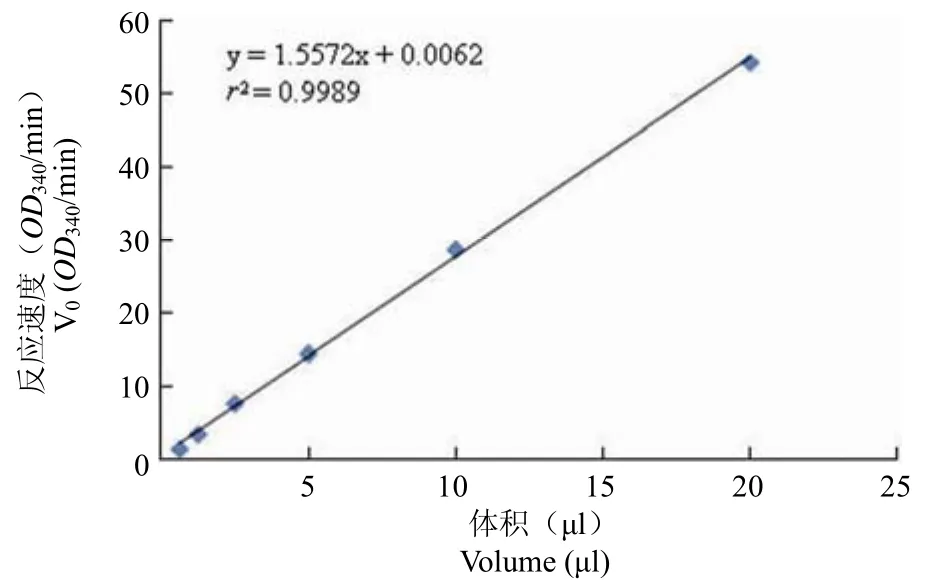
圖3 酶量與反應速度關系Figure 3 The relationship between the quantity and raction rate ofMtSD
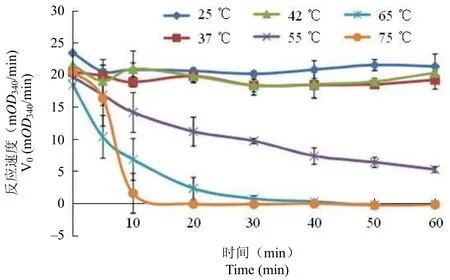
圖4 MtSD 穩定性Figure 4 The stability ofMtSD
2.3 酶穩定性測定
MtSD 在 25、37、42 ℃ 處理 1 h 內處于穩定狀態;55 ℃ 時隨著處理時間的延長酶活逐漸下降;65 ℃ 處理 40 min 后、75 ℃ 處理 20 min 后MtSD 已失活(圖 4)。
2.4 篩選條件優化和高通量篩選模型的評價
隨著溫度的升高MtSD 反應速度增加,為便于實驗的操作,選擇 37 ℃ 為篩選溫度;體系中 pH值為 12 時酶活力達到最大,但此時反應體系不穩定,故篩選的 pH 值確定為 9;最佳 SKH 濃度為8 mmol/L;最佳 NADP 濃度為 1 mmol/L;最佳酶量為 0.3 μg,即 2.5 U;DMSO 在 ≥ 0.5% 時對MtSD 活力產生影響,因此在篩選時陰性對照和空白對照必須加入與實驗組等體積的 DMSO,消除DMSO 對酶活造成的影響(圖 5)。
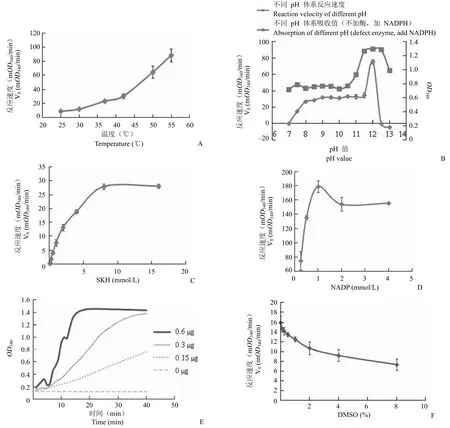
圖5 篩選條件優化(A:最適溫度;B:最適 pH;C:最佳 SKH 濃度;D:最佳 NADP 濃度;E:最佳酶量;F:DMSO濃度對酶活的影響)Figure 5 Optimization of screening conditions (A: Optimization of temperature; B: Optimization of pH; C: Optimization of the SKH concentration; D: Optimization of the NADP concentration; E: Optimization of the enzyme concentration; F: Effect of the DMSO concentration)
目前廣泛使用的 HTS 模型的穩定性和可靠性評估參數是Z′ 因子[10],它是一個統計學參數,與篩選源無關,僅與篩選方法本身有關。一般認為,如果 1 >Z′ > 0.5,說明該篩選模型是比較理想的適合于 HTS 的方法;如果Z′ < 0.5,則說明篩選方法還需要調整。本實驗中 HTS 的Z' 因子值為0.76 ± 0.04。因此,所建立的篩選方法是一種穩定性和靈敏度都較好的 HTS 方法。
2.5 MtSD 抑制劑的篩選及 IC50
采用建立的 HTS 篩選模型,對本所 5 萬余個化合物進行篩選,得到 9 個抑制率 > 20% 的化合物,并分別測定它們的 IC50。化合物編號、對MtSD的抑制率及 IC50如表 1。
2.6 抑制劑 6186050 對MtSD 的動力學研究
由于抑制劑 6186050 的 IC50相對較低,對其動力學進行研究。NADP 為 1 mmol/L 時,抑制劑6186050 以競爭的方式抑制MtSD 的活性(圖 6),抑制常數Ki為 4.9 μmol/L。
2.7 抑制劑對某些臨床分離菌包括耐藥菌株的最低抑菌濃度(MIC)的測定
經過 3 次的重復實驗,具有抑菌活性的抑制劑對菌株的 MIC 如表 2 所示。
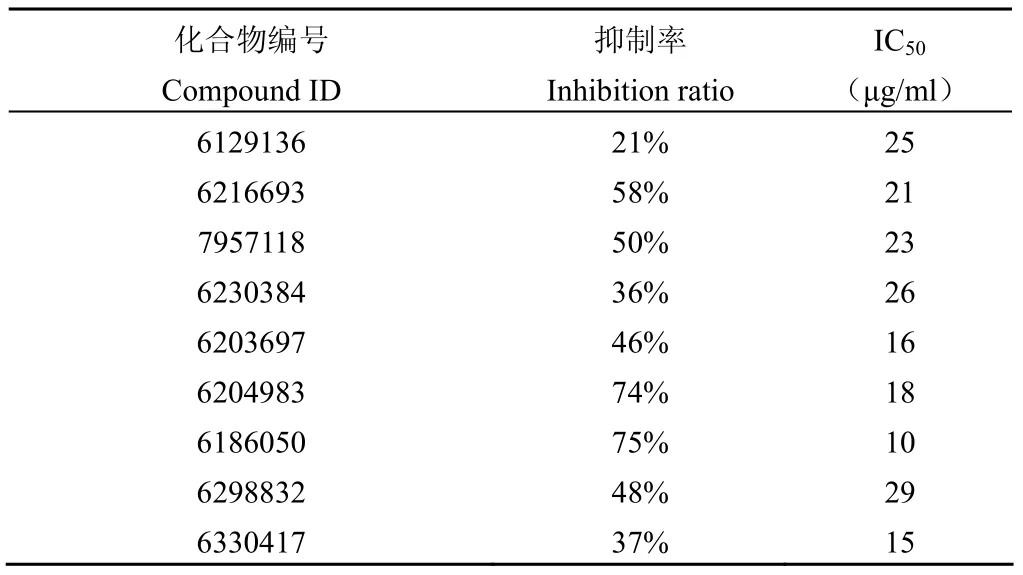
表1 各活性化合物對MtSD 抑制率及 IC50Table 1 The inhibition ratio of active compoundsfor recombinantMtSD and IC50
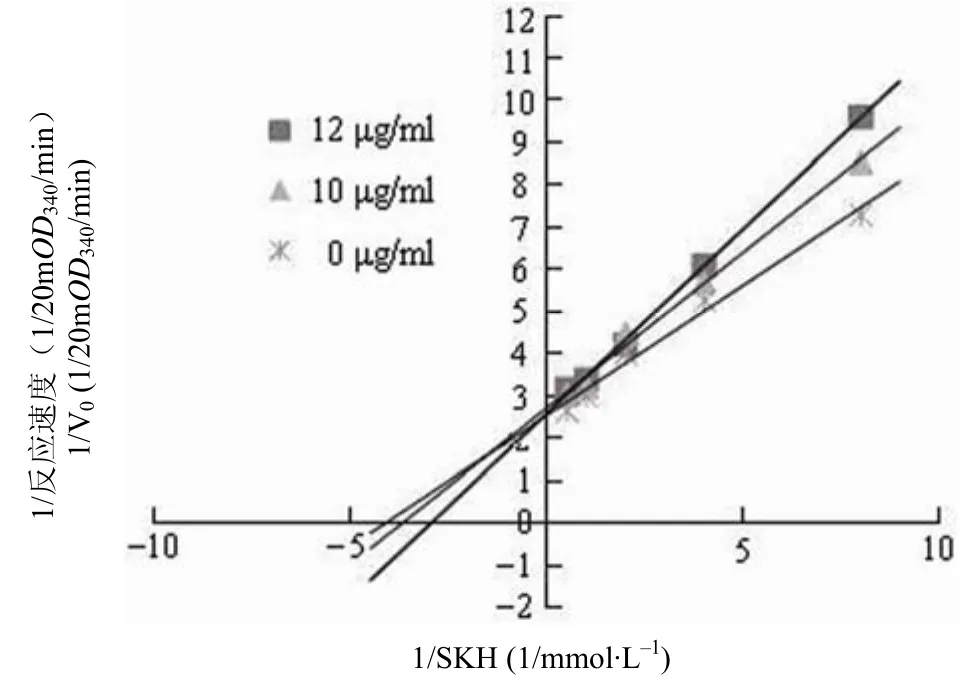
圖6 抑制劑 6186050 動力學Figure 6 The kinetics of inhibitor 6186050
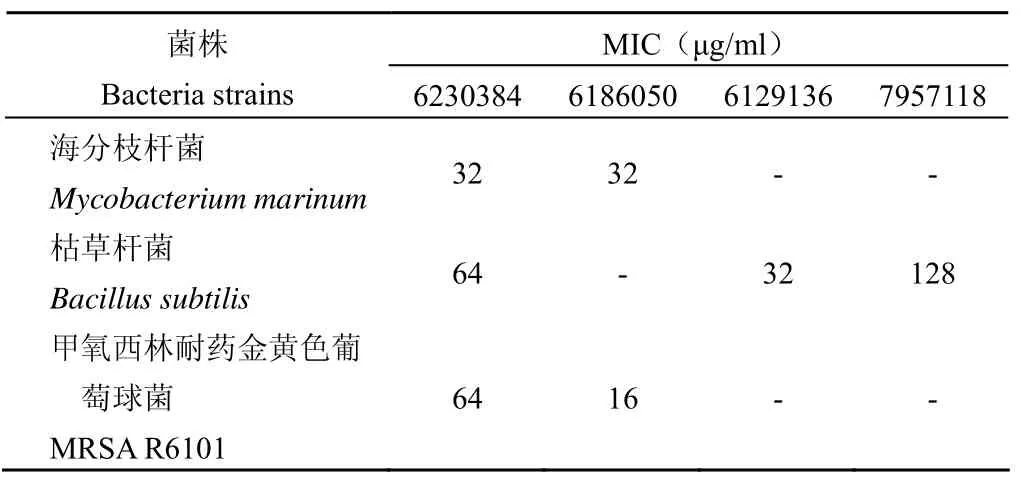
表2 抑制劑對菌株的 MICTable 2 The MIC of inhibitors to bacterial strains
3 討論
MtSD 是 MTB 莽草酸代謝途徑中關鍵酶,重組工程菌 37 ℃ IPTG 誘導和 20 ℃ 自誘導 24 h后,大部分表達的MtSD 蛋白都以包涵體的形式存在,對其氨基酸序列分析,發現序列中具有三個半胱氨酸,因而在大腸桿菌中表達很容易由于不正確折疊而形成包涵體。查閱相關的文獻[5-6]后,確立使用反復凍融 5 次再壓力破碎的方法裂解菌體,可使菌體中可溶性的MtSD 得到充分釋放,另外在裂解緩沖液中加入 0.1% 的 Triton 能提高可溶性MtSD 的產量。對純化過程中的各組分進行收集,發現柱子流穿液和雜峰洗脫液中都能檢測到MtSD活性,離心沉淀不具有活性,說明MtSD 跟 His 親和柱結合能力不強。
本實驗依據反應產物 NADPH 的吸收特性對MtSD 蛋白的活性進行測定,通過對反應體系的溫度、pH、底物濃度、酶量、DMSO 等條件的優化,建立了MtSD 抑制劑的 HTS篩選模型,其Z′ 因子值達到了0.76 ± 0.04。通過對本所 5 萬余個化合物進行篩選,表明該模型快速、靈敏、穩定等特點,為尋找和發現MtSD抑制劑提供了一種新的技術和方法。
對 Helen A. Arcuri 同源模建的MtSD 結構分析,NADPH 結合的區域在 N 端,其催化區域分布在 C 端,并且 NADPH 的結合對蛋白的結構變化不大[11],抑制劑 6186050 與NADPH 競爭性結合,因此抑制劑 6186050 與MtSD 相互作用后可能對酶的空間結構不會產生太大影響,當然這還需實驗證實。抑制劑 6230384 和 6186050 對海分枝桿菌的 MIC都是 32 μg/ml,MTB 和海分枝桿菌的SD 酶(YP_001850477.1)的同源性高達 83%,而且海分枝桿菌在遺傳上是與 MTB 關系最近的:基因組序列有 85% 與 MTB 具有同源性[12],這些抑制劑的抗結核活性還需要進一步驗證。
志謝感謝上海復旦大學王洪海老師實驗室提供的 SD 表達工程菌株。
[1] WHO. Tuberculosis. [2012-02-05]. http://www.who.int/topics/tuberculosis/ en/.
[2] Knaggs AR. The biosynthesis of shikimate metabolites. Nat Prod Rep, 2003, 20(1):119-136.
[3] Bentley R. The shikimate pathway--a metabolic tree with many branches. Crit Rev Biochem Mol Bio1, 1990, 25:307-384.
[4] Kapnick SM, Zhang Y. New tuberculosis drug development: targeting the shikimate pathway. Expert Opin Drug Discov, 2008, 3(5):565-577.
[5] Zhang X, Zhang S, Hao F, et al. Expression, purification and properties of shikimate dehydrogenase from mycobacterium tuberculosis. J Biochem Mol Biol, 2005, 38(5):624-631.
[6] Magalh?es ML, Pereira CP, Basso LA, et al. Cloning and expression of functional shikimate dehydrogenase (EC 1.1.1.25) from Mycobacterium tuberculosis H37Rv. Protein Expr Puri, 2002, 26(1): 59-64.
[7] Ausubel FM, Brent R, Kingstone RE, et al. Short protocol in molecular biology. Yan ZY, Wang HL, Translation. Beijing: Science Press, 1999:334-338. ( in Chinese) Ausubel FM, Brent R, Kingstone RE, et al. 精編分子生物學實驗指南. 顏子穎, 王海林, 譯. 北京: 科學出版社, 1999:334-338.
[8] Stamm LM, Brown EJ. Mycobacterium marinum: the generalization and specialization of a pathogenic mycobacterium. Microbes Infect, 2004, 6(15):1418-1428.
[9] Ni YX, Shang H. Clinical microbiology and inspection. 4th ed. Beijing: People’s Medical Publishing House, 2008:60-61. (in Chinese)倪語星, 尚紅. 臨床微生物學與檢驗. 4版. 北京: 人民衛生出版社, 2008:60-61.
[10] Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2):67-73.
[11] Arcuri HA, Borges JC, Fonseca IO, et al. Structural studies of shikimate 5-dehydrogenase from Mycobacterium tuberculosis. Proteins, 2008, 72(2):720-730.
[12] Tobin DM, Ramakrishnan L. Comparative pathogenesis of Mycobacterium marinum and Mycobacterium tuberculosis. Cell Microbiol, 2008, 10(5):1027-1039.
Establishment and application of a high-throughput screening model targeting to shikimate dehydrogenase from Mycobacterium tuberculosis H37Rv
CHEN Xiao-juan, CUI Jia-fei, YANG Yan-hui, GUAN Yan, ZHANG Xue-lian, XIAO Chun-ling
ObjectiveTo establish a high-throughput screening (HTS) model targeting Mycobacterium tuberculosis shikimate dehydrogenase (MtSD) for the discovery of novel antituberculosis drugs. The established model was used to screen inhibitors targeting MtSD and to explore the effects of compounds on the activity of SD.MethodsAfter expression and purification, MtSD activity was measured by detecting the absorption of NADPH at 340 nm wavelength in solution. HTS was established based on the activity of SD and Z' factors were used to evaluate the quality of the HTS model. 50 000 compounds were screened by using this model and IC50of inhibitors were determined, besides the enzyme kinetics of inhibitor 6186050 was investigated. Some bacterial strains segregated from clinical were evaluated for the effect of inhibitors by the method of diluting liquid.ResultsRecombinant MtSD was successfully obtained and has the optimal activity 20987 U/mg. The parameter Z' factor was 0.76. It was suggested that the model was highly feasible and stable for HTS drug screening. 9 compounds were found to inhibit MtSD using the HTS model, and the inhibitory effect of inhibitor 6185020 on the activity of SD was reversible. Both of the MIC of inhibitors 6230384 and 6186050 were 32 μg/ml for Mycobacterium marinum.ConclusionA steady and sensitive HTS model for potential MtSD inhibitors was established. The hits of MtSD inhibitors possess bacteriostasis activity.
Mycobacterium tuberculosis; Enzyme inhibitors; Gene expression; Shikimate dehydrogenase
s:ZHANG Xue-lian, Email: xuelianzhang@fudan.edu.cn; XIAO Chun-ling, Email: xiaoc1318@163.com
10.3969/cmba.j.issn.1673-713X.2012.03.006
“重大傳染病防治”科技重大專項(2008ZX10003-006)
100050 北京,中國醫學科學院北京協和醫學院醫藥生物技術研究所國家新藥(微生物)篩選實驗室(陳小娟、崔佳飛、楊延輝、關艷、肖春玲);200433 上海,復旦大學生命科學學院遺傳所遺傳工程國家重點實驗室(張雪蓮)
張雪蓮,Email:xuelianzhang@fudan.edu.cn;肖春玲,Email:xiaoc1318@163.com
2012-02-24
方法表達并純化結核分枝桿菌 H37Rv 莽草酸脫氫酶;利用還原型輔酶 II(NADPH)在溶液中的光吸收,測定酶的活性,構建了該酶抑制劑的高通量篩選模型;用 Z′ 因子法評價該模型的可靠性,并對 5 萬余個化合物進行篩選;測定了各抑制劑的 IC50并對抑制劑 6186050 的酶抑制動力學進行了研究;用菌液稀釋法評價了抑制劑對某些臨床分離菌株包括耐藥菌株的影響。
結果得到了重組莽草酸脫氫酶;測得比活力為 20987 U/mg,所建的莽草酸脫氫酶高通量篩選模型 Z′ 因子為 0.76,符合高通量篩選的要求;對 5 萬余個化合物進行篩選得到 9 個抑制率較高的化合物;抑制劑 6186050 為競爭性可逆抑制劑;抑制劑 6230384 和 6186050 對海分枝桿菌的最低抑菌濃度(MIC)都是 32 μg/ml。
結論建立了穩定性好、靈敏度較高的結核分枝桿菌莽草酸脫氫酶抑制劑高通量藥物篩選模型,應用該模型篩選得到的抑制劑可能具有抑菌活性。
Author Affiliations:National Laboratory for Screening New Microbial Drugs, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union medical college, Beijing 100050, China (CHEN Xiao-juan, CUI Jia-fei, YANG Yan-hui, GUAN Yan, XIAO Chun-ling); State Key Laboratory of Genetic Engineering, Institute of Genetics, School of Life Sciences, Fudan University, Shanghai 200433, China (ZHANG Xue-lian)
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(3):191-196

