整聯蛋白及其信號轉導途徑對骨骼肌生長發育的調控
李欣蔚 張 勇
(沈陽農業大學畜牧獸醫學院,沈陽110866)
整聯蛋白(integrin)是由α和β2個非共價鍵結合的跨膜亞基組成的異源二聚體,α和β亞基均由氨基酸序列較長的胞外區、跨膜區和氨基酸序列較短的胞質區組成(只有β4亞基有長的胞質區),α和β鏈的氨基末端形成的球形區域部分為胞外配體結合域[1]。有研究表明,在果蠅中,整聯蛋白在細胞黏附、細胞遷移、細胞增殖和細胞凋亡等過程中同樣發揮重要作用[2-3]。同時,Elizabeth等[4]指出,整聯蛋白黏著復合物會促進特定肌肉組織的發育,主要是通過促進蛋白質合成以及加強細胞原有功能實現的。整聯蛋白通過介導細胞外基質,構成整聯蛋白信號通路來完成對細胞凋亡、細胞增殖以及細胞遷移的信號轉導調控[5]。
1 整聯蛋白配體的生物學特性及其信號通路的特點
1.1 整聯蛋白配體的結構和生物學特性
由于α亞基具有18種不同構型,而β亞基具有8種不同構型,故整聯蛋白可以組成24種α、β異源二聚體復合物。多數α亞基只能與1種β亞基結合構成異源二聚體,但有些α亞基可與幾種不同的β亞基組合;而大部分β亞基則可以結合多種不同的α亞基;同時,β1、β3、β4、α3、α6、αⅡb等亞基的基因mRNA分子可有不同的剪接形式。以上諸多因素都增加了整聯蛋白分子的多樣性。
α和β亞基均由胞外區和胞漿區組成,胞外區和胞漿區共含有700~1 000個氨基酸。α亞基的胞外區由Ⅰ結構域、β-螺旋槳(β-propeller)、thigh、Calf-1、Calf-2構成。而β亞基(β1~β8)包含8個胞外區,即Ⅰ結構域、hybrid、神經叢蛋白-腦信號蛋白-整聯蛋白(plexin-semaphorin-integrin,PSI)子域、β-尾區和4個類表皮生長因子(EGF-like)子域[6]。以整聯蛋白β1為例,如圖1[7]所示:整聯蛋白β1共含有831個氨基酸,其信號肽含有20個氨基酸殘基,位于氨基酸1~20;胞外區域的氨基端部分(INB)是保守子域,共含有449個氨基酸殘基,位于氨基酸37~485;i-like子域位于INB區域內,是A型超家族子域中的成員,該家族含有一種原型分子,叫做von willebrand因子;金屬離子依賴性黏附位點(metal ion dependent adhesion site,MIDAS)氨基酸序列在173~177;PSI子域位于氨基酸31~73;EGF-like子域位于氨基酸513~524和607~618。其中,MIDAS存在于β亞基和部分α亞基的Ⅰ結構域,并位于具有調節作用的Ca2+結合位點附近,Mg2+、Mn2+和Ca2+均可以與 MIDAS相互作用使得整聯蛋白構象改變,從而導致其與配體的結合或解離[8]。
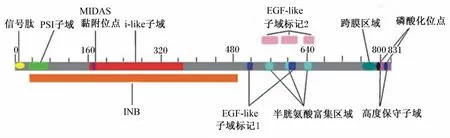
圖1 整聯蛋白β1的氨基酸序列及保守子域Fig.1 Amino acid sequence and conserved domains of integrinβ1[7]
1.2 整聯蛋白及其信號轉導途徑的活化特點
整聯蛋白作為介導信號傳遞的膜分子,是通過獨特的途徑轉導信號來調節細胞的各種生物學功能的。而整聯蛋白的活化主要通過觸發由細胞內到細胞外的信號轉導,從而實現與細胞外配體的低親和力狀態到高親和力狀態的改變,即整聯蛋白信號系統。而最新研究發現,動物受到應激后,激活的細胞外信號調節激酶(extracellular regulated kinase,ERK)會移動到細胞核表面激活整聯蛋白系統[9]。
在整聯蛋白的活化過程中,小鼠黏著斑蛋白-3(kindlin-3)基因敲除的試驗證實:kindlin-3才是整聯蛋白活化所必需的[10-12]。同時,黏著斑蛋白-1(kindlin-1)可與整聯蛋白β1和整聯蛋白β3胞質區作用,而kindlin-3能與白細胞特異性的整聯蛋白β2胞質區結合[11]。有研究表明,盡管多種蛋白質都可以與β整聯蛋白胞質區發生相互作用,但此前只有踝蛋白被確切證實能夠觸發整聯蛋白的活化[13],而黏著斑蛋白(kindlin)的F3子域中的TxxNxxY序列是其主要的結合位點[14]。當整聯蛋白的β亞基的胞質尾區與F3子域結合后,破壞了α、β之間的鹽橋,繼而觸發α、β跨膜構象轉變為高親和力構象[15]。
整聯蛋白系統被活化后,黏著斑激酶(focal adhesion kinase,FAK)是胞內第1個信號分子,首先進行磷酸化。FAK廣泛分布于血小板、內皮細胞、中性粒細胞和單核細胞等細胞的胞質中,在細胞遷移中發揮作用[16-19]。繼而由整聯蛋白連接激酶(integrin-linked kinase,ILK)作為蛋白質間相互作用網絡中的集結點,通過其偶聯的信號通路,在調節細胞生物學功能上發揮多種效應。具體信號通路是:當整聯蛋白依賴的細胞黏附激活磷酸肌醇-3激酶(PI3K),其產物多磷酸肌醇(PIP)可激活ILK[20]。
2 由整聯蛋白系統介導的ERK信號通路的生物學功能
整聯蛋白不僅可以通過識別細胞外基質的精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列介導細胞與細胞外基質之間的黏附,與免疫球蛋白超家族分子結構介導細胞與細胞間的黏附,還可以雙向轉導細胞內外的信號,直接影響細胞的生存、生長、增殖、分化以及凋亡等生物學行為。Fong等[21]研究發現,骨橋蛋白可以識別整聯蛋白αⅤβ3,啟動FAK/激活磷酸肌醇3(PI3)/ERK細胞內信號通路,進而促進細胞遷移。Roman等[22]以及Shibue等[23]也指出,整聯蛋白β1可以通過細胞外信號調節激酶1(ERK1)/細胞外信號調節激酶2(ERK2)信號通路上游的FAK調控細胞的增殖,通過抑制活化的整聯蛋白α3,利用FAK/ERK/核轉錄因子κB(NFκB)信號途徑調控基質金屬蛋 白 酶 (matrix metalloproteinase,MMP)的表達。
此外,在硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycans,HSPGs)介導細胞分布以及維持細胞骨架硬度的過程中,整聯蛋白通過下調FAK/ERK信號通路來發揮重要的動力轉導作用。如圖2[24]所示,HSPGs可以通過與整聯蛋白調控的細胞基質黏附復合物共區域化,或者通過皮層肌動蛋白細胞骨架上的黏附復合物相互作用,或者同時發 揮 以 上 2 種 作 用 來 激 活 FAK/ERK/c-Jun/MMP-13信號中樞。活化后的信號通路不僅可以調控MMP-13的表達,而且有研究指出,在皮膚損傷修復以及成肌纖維細胞的分化過程中,通過胞間質的作用,整聯蛋白也發揮了重要的動力轉導作用[25]。
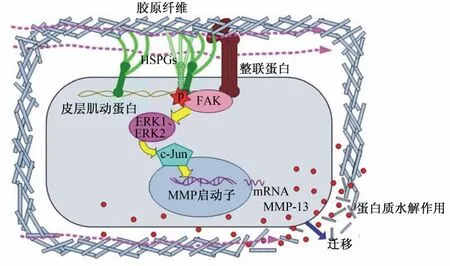
圖2 整聯蛋白在FAK/ERK信號通路中的動力轉導作用Fig.2 The mechanotransduction of integrin in FAK/ERK signal pathway[24]
3 整聯蛋白及其信號轉導途徑對動物肌肉生長發育的調控
3.1 整聯蛋白對動物肌肉生長發育的調控
骨骼肌的生長發育是一個十分復雜的過程,涉及大量基因的表達及網絡式調控[26]。而骨骼肌生長速度最終取決于骨骼肌細胞的數量、肌肉蛋白質合成和降解速度[27]。在骨骼肌發育過程中,肌肉組織之所以能夠構建成為可伸展的、可受力的分生組織,是因為整聯蛋白及其調控的細胞黏著力提供了結構上的穩定性。同樣的,有研究表明,在骨骼肌形成過程中,整聯蛋白集中在Z線,整聯蛋白缺乏將會導致Z線發育缺陷[28]。Perkins等[29]的試驗表明,骨骼肌中的整聯蛋白調控的黏著力下降會導致肌肉功能的逐漸缺失,原因在于肌節細胞結構無法維持。而這種肌肉功能上的缺失是漸進的,隨著年齡的增長,肌節肌動蛋白、Z線和M線會出現解離。電子顯微鏡顯微分析顯示,由于整聯蛋白在黏著力調控過程中發生的還原反應,細絲蛋白會與Z線解離,隨后Z線與細胞膜逐漸分離,最終導致Z線的分解。與此同時,整聯蛋白可作為骨骼肌層粘連蛋白網絡調控的細胞膜受體,參與骨骼肌細胞骨架的形成和細胞內信號途徑的介導[30]。
3.2 由泛素介導的整聯蛋白下游存活信號通路對肌肉發育的影響
泛素(ubiquitin)是一類高度保守的蛋白質,含有76個氨基酸,分子質量大約為8 500u。泛素家族除了保持有限序列的同源性以外,所有的泛素家族成員都具有典型的β-grasp泛素折疊,這也顯示出泛素家族結構上的同源性[31]。泛素存在于大多數真核細胞中,它的主要功能是標記需要分解掉的蛋白質,使其被水解。當附有泛素的蛋白質移動到桶狀的蛋白酶的時候,蛋白酶就會將蛋白質水解。有研究表明,整聯蛋白β1的活化作用和泛素的表達均可以激活PI3K/蛋白激酶B(Akt)通路來進一步抑制細胞凋亡[32]。
在肌間盤和肋節間,整聯蛋白β1與多種蛋白質如骨骼肌特異蛋白質(muscle-specific protein,melusin)相銜接(圖3[33])。β腎上腺素受體刺激成人的心肌細胞,繼而引起糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)和c-Jun氨基端激酶(JNK)的活化,在整聯蛋白β1和基質金屬蛋白酶-2(matrix metalloproteinase-2,MMP-2)的參與完成下游信號的傳導,引起細胞凋亡。另有研究表明[34],阻止 MMP-2的活化會導致肌細胞骨架重組受抑制,同時引起肌細胞功能性異常。同樣的,切斷melusin基因后也會抑制Akt介導的GSK3β的磷酸化作用,繼而抑制了細胞凋亡。同時,泛素介導的信號通路中所涉及的諸多蛋白質分子,將會被肌細胞骨架所重新吸收,然后完成下游信號通路的轉導。在β腎上腺素受體的刺激下,整聯蛋白β3不會被心肌細胞的閏盤泛素化,而在這段時間,酪氨酸激酶活化后的下游因子——黏著斑復合體(focal adhesion complex,FAC)逐漸形成。所以,在β腎上腺素受體的刺激下,整聯蛋白β1和整聯蛋白β3都會引起肌細胞的代償性生長,整聯蛋白與其他蛋白質共同形成了網絡式的級聯反應,而在這些級聯反應中,由泛素介導的整聯蛋白β1下游存活信號通路會被不斷激活。

圖3 由泛素介導的整聯蛋白β1下游存活通路Fig.3 Ubiquitin-mediated survival signaling downstream of integrinβ1[33]
4 小 結
整聯蛋白是一類細胞表面受體分子家族,廣泛存在于各種組織中,可使細胞黏附于胞外基質并介導來自基質的機械信號和化學信號,具有激活胞漿激酶和維持生長因子的生物活性,實現細胞外基質-整聯蛋白-細胞內的信號轉導功能。而骨骼肌生長發育需要蛋白質合成和降解之間的平衡,涉及合成代謝與分解代謝之間的比例關系。因此,根據整聯蛋白信號通路的特點可以推測,在肌肉蛋白質降解和合成代謝過程中,整聯蛋白及其信號通路很可能發揮重要作用。目前,對于整聯蛋白的研究尚處于人類和動物疾病的預防及治療階段,在肌肉發育以及動物肉品質改良方面甚少。所以,深入研究整聯蛋白及其信號通路在肌肉發育方面的調控機理,便可以通過調節整聯蛋白信號途徑來進一步改善動物肉品質,可以說,在動物營養領域的研究中,整聯蛋白及其信號通路極具研究前景。
[1] LUO B H,CARMAN C V,SPRINGER T A.Structural basis of integrin regulation and signaling[J].Annual Review Immunology,2007,25(6):619-647.
[2] O'REILLYA M,LEE H H,SIMON M A.Integrins control the positioning and proliferation of follicle stem cells in the Drosophila ovary[J].Journal of Cell Biology,2008,182:801-815.
[3] DINKINS M B,FRATTO V M,LEMOSY E K.Integrinαchain exhibit distinct temporal and spatial localization patterns in epithelial cells of the Drosophila ovary[J].Developmental Dynamics,2008,237:3927-3939.
[4] ETHERIDGE T,OCZYPOK E A,LEHMANN S,et al.Calpains mediate integrin attachment complex maintenance of adoult muscle in Caenorhabditis elegans[J].PLoS Gentics,2012,1(8):1-20.
[5] SEJEONG S,LAURA W,SANG-OH Y.Integrin trafficking and tumor progression[J].International Journal of Cell Biology,2012,2012:1-7.
[6] STEWART P L,NEMEROS G R.Cell integrins:commonly used receptors for diverse viral pathogens[J].Trends Microbiol,2007,15(11):500-507.
[7] HU J,ZHAO H F,LIU J,et al.Integrinβ1subunit from Ostrinia furnacalis hemocytes:molecular characterization,express,and effects on the spreading of plasmatocytes[J].Journal of Insect Physiology,2010,56:1846-1856.
[8] WEGENER K L.Structural basis of integrin activation by talin[J].Cell,2007,128(1):171-182.
[9] BHARADWAJ S,VASABTH G,MASUELLI L,et al.Inhibition of nuclear accumulation of phosphorylated ERK by tropomyosin-1-mediated cytoskeletal reorganization[J].Cancer Molecular,2008,4(5):139-144.
[10] MOSER M,NIESWANDT B,USSAR S,et al.Kindlin-3is essential for integrin activation and platelet aggregation[J].Nature Medicine,2008,14(3):325-330.
[11] MOSER M,BAUER M,SCHMID S,et al.Kindlin-2 is required for myocyte elongation and is essential for myogensis[J].BioMed Central Cell Biology,2008,9:36.
[12] LARJAVA H,WU C.Kindlins:essential regulators of integrin signalling and cell-matrix adhesion[J].European Molecular Biology Organization Reports,2008,9(12):1203-1208.
[13] WEGENER K L,PARTRIDGE A W,HAN J,et al.Structural basis of integrin activation by talin[J].Cell,2007,128(1):171-182.
[14] MA Y Q,QIN J,WU C,et al.Kindlin-2 (Mig-2):a co-activator ofβ3integrins[J].Cell Biology,2008,181(3):439-446.
[15] XIONG J P,ALONSO J L.Crystal structure of the complete integrinαⅤβ3ectodomain plus anα/βtransmembrane fragmanet[J].Journal of Cell Biology,2009,186(4):589-600.
[16] JONES M L,SHAWE-TAYLOR A J,WILLIAMS C M,et al.Characterization of a novel focal adhesion kinase inhibitor in human plateles[J].Biochemical and Biophysical Research Communications,2009,389(1):198-203.
[17] TAVORA B,BATISTA S,REYNOLDS L E,et al.Endothelial FAK is required for tumour angiogenesis[J].European Molecular Biology Organization Molecular Medicine,2010,2(12):516-528.
[18] KASORN A,ALCAIDE P,JIA Y,et al.Focal adhesion kinase regulates pathogen-killing capability and life span of neutrophils via mediating both adhesiondependent and-independent cellular signals[J].Journal of Immunology,2009,183(2):1032-1043.
[19] PARK Y M,FEBBRAIO M,SILVERSTEIN R L.CD36modulates migration of mouse and human macrophages in response to oxidized LDL and may contribute to macrophage trapping in the arterial intima[J].Journal of Clinical Investigation,2009,119(1):136-145.
[20] MCDONALD P C,OLOUMI A,MILLS J,et al.Rictor and integrin-linked kinase interact and regulate Akt phosphorylation and cancer cell survival[J].Cancer Research,2008,68(6):1618-1624.
[21] FONG Y C,LIU S C,HUANG C Y,et al.Osteopontin increases lung cancer cells migration via activation of theαⅤβ3integrin/FAK/Akt and NF-κB-dependent pathway[J].Lung Cancer,2009,64(3):263-270.
[22] ROMAN J,RITZENTHALER J D,ROSER-PAGE S,et al.α5β1-integrin expression is essential for tumor progression in experimental lung cancer[J].American Journal Respiratory Cell and Molecular Biology,2010,43(6):684-691.
[23] SHIBUE T,WEINBERG R A.Integrinβ1-focal adhesion kinase signaling direcrts the proliferation of metastatic cancer cells disseminated in the lungs[J].Proceedings of the Nature Academy of Sciences(USA),2009,106(25):10290-10295.
[24] SHI Z D,WANG H,JOHN M,et al.Heparan sulfate proteoglycans mediate interstitial flow mechanotransduction regulating MMP-13expression and cell motility via FAK-ERK in 3Dcollagen[J].PloS One,2011,6(1):1-10.
[25] HUANG C Y,FU X L,LIU J,et al.The involvement of integrinβ1signaling in the migration and myofibroblastic differentiation of skin fibroblasts on anisotropic collagen-containing nanofibers[J].Biomaterials,2012,33:1791-1800.
[26] 張勇,孫璀.鈣調磷酸酶-活化T細胞核因子信號途徑在骨骼肌細胞生長和發育中生理作用的研究進展[J].動物營養學報,2011,23(4):536-541.
[27] 張勇,鄧科.骨骼肌特異性蛋白酶與蛋白質降解[J].動物營養學報,2011,23(4):542-545.
[28] SPARROW J C,SCHOCK F.The initial steps of myofibril assembly:integrins pave the way[J].Nature Reviews Molecular Cell Biology,2009,10:293-298.
[29] PERKINS A D,STEPHANIE J,SHAMSIAN P A I,et al.Integrin-mediated adhesion maintains sarcomeric integrity[J].Developmental Biology,2010,338:15-27.
[30] GAWLIK K I,DURBEEJ M.Skeletal muscle laminin and MDC1A:pathogenesis and treatment strategies[J].Skeletal Muscle,2011(1):2-13.
[31] VERTEGAAL A O.Uncovering ubiquitin and ubiquitin-like signaling networks[J].American Chemical Society,2011,111(12):7923-7940.
[32] SINGH M,ROGINSKAYA M,DALAL S,et al.Extracellular ubiquitin inhibitsβ-AR-stimulated apoptosis in cardiac myocytes:role of GSK-3βand mitochondrial pathways[J].Cardiovascular Research,2010,86(1):20-28.
[33] HARSTON R K,KUPPUSWAMY D.Integrins are the necessary links to hypertrophic growth in cardiomyocytes[J].Journal of Signal Transduction,2011,10:1-8.
[34] MENON B,SINGH M,ROSS R S,et al.β-adrenergic receptor-stimulated apoptosis in adult cardiacmyocytes involves MMP-2-mediated disruption ofβintegrin signaling and mitochondrial pathway[J].American Journal of Physiology,2006,290(1):254-261.

