白穎苔草熱激轉錄因子(HSF1)真核表達載體的構建
孫 彥,郭校民,周 禾
(中國農業大學動物科技學院草業科學系 草業科學北京市重點實驗室,北京 100193)
白穎苔草(Carexrigescens)別名小羊胡子草,隸屬于莎草科苔草屬。喜冷涼氣候,耐寒力強,且耐干旱、耐瘠薄,能適應多種土壤類型。該草葉綠、纖細,外形整齊美觀,是很好的疏林游樂草坪植物,我國北方地區多用作觀賞草坪和裝飾草坪,也可用作高速公路、鐵路兩旁等優良的地被植物以及人流量不多的公園、庭院、街道、花壇等綠化材料[1]。
在植物細胞內有一種轉錄調節因子在熱激條件下可以激活熱激基因的表達,被稱為熱激轉錄因子(HSF)[2]。隨著對植物逆境響應研究的逐漸深入,熱激因子參與植物環境脅迫響應的證據越來越多[3-7]。迄今,研究人員已在多種生物體內發現了不同種類的HSF,并通過多種方法探明了HSF分子上的大部分重要結構,同時對這些重要結構的定位、空間構象、功能及調節進行了充分的研究[8-10]。
對于草坪草相關熱激轉錄因子的研究報道很少,黨衛玲[11]已完成白穎苔草熱激轉錄因子基因的克隆,本研究進行白穎苔草熱激轉錄因子(HSF1)真核表達載體的構建,以期為進一步研究HSF1在熱激蛋白(HSP)合成及提高植物耐熱性中的作用和培育耐熱植物新品種奠定基礎。
1 材料與方法
1.1材料
1.1.1菌株和克隆載體 用于轉化真核生物的農桿菌LBA4404菌株,用于克隆和載體構建的大腸桿菌DH5α菌株、CrHsf全長cDNA的大腸桿菌菌液及真核表達載體PBI 121(圖1)均由中國農業科學院北京畜牧獸醫研究所保存。克隆載體Pmd-18T由TaKaRa公司提供。載體在pUC18載體的多克隆位點處的Xba I和Sal I識別位點之間插入了EcoR V識別位點,用EcoR V進行酶切反應后,再在兩側的3′端添加“T”而成。因大部分耐熱性DNA聚合酶反應時都有在PCR產物的3′端添加一個“A”的特性,使PCR產物的連接、克隆效率大大提高。pMD-18T載體圖譜如圖2。
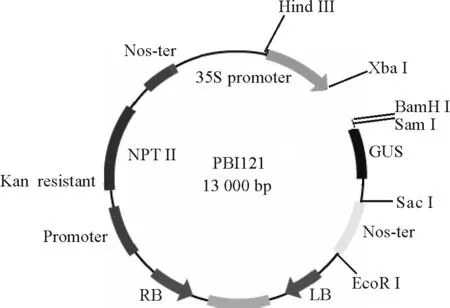
圖1 真核表達載體PBI 121
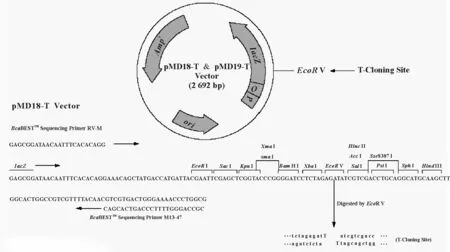
圖2 pMD-18T載體圖譜
1.1.2溶液的配制 10×TAE:Tris 48.4 g,冰醋酸11.42 mL,0.5 mol·L-1EDTA(pH值8.0)20 mL,加水定容至1 L。
6×DNA Loading Buffer:0.25%溴酚藍,40%甘油水溶液,4 ℃保存。
LB培養基(1 L):蛋白胨10 g,酵母提取物5 g,NaCl 10 g,調pH值至7.0(固體培養基每升加10 g瓊脂粉),高壓滅菌20 min。
YEB培養基:牛肉浸膏5 g,酵母提取物1 g,胰化蛋白胨5 g,蔗糖5 g,氨芐青霉素(Amp)貯液(100 mg·mL-1)即100 mg Amp溶于1 mL蒸餾水中,-20 ℃保存。
溶液 Ⅰ:50 mmol·L-1Tris·HCl(pH值7.5),10 mmol·L-1EDTA(pH值8.0),高壓滅菌。
溶液Ⅱ:0.2 mol·L-1NaOH,1% SDS,分別配制0.4 mol·L-1NaOH和2% SDS的貯液,使用時以1∶1比例混合。
溶液Ⅲ:1.32 mol·L-1KAc(pH值4.8),高壓滅菌。
1.2質粒PMD-CR的構建
1.2.1PCR擴增


CRHSF 全長cDNA 的大腸桿菌菌液,200 mL PCR管中混合,共25.0 μL,組分如下:ddH2O 17.75 μL,10×PCR buffer(含Mg2+)2.5 μL,dNTP(10 mmol·L-1each)0.5 μL,Primer CP1(10 μmol·L-1)1.0 μL,Primer CP2(10 μmol·L-1)1.0 μL菌液2.0 μL,Taq DNA(5 U·μL-1)0.25 μL。混合均勻后按下列條件進行反應:94 ℃ 3 min后,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 60 s,進行40循環后,72 ℃ 5 min。
1.2.2PCR產物的回收和純化
1)PCR產物在2.0%的瓊脂糖凝膠上電泳,待回收的DNA 片段經電泳分離后,從瓊脂糖凝膠上切下所需的DNA片段,放在1.5 mL離心管中,稱取質量。
2)加入3倍體積的溶膠液PN,50 ℃水浴放置10 min,期間不斷溫和地翻轉離心管,直至瓊脂糖凝膠完全溶解。
3)待膠溶液冷卻至室溫后,將其加入一個吸附柱CA2中,13 000 r·min-1,離心30 s,倒掉收集管中的廢液,將吸附柱重新放入收集管中。
4)向吸附柱中加入700 L漂洗液PW,13 000 r·min-1,離心30 s,倒掉收集管中的廢液,將吸附柱重新放入收集管中。
5)向吸附柱中加入500 L漂洗液PW,13 000 r·min-1,離心30 s,倒掉收集管中的廢液,13 000 r·min-1,離心2 min,室溫干燥數分鐘,使漂洗液中的乙醇揮發完全。
6)將吸附柱放到一個干凈的離心管中,向吸附膜中間位置懸空滴加適量洗脫緩沖液EB,室溫放置2 min,13 000 r·min-1,離心1 min,收集DNA溶液。此溶液即為回收的片段。
1.2.3連接反應 將上一步回收的PCR產物直接與pMD-18T載體連接[按(3~9)∶1的摩爾比連接],反應體系:pMD-18T Vector (50 ng·μL-1)1.0 μL,PCR 產物 4.0 μL,Ligation Solution Ⅰ 5.0 μL,共10.0 μL。混勻后,16 ℃連接過夜,-20 ℃保存。
1.2.4大腸桿菌感受態細胞的制備(CaCl2法) 挑單菌落接種于LB液體培養基中,37 ℃培養過夜。取500 μL菌液加到50 mL LB液體培養基中,37 ℃震蕩培養2~3 h,至OD600值為0.3~0.5。冰浴20~30 min,9 000 r·min-1,4 ℃離心2 min,收集菌體。用預冷的20 mL 80 mmol·L-1CaCl2懸浮。冰浴20~30 min,9 500 r·min-1,4 ℃離心2 min,收集菌體。再用預冷的20 mL 80 mmol·L-1CaCl2懸浮,菌液置于冰浴中備用(12~14 h內轉化效率最高),或者加入20%甘油,每管以200 μL分裝于1.5 mL離心管中,液氮速凍后,保存于-70 ℃備用。
1.2.5連接產物的轉化 在超凈臺內將5 μL連接產物加入到200 μL的DH5α感受態細胞中,混勻,置冰上30 min。42 ℃熱激90 s,冰浴5 min。加入800 μL LB液體培養基,37 ℃振蕩培養1 h。3 500 r·min-1,離心5 min,棄去800 μL上清液,剩余物涂板于含Ampicillin(100 g·mL-1)的LB平板上。37 ℃避光培養過夜,第2天觀察結果。
1.2.6菌液PCR 隨機挑取克隆單菌落接種于含有相應抗生素的1 mL LB液體培養基中,37 ℃振蕩培養過夜。與第1次PCR擴增相同的引物對和PCR反應條件進行擴增。按下列方法準備反應體系:在200 μL PCR管中混合,共25.0 μL如下組分:ddH2O 17.75 μL,10×PCR buffer(含Mg2+)2.5 μL,dNTP(10 mmol·L-1)0.5 μL,Primer CP1(10 μmol·L-1)1.0 μL,Primer CP2(10 μmol·L-1)1.0 μL,菌液 2.0 μL,Taq DNA酶(5 U·μL-1)0.25 μL。混合均勻后按下列條件進行反應:94 ℃ 3 min后,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 60 s,40循環后,72 ℃ 5 min。
1.2.7質粒提取(堿裂解法) 將陽性(PCR擴增后,顯示有目的片斷的菌即是陽性克隆,否則就是陰性)克隆單菌落接種于含有相應抗生素的5 mL LB液體培養基中,37 ℃振蕩培養過夜。取3 mL 菌液,12 058 r·min-1,離心60 s,收集菌體。加100 μL溶液Ⅰ(50 mmol·L-1EDTA,10 mmol·L-1Tris-HCl,pH值7.5),輕輕顛倒混勻。加200 μL新配制的溶液Ⅱ(1%SDS,0.2 mol·L-1NaOH),顛倒混勻。待溶液澄清后立即加入預冷的150 μL溶液Ⅲ(1.32 mol·L-1醋酸鉀,pH值4.8),混勻后冰上放置5~10 min。12 058 r·min-1,離心10 min,棄去沉淀。加1倍體積異丙醇,室溫放置5 min。12 058 r·min-1,離心10 min。沉淀用70%乙醇洗滌2次,晾干沉淀。用50 μL含RNase A(20 μg·mL-1)的TE緩沖液溶解質粒DNA,37 ℃消化30 min,-20 ℃保存備用。該質粒命名為PMD-CR。
1.3表達載體的構建
1.3.1酶切質粒pMD-CR和表達載體PBI 121酶切的反應體系:pMD-CR(orPBI 121)8 μL,Xba I 1 μL,BamH I 1 μL,10×Buffer K 1 μL,ddH2O 9 μL, 37 ℃保溫6 h,回收目的片段。
1.3.2將酶切的目的基因片段和載體片段進行連接 連接的反應體系:PBI 121 3 μL,PMD-CR 9 μL,10× Buffer 2 μL,Ligase 1 μL,ddH2O 5 μL,共20 μL。16 ℃下保溫16 h,連接產物在-20 ℃保存或用于轉化。
1.3.3農桿菌感受態的制備 挑取根癌農桿菌單菌落于3 mL的含利福平50 μg·mL-1的YEB液體培養基,28 ℃振蕩培養過夜。取過夜培養菌液500 μL接種于50 mL YEB(含相應抗生素)液體培養基中,28 ℃振蕩培養至OD600為0.5。5 000 r·min-1,離心5 min。加10 mL 0.15 mmol·L-1NaCl懸浮農桿菌細胞,5 000r·min-1,離心5 min。1 mL預冷的20 mmol·L-1CaCl2懸浮細胞,冰浴,24 h內使用,或分裝成每管200 μL,液氮中速凍1 min,置-70 ℃保存備用。
1.3.4農桿菌轉化及鑒定 取200 μL感受態細胞,加入1 μg構建好的質粒DNA,液氮中速凍1 min,37 ℃水浴5 min,然后加入1 mL YEB培養基,28 ℃慢速振蕩培養4 h。1 000 r·min-1,離心30 s,棄上清,加入0.1 mL YEB培養基重新懸浮細胞,涂布于含有100 μg·mL-1Kna和50 μg·mL-1Rif的YEB平板上,28 ℃培養約48 h。挑取平板上長出的單菌落,接種于YEB液體培養液(含有100 μg·mL-1Kna和50 μg·mL-1Rif)中,28 ℃振蕩培養過夜。小量提取質粒DNA,以質粒DNA為模板進行PCR擴增鑒定。陽性質粒命名為PBICR,并將其測序。
2 結果與討論
2.1含有酶切位點CrHsf開放閱讀框片段的獲得 以實驗室的CrHsf 全長cDNA 的大腸桿菌菌液為材料,以 Primer CP1,Primer CP2為引物進行PCR擴增,瓊脂糖電泳檢測擴增,擴增的DNA片段與預期的1 000 bp大小一致(圖3)。
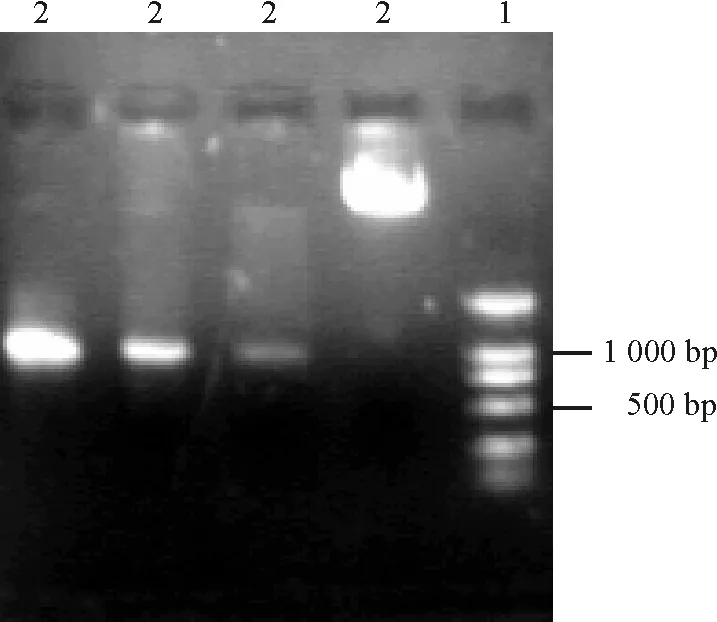
圖3 CrHsf全長cDNA的PCR擴增結果
2.2重組質粒PMD-CR的構建及酶切結果 用PCR產物回收試劑盒對cDNA PCR擴增產物進行純化回收,然后與克隆載體質粒PMD-18T進行連接,將質粒轉化大腸桿菌感受態細胞。挑取白色菌株做PCR擴增,提取質粒,連接后的質粒命名為PMD-CR。對質粒PMD-CR進行BamHⅠ和XbaⅠ雙酶切,約1 000 bp處即為目的基因片段(圖4)。結果證明,酶切后獲得了預期目的基因片段。
2.3表達載體的構建及鑒定 對植物表達載體PBI 121進行XbaⅠ/BamHⅠ雙酶切,大于2 000 bp的即為載體片段(圖5)。分別對酶切產物進行回收,把目的基因片段定向克隆到植物表達載體PBI121上,連接構建載體PBI 121-HSF。轉化農桿菌,挑取飽滿菌落進行PCR擴增和XbaⅠ/BamHⅠ雙酶切消化,有一段外源片段放出。經瓊脂糖電泳,在1 000 bp處呈現的條帶(圖6)與質粒PMD-CR雙酶切后的圖顯示一致,表明目的基因片段已插入植物表達載體PBI 121中,證明植物表達載體PBI-HSF構建成功(圖7)。載體的構建成功可以為轉基因做準備,同時可以為進一步研究HSF1基因在熱激蛋白合成及提高植物耐熱性中的作用、培育耐熱植物新品種打下一定的基礎。
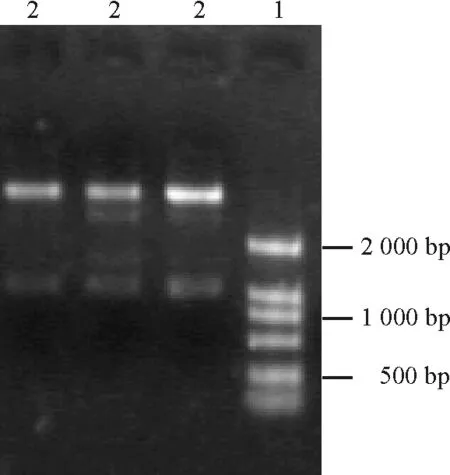
圖4 質粒PMD-18T的酶切結果
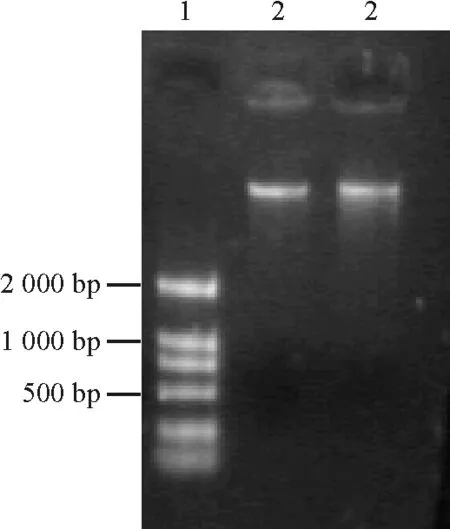
圖5 PBI 121酶切圖譜
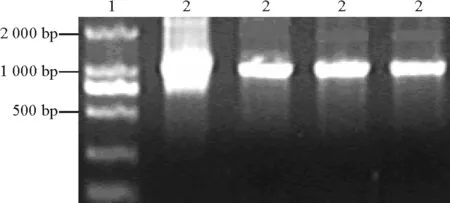
圖6 PBI-HSF酶切圖譜
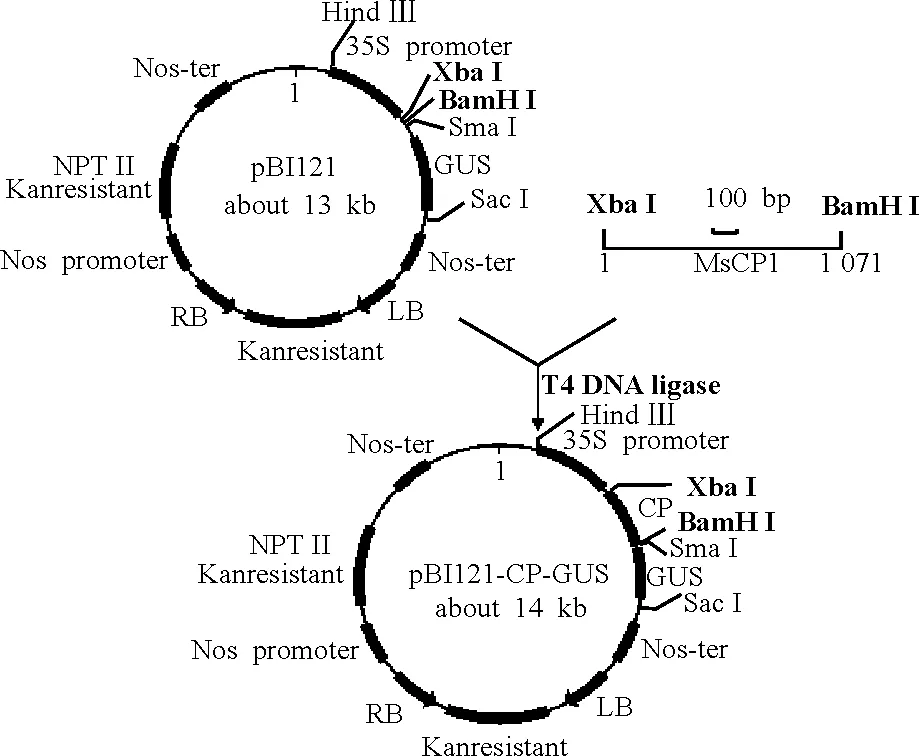
圖7 PBI 121-HSF構建圖
[1]孫彥.草坪實用技術手冊[M].北京:化學工業出版社,2001.
[2]Linquist S.The heat shock response[J].Annual Review of Biochemistry,1986,55:1151-1191.
[3]Baniwal S K,Chan K Y,Scharf K D,etal.Role of heat stress transcription factor HsfA5 as specific repressor of HsfA4[J].Journal of Biology Chemitry,2007,282(6):3605-3613.
[4]Czarnecka-Verner E,Yuan C X,Fox P C,etal.Isolation and characterization of six heat shock transcription factor cDNA clones from soybean[J].Plant Molecular Biology,1995,29(1):37-51.
[5]黃夢蘇.熱激轉錄因子基因轉化不結球白菜的研究[D].南京:南京農業大學,2002.
[6]穆睿聆.玉米熱激因子HSF1基因的克隆[D].石家莊:河北師范大學,2002.
[7]熊愛生,彭日荷,李賢,等.擬南芥熱激因子cDNA的克隆及轉化煙草研究[J].上海農業學報,2003,19(1):6-10.
[8]Gong M,van der Luit A H,Knight M R,etal.Heat-shock-induced changes in intracellular Ca2+level in tobacco seedlings in relation to thermotolerance[J].Plant Physiology,1998,116:429-437.
[9]張偉.熱休克基因轉錄的調節:熱休克轉錄因子(HSF)的結構與功能[J].第三軍醫大學學報,2002,22(2):198-200.
[10]Wu C.Heat stress transcription factors:Structure and regulation[J].Annual Reviews of Cell and Developmant Biology,1995,11:441-469.
[11]黨衛玲.編碼白穎苔草熱激轉錄因子基因的克隆及其序列分析[D].北京:中國農業大學,2007:18-43.

