擬南芥新型脂轉移蛋白AtDHyPRP1的亞細胞定位及其對灰霉菌的抗性
張晨,李嵐,徐子勤
西北大學生命科學學院 陜西省生物技術重點實驗室 西部資源與現代生物技術省部共建教育部重點實驗室,陜西 西安710069
脂轉移蛋白 (Lipid transfer protein,LTP) 廣泛存在于動物、植物和微生物中,它們對脂類分子的親和作用沒有選擇性,所以也被稱為非特異性脂轉移蛋白 (Non-specific lipid transfer protein,nsLTP)。LTP蛋白最重要的特點是含有8個位置高度保守的半胱氨酸,可以形成4個二硫鍵。它們的三級結構十分穩定,中間具有一個疏水性空穴,可以轉運多種類型的脂質分子[1]。越來越多的證據顯示 LTP參與了植物的抗病反應,它們能夠抑制病原體的生長,并產生系統性獲得抗性 (Systemic acquired resistance,SAR)[2-3],已被歸類到病程相關蛋白(Pathogenesis-related,PR) PR-14家族中[4]。在離體條件下,這類蛋白質對病原體也表現出很強的抗性[5-7]。植物幼嫩葉片的表面蠟質中包含大量的LTP蛋白,而在葉片表面發生的主要生物學事件是角質的沉積,所以很多研究認為LTP蛋白的功能是將分泌到細胞外的親脂性物質如蠟質和角質單體轉運到特定的位置[8]。
擬南芥AT4G22470基因編碼的蛋白質具有2個8CM結構域,2個富含脯氨酸結構域,由于對該基因的功能尚未見報道,本研究將其命名為AtDHyPRP1 (DOUBLE HYBRID PROLINE-RICH PROTEIN 1)。AtDHyPRP1屬于蛋白酶抑制劑/種子儲藏蛋白/脂轉移蛋白家族,氨基末端存在一段信號肽序列,在功能上可能與脂類分子的轉運有關。GENEVESTIGATOR數據庫中的基因芯片分析結果顯示AtDHyPRP1基因在擬南芥原生質體和成熟葉片中表達水平很高,它可以被丁香假單胞菌誘導。本研究利用轉基因擬南芥和煙草研究了AtDHyPRP1蛋白的亞細胞定位和它對灰霉菌的抗性。
1 材料與方法
1.1 材料
1.1.1 植物材料和細菌菌株
使用的起始材料為擬南芥 Arabidopsis thaliana Ws生態型 (Wassilewskija) 種子和秦煙Nicotiana tabacum 95種子。基因克隆實驗的受體細胞為大腸桿菌Escherichia coli DH5α,擬南芥和煙草遺傳轉化實驗采用農桿菌LBA4404。
1.1.2 主要試劑
限制性內切酶、T4 DNA連接酶和PCR Mix購自Fermentas公司和西安潤德公司,PFU DNA聚合酶、克隆載體pMD18-T和植物雙元表達載體pRI101-AN購自TaKaRa公司,植物雙元表達載體pCAMBIA1302為本實驗室保存,瓊脂糖凝膠DNA回收試劑盒、質粒小提試劑盒購自OMEGA公司,地高辛雜交檢測試劑盒為Roche公司產品。
1.2 方法
1.2.1 AtDHyPRP1過表達載體的構建
根據AtDHyPRP1基因的ORF設計一對引物,上下游引物分別為 P1、P2 (表 1)。由于AtDHyPRP1基因沒有內含子,所以本研究以擬南芥 Ws野生型植株基因組 DNA為模板進行PCR反應。將擴增產物連接到pMD18-T載體中,轉化大腸桿菌DH5α,經菌液PCR鑒定后送上海生工生物技術公司進行測序。用質粒小量提取試劑盒分離 pMD18-T-AtDHyPRP1,經 VspⅠ和SacⅠ雙酶切后用 DNA回收試劑盒 (OMEGA)回收大小為1 128 bp的AtDHyPRP1目的片段。同時用SacⅠ和VspⅠ同尾酶NdeⅠ對植物雙元表達載體pRI101-AN進行雙酶切,回收載體大片段。接著用T4 DNA連接酶進行連接,構建產生pRI101-AN-AtDHyPRP1過表達載體,經菌液PCR及酶切鑒定后送上海生工生物技術公司進行測序。質粒DNA提取、酶切、連接、轉化以及大腸桿菌感受態細胞的制備等參照《分子克隆實驗指南》中的常規方法進行[9]。
1.2.2 AtDHyPRP1-GFP融合表達載體的構建
以測序正確的 pMD18-T-AtDHyPRP1作為模板,根據AtDHyPRP1基因的開放閱讀框設計一對引物,上下游引物分別為P3、P4 (見表1)。采用PFU高保真DNA聚合酶進行PCR反應,用NcoⅠ和SpeⅠ對純化的1 128 bp的擴增產物和pCAMBIA1302-GFP進行雙酶切,用T4 DNA連接酶將 AtDHyPRP1編碼序列插入到pCAMBIA1302的35S啟動子和gfp報告基因之間,經菌液 PCR及酶切鑒定后送上海生工生物技術公司進行測序。
1.2.3 擬南芥的遺傳轉化與AtDHyPRP1蛋白的亞細胞定位
將pCAMBIA1302-AtDHyPRP1-GFP融合表達載體和含有 gfp報告基因的空載體pCAMBIA1302通過凍融法分別轉化到農桿菌菌株LBA4404中,經菌落PCR驗證后參照Bechtold和 Clough建立的方法轉化擬南芥[10-11]。按單株收集轉化當代的成熟種子,在含25 mg/L潮霉素的MS培養基上進行篩選。采用CTAB法從葉片組織提取基因組DNA[12],進行PCR鑒定。潮霉素抗性植株分析使用的上下游引物分別為 P5、P6 (表1)。將T1代AtDHyPRP1-GFP和GFP轉基因擬南芥種子消毒后播種于附加25 mg/L潮霉素的 MS培養基中,10 d后將根切下,在OLYMPUS激光掃描共聚焦顯微鏡下進行觀察。使用495~511 nm FITC濾光器拍攝GFP熒光,激發光波長為488 nm。
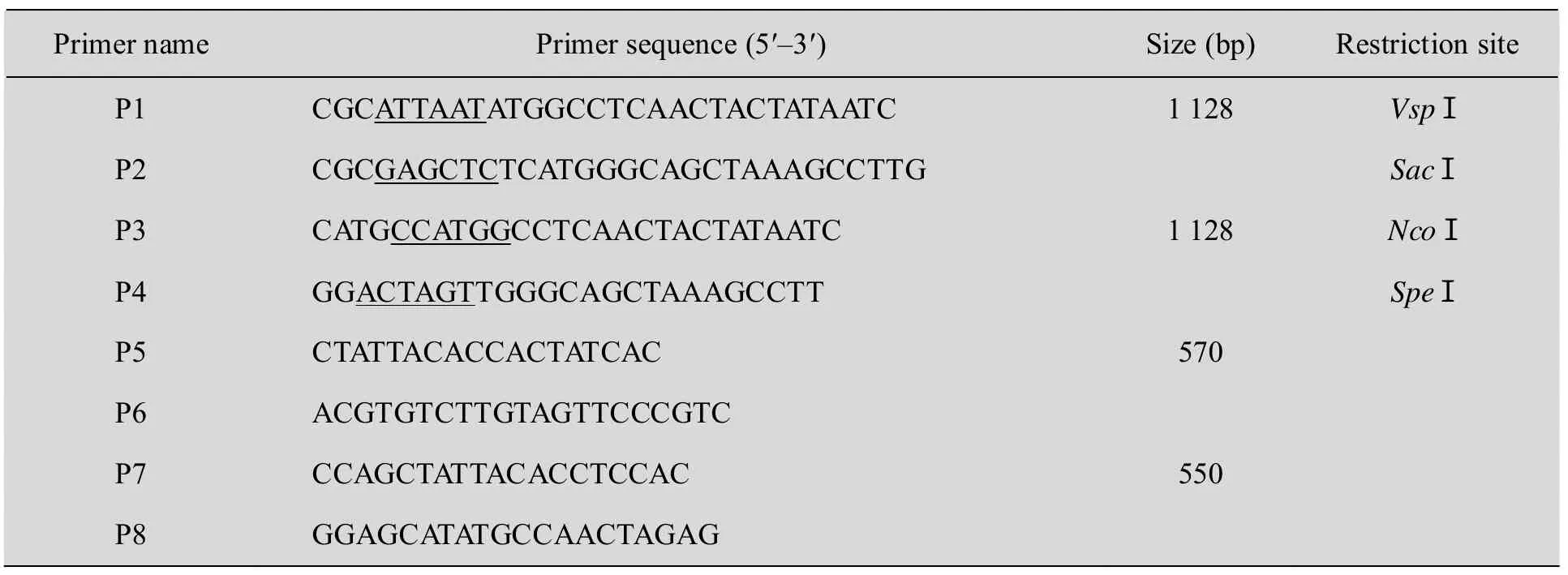
表1 PCR擴增所用引物序列Table 1 Primer sequences for PCR amplification
1.2.4 轉AtDHyPRP1煙草植株的再生和分子鑒定
采用液氮凍融法將pRI101-AN-AtDHyPRP1導入農桿菌 LBA4404感受態細胞,在附加100 μg/mL鏈霉素、50 μg/mL卡那霉素和20 μg/mL利福平的YEB培養基上進行選擇。抗性菌落經 PCR鑒定后在附加相同抗生素的YEB液體培養基中培養至 OD600≈0.5,用于煙草轉化。將煙草無菌苗葉片切成塊狀,放入農桿菌懸浮液侵染5~10 min。在含有3%蔗糖、0.65%瓊脂的MS固體培養基上暗培養3 d后,將外植體轉移到附加 0.5 mg/L IAA、3 mg/L 6-BA、50 mg/L卡那霉素 (Kan)、500 mg/L頭孢霉素 (Cef)、3%蔗糖和0.65%瓊脂的分化培養基上進行選擇。將分化出的不定芽從基部切下,轉移到附加50 mg/L卡那霉素 (Kan)、500 mg/L頭孢霉素 (Cef)、3%蔗糖和0.65%瓊脂的MS培養基上生根。
采用CTAB法提取基因組DNA,對具有卡那霉素抗性的煙草植株進行PCR檢測。PCR反應所用上下游引物分別為P7、P8 (表1)。為了檢測AtDHyPRP1基因在煙草基因組中的拷貝數,用SacⅠ對20 μg基因組DNA進行單酶切,用PCR擴增產生的AtDHyPRP1基因ORF中間的一段550 bp的序列制備探針,按Roche公司的DIG High Prime DNA Labeling and Detection Starter Kit Ⅱ試劑盒使用手冊進行Southern印跡分析。同時用Trizol試劑 (Invitrogen) 提取總RNA,通過RT-PCR和Northern印跡技術進行表達分析。在RT-PCR試驗中,用RT-Master Mix反轉錄試劑盒 (TaKaRa) 合成cDNA,PCR反應所用上下游引物分別為 P7、P8 (表 1),擴增產物大小550 bp。在Northern印跡實驗中,采用甲醛變性膠對提取的RNA進行分離,雜交和檢測方法參照DIG High Prime DNA Labeling and Detection Starter Kit Ⅱ (Roche) 說明書進行。
1.2.5 蒜薹灰霉菌侵染分析
蒜薹灰霉菌Botrytis cinerea Pers.ex of Garlic Sprout由本實驗室保存。菌株在馬鈴薯培養基上于28 ℃培養4 d后,用無菌水懸浮孢子,經玻璃棉過濾除去菌絲后用 1/4馬鈴薯培養基稀釋成5×104個孢子/mL的懸浮液。將10 μL孢子懸浮液接種于野生型秦煙95和AtDHyPRP1轉基因煙草葉片表面,然后置于22 ℃、16 h光照、90%濕度條件下,每隔5 d觀察葉片的顏色變化情況和灰霉菌的侵染程度。侵染實驗重復3次,每次接種3片葉子。
為了檢測侵染部位H2O2的積累水平,將侵染5 d后的葉片用0.5% DAB (3,3-二氨基聯苯胺) 在37 ℃染色過夜,經乙醇脫色后用80%甘油封片,在顯微鏡下觀察侵染情況。同時,在接種5 d后用0.4%臺酚藍于37 ℃染色1 h,在85%乙醇中煮10 min脫去葉綠素,用80%甘油封片,在顯微鏡下觀察細胞的存活狀態。
2 結果與分析
2.1 AtDHyPRP1蛋白的結構特征
AtDHyPRP1基因 (GenBank Accession No. NM_118373) 開放閱讀框全長為 1 128個堿基對,無內含子,編碼的蛋白質由375個氨基酸構成 (圖1)。AtDHyPRP蛋白的氨基酸序列包括4個部分,從氨基末端開始依次為信號肽 (1-23)、富含脯氨酸結構域 PRD (Proline-rich domain) (24-173)、8CM (Eight Cysteine Motif) (174-254)、PRD (255-294) 和8CM (295-375)。2個8CM只有 2個氨基酸不同,分別為 I209/V330和P228/R349。
2.2 AtDHyPRP1基因的分離和載體構建
以擬南芥Ws野生型植株基因組DNA為模板,通過PCR擴增AtDHyPRP1基因的ORF序列,1%瓊脂糖凝膠電泳結果顯示有兩條帶,一條符合預期大小 (1 128 bp),一條位于750~1 000 bp之間。出現這種結果的原因是AtDHyPRP1蛋白有2個8CM,PCR反應所用的下游引物可以與這2個8CM編碼序列的3'端配對。將大片段回收后連接至pMD18-T載體,測序結果表明有2個堿基與數據庫中下載的來自 Col-0的AtDHyPRP1基因序列不同,分別為 765位的T變成了A,811位的A變成了C。Ws生態型中的第1個堿基變化沒有引起氨基酸改變,但第2個堿基變化使第271位的K變為Q。

圖1 AtDHyPRP1蛋白 (NP_193978.2) 的氨基酸序列Fig. 1 The deduced amino acid sequence of AtDHyPRP1. The signal peptide is underlined. Two 8CM are framed, the conservative cysteine residues are shadowed, the different amino acid residues between two 8CM are shown in bold.
用VspⅠ和SacⅠ對pMD18-T-AtDHyPRP1進行雙酶切,得到 AtDHyPRP1編碼序列。用NdeⅠ和 SacⅠ對植物雙元表達載體 pRI101-AN進行雙酶切,得到線性化質粒 DN A。將AtDHyPRP1編碼序列與pRI101-AN質粒DNA連接,構建產生 pRI101-AN-AtDHyPRP1。將pRI101-AN-AtDHyPRP1送上海生工生物技術公司測序,結果沒有變化,表明載體構建成功。
以測序正確的 pMD18-T-AtDHyPRP1為模板,采用高保真 PFU DNA聚合酶擴增AtDHyPRP1編碼序列,上下游引物 5¢端分別包含NcoⅠ和SpeⅠ酶切位點。用NcoⅠ和SpeⅠ對擴增產物和植物雙元表達載體pCAMBIA1302進行雙酶切,用T4 DNA連接酶將AtDHyPRP1編碼序列連接到pCAMBIA1302中的gfp基因之前,產生pCAMBIA1302-AtDHyPRP1-GFP融合表達載體。將pCAMBIA1302-AtDHyPRP1-GFP送上海生工生物技術公司測序,結果顯示序列正確,讀碼框沒有變化。
2.3 轉基因擬南芥的分子鑒定和AtDHyPRP1蛋白的亞細胞定位
用包含pCAMBIA1302-AtDHyPRP1-GFP的農桿菌LBA4404通過真空滲透方法轉化擬南芥Ws野生型植株,在附加25 mg/L潮霉素的MS培養基上對收獲的種子進行篩選。未轉化的種子苗在潮霉素抗性培養基上不能正常生長,逐漸黃化死去,而轉基因植株能夠正常生長。用激光共聚焦顯微鏡觀察 PCR檢測陽性的轉基因擬南芥植株的根,結果顯示AtDHyPRP1定位于細胞表面,表明AtDHyPRP1蛋白主要分布在細胞膜或細胞壁上 (圖2A)。而pCAMBIA1302空載體轉化的擬南芥根細胞中 GFP分布在整個細胞內(圖2B)。
2.4 轉AtDHyPRP1基因煙草的分子鑒定和表達分析
通過凍融法將重組質粒 pRI101-ANAtDHyPRP1轉入農桿菌 LBA4404,采用菌落PCR進行鑒定。用含有pRI101-AN-AtDHyPRP1的農桿菌LBA4404對秦煙95進行遺傳轉化,經卡那霉素篩選和PCR檢測獲得6個轉基因植株。圖3為TT1和TT2兩個轉基因煙草株系的PCR檢測結果。
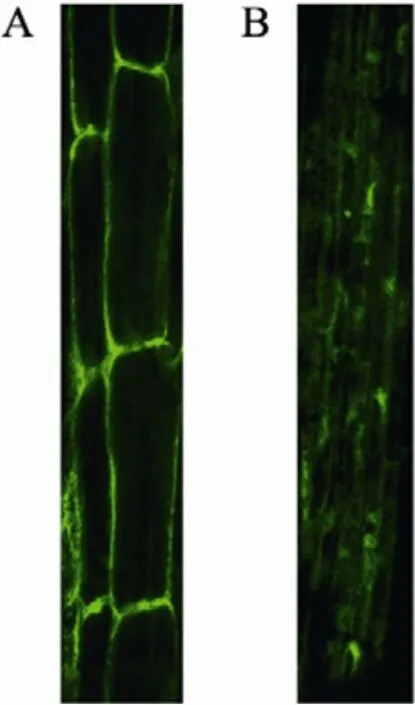
圖2 轉基因擬南芥根細胞中GFP熒光的觀察Fig. 2 Fluorescence detection of GFP in root cells of transgenic Arabidopsis. (A) GFP fluorescence in root cells of pCAMBIA1302-AtDHyPRP1-GFP transformed Arabidopsis plant. (B) GFP fluorescence in root cells of pCAMBIA1302 transformed plant.
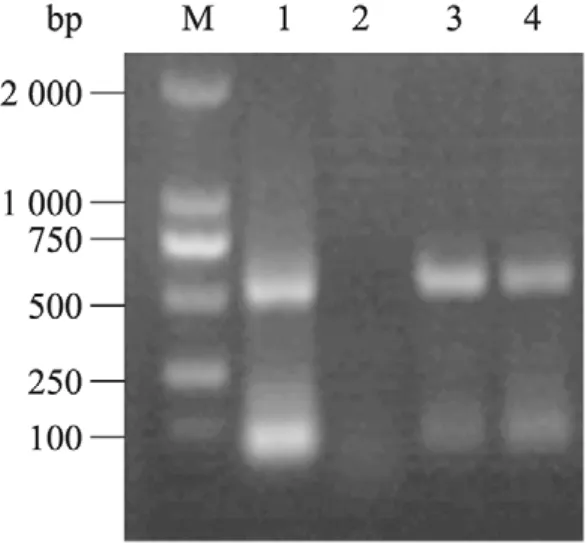
圖3 轉AtDHyPRP1基因煙草的PCR檢測Fig. 3 PCR analysis of the transgenic tobacco plants harboring AtDHyPRP1. M: DL2000 DNA marker; 1: pRI101-AN-AtDHyPRP1; 2: wild type tobacco plant; 3–4: transgenic tobacco plants with kanamycin resistance (TT1 and TT2, respectively).
從PCR鑒定為陽性的轉AtDHyPRP1基因煙草提取基因組 DNA,經限制性酶切后進行Southern印跡分析,結果顯示TT1整合有一個拷貝的AtDHyPRP1基因 (圖4-3),TT2整合有兩個拷貝的AtDHyPRP1基因 (圖4-4)。對這2個轉基因植株進行RT-PCR (圖5) 和Northern印跡(圖6) 分析,結果表明AtDHyPRP1基因能夠有效表達。
2.5 轉AtDHyPRP1基因煙草對蒜薹灰霉菌的抗性分析

圖4 T0代轉AtDHyPRP1基因煙草的Southern印跡分析Fig. 4 Southern blotting analysis of T0 tobacco plants harboring AtDHyPRP1. 1: pRI101-AN-AtDHyPRP1 digested with Sac I and Xba I; 2: genomic DNA of wild type tobacco plant digested with Sac I; 3–4: genomic DNA of transgenic tobacco plants harboring AtDHyPRP1 digested with Sac I (TT1 and TT2, respectively).
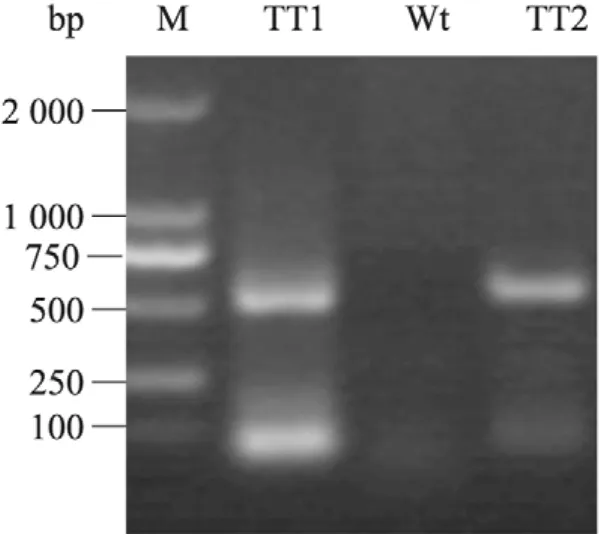
圖5 轉AtDHyPRP1基因煙草的RT-PCR檢測Fig. 5 RT-PCR analysis of the transgenic tobacco plants harboring AtDHyPRP1. M: DL2000 DNA marker; TT1: transgenic tobacco line TT1; Wt: wild type tobacco plant; TT2: transgenic tobacco line TT2.

圖6 轉AtDHyPRP1基因煙草的Northern blotting分析Fig. 6 Northern blotting analysis of the transgenic tobacco plants harboring AtDHyPRP1. Wt: wild type tobacco plant; TT1,TT2: transgenic tobacco plant TT1 and TT2, respectively.
在3次重復實驗中,共接種9個TT1葉片,9個TT2葉片,9個野生型葉片。蒜薹灰霉菌侵染5 d后,轉AtDHyPRP1基因煙草仍然保持綠色,而野生型葉片四周已經開始褪綠。侵染8 d后,野生型煙草葉片上的病斑逐漸擴大,超過50%的葉片表面顏色變黃;而TT1有7個葉片仍為綠色,2個葉片在葉邊緣出現變黃現象;TT2有6個葉片仍為綠色,3個葉片在葉邊緣出現變黃現象。說明野生型煙草相對于轉 AtDHyPRP1煙草在受到灰霉菌侵染時葉片褪綠的時間要早。侵染 12 d后,野生型煙草葉片變黃面積超過90%,其中3個葉片已經腐爛;TT1只有1個葉片基本上保持綠色,8個葉片的邊緣已經褪綠,其中2個葉片的變黃部分已由邊緣向中間擴散,其余6片只是在葉邊緣出現變黃現象,葉片變黃面積約為20%;TT2有3個葉片的變黃部位已由邊緣向中間擴散,6個葉片只是在葉邊緣出現變黃現象,葉片變黃面積約為30%,并且在大部分侵染位點能看到有黃色的斑點,但斑點與健康組織之間存在明顯的界限,無葉片腐爛現象出現。侵染20 d后,9個TT1葉片都已褪綠,有1片葉邊緣出現黃色,其余葉片進一步變黃,變黃面積達到50%;TT2葉片變黃面積達到60%;這時9個野生型煙草葉片幾乎完全枯死,3片軟化成為濕腐狀,最終遍及整片葉子,而 18個轉AtDHyPRP1基因煙草葉片都沒有腐爛,葉片中部仍然保持有綠色 (圖7)。以上結果說明與野生型煙草相比,轉AtDHyPRP1基因煙草對灰霉菌具有明顯的抗性。
具有抗性的植物在受到病原體侵染時,會發生超敏反應 (Hypersensitive response,HR)。HR指病原體入侵后的很短時間內被侵染位點產生的大量活性氧 (ROS) 能夠引起細胞死亡,將病原體的生長限制在一定的范圍內,防止其擴散并造成大面積的傷害。ROS包括H2O2、O2?和OH等。DAB可以和H2O2反應而顯示出紅褐色[13]。在蒜薹灰霉菌侵染10 d后,野生型煙草葉片經過DAB染色可以觀察到有少量的染色較淺的區域,顯示灰霉菌侵染引起了較低水平的 H2O2積累,沒有產生超敏反應,病原體可以擴散,菌絲的生長最終引起整個葉片枯萎 (圖 8A)。而轉AtDHyPRP1基因煙草葉片經DAB染色后可以觀察到較為集中的染色較深的紅褐色區域,顯示高水平H2O2積累引發了HR反應,灰霉菌不能繼續侵染周圍的細胞 (圖 8B),說明 AtDHyPRP1基因可以明顯提高煙草的抗真菌能力。臺酚藍染色結果顯示野生型煙草葉片在灰霉菌侵染之后出現大量死亡細胞 (圖 9A),而轉AtDHyPRP1基因煙草葉片細胞的壞死現象明顯減輕 (圖9B)。

圖7 轉AtDHyPRP1基因煙草對蒜薹灰霉菌的抗性分析Fig. 7 Resistance of the transgenic tobacco plants to B. cinerea Pers. ex of Garlic Sprout. (A) 5 d after inoculation with the conidia of B. cinerea. (B) 8 d after inoculation with the conidia of B. cinerea. (C) 12 d after inoculation with the conidia of B. cinerea. (D) 20 d after inoculation with the conidia of B. cinerea. TT1 and TT2: transgenic tobacco plant TT1 and TT2, respectively; Wt: wild type tobacco plant.

圖8 H2O2積累水平的DAB染色觀察Fig. 8 Observation of H2O2 accumulation by DAB staining. (A) Leaf of wild type tobacco plant. (B) Leaf of transgenic tobacco plant harboring AtDHyPRP1.
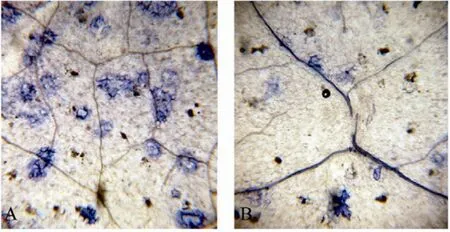
圖9 侵染煙草葉片的臺酚藍染色Fig. 9 Trypan blue staining of the tobacco leaves after infection with B. cinerea. (A) Leaf of wild type tobacco plant. (B) Leaf of transgenic tobacco plant harboring AtDHyPRP1.
3 討論
本研究從擬南芥中克隆了 AtDHyPRP1基因,生物信息學分析發現AtDHyPRP1在N端具有信號肽序列,顯示該蛋白在合成后可能被運送或分泌到植物細胞的表面來執行特殊的功能。對GENEVESTIGATOR (www.genevestigator.ethz. ch/gv/index.jsp) 數據庫中的芯片實驗結果進行分析,顯示AtDHyPRP1基因在受到丁香假單胞菌侵染誘導時表達水平最高,說明該基因與植物的抗病防御機制有關。本研究通過農桿菌轉化方法將AtDHyPRP1基因導入煙草基因組,蒜薹灰霉菌侵染結果證實組成性表達該基因對病原體確實具有明顯的抗性。
AtDHyPRP1蛋白的相對分子質量為38.79 Da,具有2個8CM結構域,2個PRD結構域,是一種新型的非特異性脂轉移蛋白。盡管對AtDHyPRP1的功能目前還沒有研究報道,但是從大規模檢測擬南芥個體經不同處理后的基因表達水平的芯片實驗數據中,可以找到一些有關該基因的信息。由于包含富脯氨酸序列,AtDHyPRP1也被認為是一種PRP/Hybrid PRP蛋白[14]或類Extensin蛋白 (Extensin-like)[15],它可能與細胞周期調控有關,在G1期存在表達峰值。用無毒丁香假單胞菌Pst DC3000 (avrRpt2) 處理gh3.5-1D激活標簽突變體后,GH3.5在侵染部位和其他組織中都會過量表達,SA積累水平和PR-1表達水平均表現增加,在這種系統性獲得抗性應答過程中AtDHyPRP1基因的表達水平會上升3.3倍[16]。用Pst hrpA、Pst COR-hrpS、Pst DC3000和大腸桿菌等病原體處理擬南芥時AtDHyPRP1基因的轉錄水平均表現上升[17]。 Mohr和Cahill的微陣列實驗結果顯示Pst無毒菌株侵染可以使AtDHyPRP1表達水平明顯提高,同時發現葉片中ABA濃度的增加能夠使擬南芥對Pst無毒菌株變得十分敏感,并伴隨著木質素和水楊酸濃度的下降,以及抗性相關基因表達的抑制[18]。以上研究報道說明AtDHyPRP1基因編碼的蛋白質主要參與擬南芥對病原體的抗性應答過程。
在與病原體的相互作用中,LTP可能參與激發子觸發植物細胞過敏性反應的信號轉導過程。激發子是一類能誘導寄主植物產生防衛反應的特殊化合物,與受體分子結合后可通過一定的信號傳導途徑激發植物產生防衛反應[19]。另外,激發子具有甾醇轉移活性,它們與甾醇形成的復合物可以和植物細胞膜上的受體蛋白互相作用,引起植物細胞的超敏反應,從而激活抗病防衛反應的信號轉導途徑,誘導植物抗性。發生HR反應后,侵染位點會有H2O2等活性氧 (ROS) 分子的積累。由于 LTP和激發子在空間結構上有相似性,所以LTP可以競爭性結合激發子的膜受體,抑制細胞死亡并誘導系統抗性的產生[20]。本研究用蒜薹灰霉菌孢子對轉AtDHyPRP1基因煙草和野生型煙草葉片進行離體侵染,從DAB染色結果可以明顯地看出野生型煙草葉片表面的被侵染位點著色較淺,病原體可以擴散。而轉AtDHyPRP1基因煙草葉片上的侵染位點著色很深,說明發生了HR反應并有大量的H2O2積累,從而限制了菌體的擴散。臺酚蘭染色結果也證實灰霉菌侵染可以引起野生型葉片細胞的大量死亡,而轉AtDHyPRP1基因煙草葉片細胞的壞死數量明顯減少。
蛋白質是生物功能的具體執行者,蛋白質的功能與其在細胞中的亞細胞定位密切相關。本研究在構建pCAMBIA1302-AtDHyPRP1-GFP植物表達載體的基礎上,通過浸花法獲得了表達AtDHyPRP1-GFP融合蛋白的擬南芥轉基因植株,激光共聚焦顯微觀察顯示AtDHyPRP1定位于細胞表面,這與生物信息學分析和灰霉菌抗性分析結果一致。
[1] Arondel V, Vergnolle C, Cantrel C, et al. Lipid transfer proteins are encoded by a small multigene family in Arabidopsis thaliana. Plant Sci, 2000, 157(1): 1?12.
[2] Suzuki H, Xia YJ, Cameron R, et al. Signals for local and systemic responses of plants to pathogen attack. J Exp Bot, 2004, 55(395): 169?179.
[3] Maldonado AM, Doerner P, Dixon RA, et al. A putative lipid transfer protein involved in systemic resistance signalling in Arabidopsis. Nature, 2002, 419(6905): 399?403.
[4] Van Loon LC, Van Strien EA. The families of pathogenesis-related proteins, their activities, and comparative analysis of PR-1 type proteins. Physiol Mol Plant Pathol, 1999, 55(2): 85?97.
[5] Nishimura S, Tatano S, Gomi K, et al. Chloroplast-localized nonspecific lipid transfer protein with anti-fungal activity from rough lemon. Physiol Mol Plant P, 2008, 72(4/6): 134?140.
[6] Molina A, García-Olmedo F. Enhanced tolerance to bacterial pathogens caused by the transgenic expression of barley lipid transfer protein LTP2. Plant J, 1997, 12(3): 669?675.
[7] Ge XC, Chen JC, Li N, et al. Resistance function of rice lipid transfer protein LTP110. J Biochem Mol Biol, 2003, 36(6): 603?607.
[8] Zottich U, Da Cunha M, Carvalho AO, et al. Purification, biochemical characterization and antifungal activity of a new lipid transfer protein (LTP) from Coffea canephora seeds with α-amylase inhibitor properties. Biochim Biophys Acta, 2011, 1810(4): 375?383.
[9] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001.
[10] Bechtold N, Ellis J, Pelletier G. In planta Agrobacterium-mediated gene transfer by infiltration of adult Arabidopsis thaliana plants. C R Acad Sci, 1993, 316: 1194?1199.
[11] Clough SJ, Bent AF. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J, 1998, 16(6): 735?743.
[12] Stewart CN Jr, Via LE. A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications. Biotechniques, 1993, 14(5): 748?749.
[13] Wang CF, Huang LL, Buchenauer H, et al. Histochemical studies on the accumulation of reactive oxygen species (O2-and H2O2) in the incompatible and compatible interaction of wheat——Puccinia striiformis f. sp. tritici. Physiol Mol Plant Pathol, 2007, 71(4/6): 230?239.
[14] Schultz CJ, Rumsewicz MP, Johnson KL, et al. Using genomic resources to guide research directions. The Arabinogalactan protein gene family as a test case. Plant Physiol, 2002, 129(4): 1448?1463.
[15] Menges M, Hennig L, Gruissem W, et al. Cell cycle-regulated gene expression in Arabidopsis. J Biol Chem, 2002, 277(44): 41987?42002.
[16] Zhang ZQ, Li Q, Li ZM, et al. Dual regulation role of GH3.5 in salicylic acid and auxin signaling during Arabidopsis-Pseudomonas syringae interaction. Plant Physiol, 2007, 145(2): 450?464.
[17] Thilmony R, Underwood W, He SY. Genome-wide transcriptional analysis of the Arabidopsis thaliana interaction with the plant pathogen Pseudomonas syringae pv. tomato DC3000 and the human pathogen Escherichia coli O157:H7. Plant J, 2006, 46(1): 34?53.
[18] Mohr PG, Cahill DM. Suppression by ABA of salicylic acid and lignin accumulation and the expression of multiple genes, in Arabidopsis infected with Pseudomonas syringae pv. tomato. Funct Integr Genomics, 2007, 7(3): 181?191.
[19] Liu MF, Zhu XC, Xiao HS. Research progress of elicitor and it’s signal transduction in plants. Chin Agric Sci Bull, 2008, 24(3): 215?220.劉梅芳, 朱曉程, 肖華山. 植物激發子及其信號傳導之研究進展, 中國農學通報, 2008, 24(3): 215?220.
[20] Blein JP, Coutos-Thévenot P, Marion D, et al. From elicitins to lipid-transfer proteins: a new insight in cell signalling involved in plant defence mechanisms. Trends Plant Sci, 2002, 7(7): 293?296.