氧化葡萄糖酸桿菌生物催化1,3-丙二醇合成3-羥基丙酸
孫麗慧,于飛飛,鄭裕國
浙江工業(yè)大學生物工程研究所,浙江 杭州 310032
3-羥基丙酸 (3-Hydroxypropionic acid,3-HP)是一種重要的有機合成中間體,由于其分子兩端分別帶有一個羥基和一個羧基,是較為活潑的分子,在合成新型生物可降解性聚合物、個人護理用品、膠黏劑和涂料等方面有著廣泛的應用前景[1]。目前,3-HP的生產(chǎn)方法主要是化學合成法,但該方法存在技術難度較大、生產(chǎn)成本高、環(huán)境污染嚴重等缺點[1-2]。隨著生物技術的迅猛發(fā)展,近年來很多學者研究了利用微生物發(fā)酵法生產(chǎn)3-HP,但目前所報道的采用發(fā)酵法生產(chǎn)3-HP的野生菌株,產(chǎn)量均較低,只能通過基因工程手段構建高效代謝途徑,但需要較多基因的克隆,工程菌的構建具有一定的難度[3-5]。陳國強等將1,3-丙二醇脫氫酶和醛基氧化酶在宿主細胞中共表達,以1,3-丙二醇為原料發(fā)酵生產(chǎn)3-HP,最終發(fā)酵液中產(chǎn)物濃度最高為 12.1 g/L[6];Rathnasingh等將甘油脫水酶與醛脫氫酶偶聯(lián)表達,以甘油為底物,最終在發(fā)酵液中3-HP產(chǎn)量能夠達到38.7 g/L,這也是目前文獻報道中利用發(fā)酵法能夠取得最好的結果[7]。
本研究室前期成功篩選并經(jīng)誘變得到了一株氧化葡萄糖酸桿菌 ZJB09112 (Gluconobacter oxydans ZJB09112)[8-10],該菌最顯著的特點就是在其細胞膜上存在著多種脫氫酶,能夠將眾多糖醇類化合物不完全氧化,生成相應的產(chǎn)物醛、酮以及酸,這一過程的電子傳遞鏈由泛醌、細胞色素O和細胞色素O還原性酶組成,氧作為電子受體,并且該電子傳遞鏈與ADP氧化磷酸化形成ATP的過程相耦合[11-14]。由于膜系脫氫酶的氧化產(chǎn)物可以直接分泌到細胞外,催化過程無需跨膜運輸,且氧化效率很高,因而近年來對G. oxydans在生物催化應用方面的研究,受到了極大關注。在前期實驗中,本課題組已經(jīng)利用該菌對以甘油為底物合成1,3-二羥基丙酮做了大量的研究工作,并將所取得成果成功地實現(xiàn)了產(chǎn)業(yè)化,現(xiàn)已在浙江海正藥業(yè)股份有限公司構建了年產(chǎn)1 000 t的1,3-二羥基丙酮生產(chǎn)線,生產(chǎn)技術指標達到國際領先水平[12]。目前國內外已經(jīng)有利用G. oxydans生物催化合成維生素C、米格列醇、葡萄糖酸、D-乳酸、1,3-二羥基丙酮、羥基乙酸等相關研究[11,15-21]。本文以G. oxydans ZJB09112靜息細胞作為生物催化劑,利用其不完全氧化特性,催化1,3-丙二醇合成3-HP,反應過程如圖1所示,考察了細胞加入量、底物抑制和產(chǎn)物抑制對催化反應的影響,并采取適當?shù)难a料方式和生物轉化與分離相耦合的手段解除抑制,以提高目標產(chǎn)物終濃度。同時,本研究也能為加深了解G. oxydans不完全氧化醇類化合物的特性奠定一定的理論基礎,有助于發(fā)現(xiàn)和開拓它在工業(yè)催化中的新用途。

圖1 氧化葡萄糖酸桿菌生物催化1,3-丙二醇合成3-羥基丙酸Fig. 1 Biocatalysis of 1,3-propanediol to 3-hydroxypropionic acid by Gluconobacter oxydans.
1 材料與方法
1.1 菌種和試劑
氧化葡萄糖酸桿菌 ZJB09112 (G. oxydans ZJB09112),為本實驗篩選保藏,于中國典型培養(yǎng)物保藏中心保藏,公共保藏編號為 CCTCC No: M208069。1,3-丙二醇購自Sigma-Aldrich公司;3-HP購自日本東京化成株式會社;樹脂購于上海華振有限公司;其他化學試劑均為分析純。
1.2 培養(yǎng)基
種子培養(yǎng)基 (g/L):酵母粉30,甘油5。
發(fā)酵培養(yǎng)基 (g/L):甘油24,甘露醇6,酵母粉 7,蛋白胨 1,MgCl21,(NH4)2SO41,KH2PO41。
1.3 菌體培養(yǎng)方法
從菌種斜面接種兩環(huán)至裝有 50 mL種子培養(yǎng)基的500 mL搖瓶中,于30 ℃、150 r/min振蕩培養(yǎng)24 h作為種子。將種子液以10%接種量接入發(fā)酵培養(yǎng)基中,于30 ℃、150 r/min發(fā)酵培養(yǎng)22 h,離心收集菌體并用生理鹽水洗滌2次用于生物轉化。
1.4 樹脂的選擇和預處理
由于 3-HP為弱酸性有機酸 (pKa=4.5),根據(jù)離子交換理論,應選用堿性樹脂作為原位分離介質。以往研究表明,弱堿性陰離子交換樹脂對羥基酸的吸附容量遠遠超過強堿性陰離子交換樹脂。所以,本實驗代表性地選取了工業(yè)上應用廣泛的幾種弱堿性陰離子交換樹脂,D301 (苯乙烯系)、D314 (丙烯酸系)、D315 (丙烯酸系) 和D335 (環(huán)氧系),比較了其對3-HP的吸附性能,并對洗脫劑進行了選擇。
樹脂預處理:首先將樹脂用乙醇浸泡4 h,使其充分溶脹并除去有機雜質;然后用1 mol/L NaOH浸泡24 h,水洗至中性;再用1 mol/L HCl浸泡24 h,水洗至中性;最后用1 mol/L NaOH浸泡24 h,實現(xiàn)樹脂轉型,水洗至中性,抽濾后保藏備用。
1.5 生物轉化反應
50 mL搖瓶中轉化:取適量濕菌體,懸浮于緩沖溶液中,加入適量1,3-丙二醇,總反應體系為10 mL。在30 ℃、180 r/min下進行生物轉化,反應初速度通過轉化前10 min的產(chǎn)物量計算,所有實驗均重復3次。
2 L鼓泡塔中轉化:初始反應體系為1 L,在控制合適的通氣量和pH條件下,定時取樣分析底物濃度,通過流加補料的方式和產(chǎn)物原位分離手段解除抑制。
1.6 分析方法
1,3-丙二醇濃度用氣相色譜 (GC-14B,日本島津公司) 檢測,色譜柱為HP-5,升溫程序為:80 ℃保持2 min,然后以5 ℃/min升溫至110 ℃,保持1 min,汽化室與檢測器溫度均為260 ℃,載氣為N2,流速1 mL/min,進樣量1 mL,采用外標法定量;3-HP采用高效液相色譜(1100 series,美國安捷倫公司) 檢測,色譜柱為Hypersil ODS2,色譜分析條件:流動相為20 mmol/L KH2PO4緩沖液 (用磷酸調pH為2.4),流速0.8 mL/min,紫外檢測波長210 nm,柱溫35 ℃;進樣量20 μL,采用外標法定量。
2 結果與分析
2.1 生物催化1,3-丙二醇合成3-HP
2.1.1 靜息細胞濃度對轉化反應的影響
在一定程度上,靜息細胞的添加量代表著反應體系中的酶濃度,因此提高反應體系中細胞濃度,有助于加快酶催化反應速度。在30 ℃、100 mmol/L檸檬酸鹽緩沖液pH 5.5條件下,添加1,3-丙二醇濃度20 g/L,考察細胞濃度對轉化反應的影響。從圖2結果可知,隨著細胞濃度的增加,酶催化反應初速度逐漸增加,當細胞濃度達到6 g/L以后,產(chǎn)物得率和反應初速度均達到了較高水平,繼續(xù)增加細胞濃度,成本會大大增加,然而對酶催化的轉化率和反應初速度卻不再有明顯增加,一方面,這可能是由于該氧化反應需要較多的氧氣參與,而轉化瓶中的溶氧有限,從而限制了酶的催化活性,另一方面,反應體系中添加過多的細胞會隨著搖床轉動,細胞粘附在瓶壁上而未能發(fā)揮催化作用。因而綜合考慮,選擇該轉化反應最適細胞濃度為6 g/L。
2.1.2 底物濃度對轉化反應的影響
在 30 ℃、100 mmol/L檸檬酸鹽緩沖液(pH 5.5) 條件下,細胞濃度6 g/L,考察不同初始底物濃度對轉化反應的影響。從圖3結果可知,在底物濃度低于15 g/L時,隨著底物1,3-丙二醇濃度的增加,酶催化反應初速度及3-HP的終產(chǎn)量均在逐漸增加,而當?shù)孜餄舛瘸^20 g/L時,隨著底物濃度的增加,底物抑制作用開始顯現(xiàn),酶催化反應初速度及轉化率明顯下降且3-HP產(chǎn)量也不再增加。因此,需控制底物量不超過20 g/L。
2.1.3 產(chǎn)物濃度對轉化反應的影響
在30 ℃、100 mmol/L檸檬酸鹽緩沖液pH 5.5條件下,細胞濃度6 g/L,底物濃度20 g/L,考察在轉化初始添加不同濃度產(chǎn)物對轉化反應的影響。從圖4結果可知,產(chǎn)物3-HP對細胞催化活力具有一定的抑制作用,并隨著產(chǎn)物添加濃度的增大,抑制作用越來越明顯。當初始產(chǎn)物添加量為40 g/L時,酶催化效率僅為對照組的40%,而當產(chǎn)物量達到60 g/L時,催化效率僅為對照組的1%,反應幾乎接近終止。因此,反應過程中及時移除產(chǎn)物,減少產(chǎn)物抑制是提高產(chǎn)率的一種重要手段。
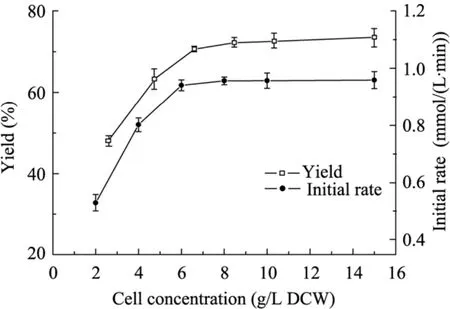
圖2 細胞濃度對轉化反應的影響Fig. 2 Effect of cell concentration on biotransformation reaction.
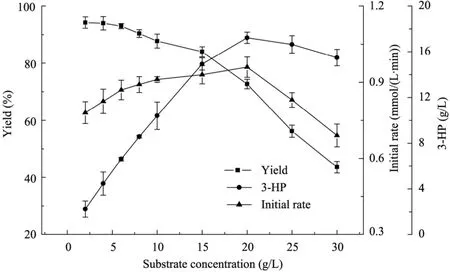
圖3 初始底物濃度對轉化反應的影響Fig. 3 Effect of initial substrate concentration on biotransformation reaction.
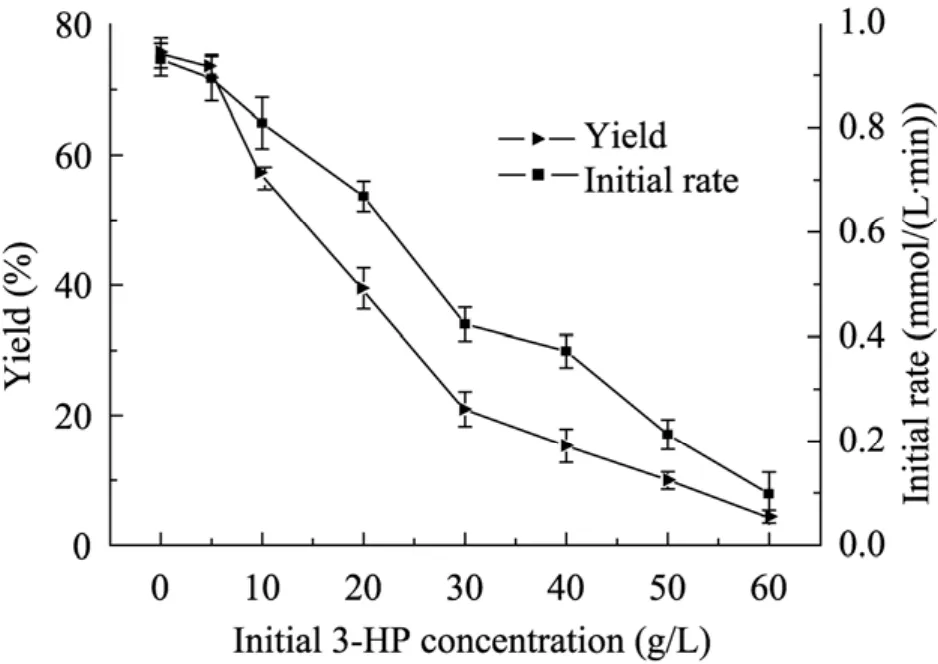
圖4 產(chǎn)物添加量對轉化反應的影響Fig. 4 Effect of different addition concentration of product on biotransformation reaction.
2.1.4 pH對轉化過程的影響
反應體系中pH值不僅影響底物分子的離子化狀態(tài),也能夠影響酶蛋白分子的離子化狀態(tài),從而影響酶催化反應的效率。在 30 ℃的條件下,選取檸檬酸鹽緩沖液 (pH 3.0~6.0)、磷酸鹽緩沖液 (pH 5.0~6.0) 和 Tris-HCl緩沖液(pH 6.0~8.0),緩沖液濃度均為100 mmol/L,在10 mL反應體系中,底物1,3-丙二醇加入濃度為20 g/L,細胞加入濃度6 g/L,反應20 min,考察不同緩沖溶液中pH值對酶催化活性的影響。從圖5結果可知,當pH值在5.5時,酶表現(xiàn)出最大的活力,且在以檸檬酸鹽緩沖液中酶活力相對最高,但考慮檸檬酸影響后期樹脂吸附能力,因此選擇轉化體系為pH 5.5的磷酸鹽緩沖液。
圖6為在30 ℃、細胞濃度6 g/L,底物濃度20 g/L,通氣量60 L/h,初始pH 5.5,1 L鼓泡塔體系中,考察pH控制與否對轉化過程的影響。從結果可知,對于該轉化反應,若不控制 pH,伴隨著產(chǎn)物 3-HP的積累,會導致反應體系 pH的逐漸下降,當反應進行到6 h,pH就已迅速降到 4.0,而酶作為生物催化劑,都存在一個最適合的pH范圍,當pH降到3.8時,目標產(chǎn)物基本不再積累,此時pH控制在5.5恒定組轉化率已高達90.1%,而對照組僅為65.5%。實驗結果表明pH維持在5.5時有利于3-HP的合成。
2.1.5 用流加補料方式轉化1,3-丙二醇合成3-HP
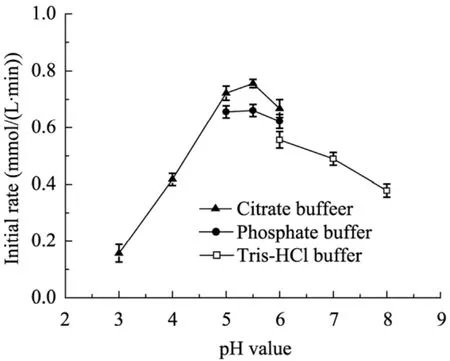
圖5 緩沖液pH值對轉化反應的影響Fig. 5 Effect of buffer pH on biotransformation reaction.
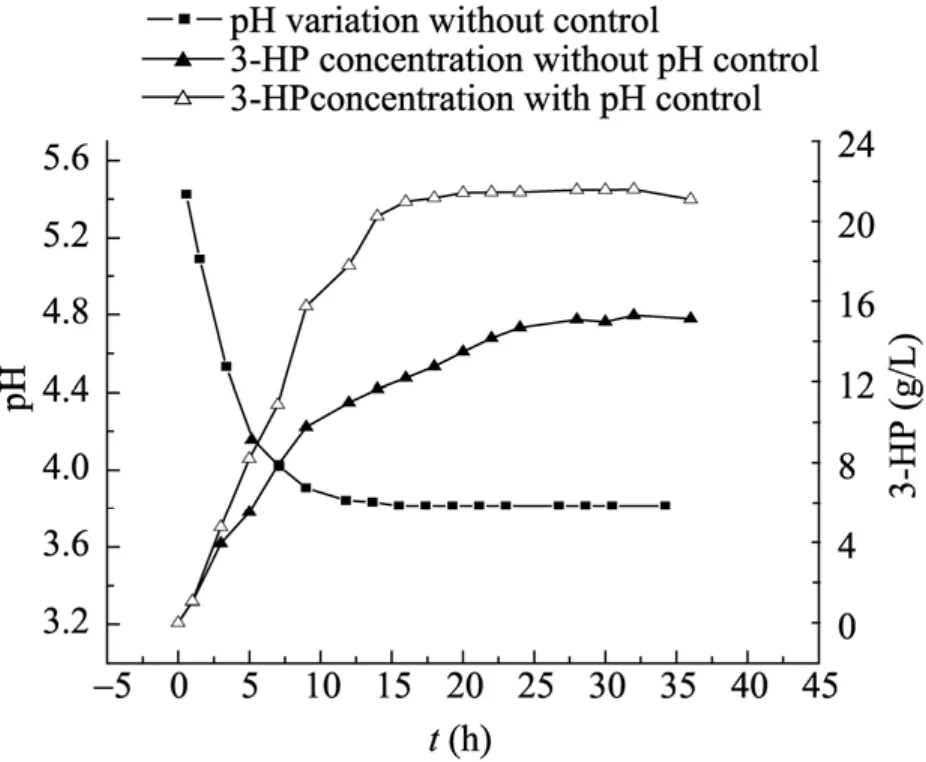
圖6 pH對轉化過程的影響Fig. 6 Effect of pH on biotransformation process.
搖瓶轉化實驗表明,當?shù)孜餄舛瘸^20 g/L就會對細胞催化活性產(chǎn)生抑制作用,為了消除底物抑制作用,在30 ℃、細胞濃度6 g/L,初始底物濃度20 g/L,通氣量60 L/h,pH 5.5條件下,1 L鼓泡塔體系中,定期取樣,采取手動間歇補加底物1,3-丙二醇的方式,控制催化過程中底物濃度維持在15~20 g/L,結果如圖7所示。在催化反應初期 (0~15 h),產(chǎn)物迅速積累,當產(chǎn)物達到40 g/L時,產(chǎn)物抑制效應逐漸顯現(xiàn),產(chǎn)物合成速率下降。由于在鼓泡塔中能夠較好地控制通氣條件和恒定的pH值,因此與搖瓶中轉化反應相比,產(chǎn)物濃度和催化效率都有明顯的提高,當產(chǎn)物濃度積累到60 g/L時,產(chǎn)物抑制效應明顯,轉化反應基本停止。經(jīng)過60 h的催化反應,3-HP的濃度達到60.8 g/L,生產(chǎn)強度為1.0 g/(L·h),轉化率為84.3%。
2.2 生物轉化與分離相耦合合成3-HP
2.2.1 樹脂的選擇
離子交換樹脂具有吸附容量大、吸附選擇性強、速度快、易解析、易再生等優(yōu)點,因而在轉化體系中引入吸附樹脂可以吸附產(chǎn)物以減輕轉化液中的產(chǎn)物抑制效應。實驗選取了幾種對有機酸有較好交換容量的弱堿性陰離子交換樹脂,配制成一定濃度的3-HP溶液,用氫氧化鈉調節(jié)pH至5.5左右,分別加入相同質量的樹脂于30 ℃、180 r/min條件下吸附120 min,從圖8可以看出,樹脂D335對3-HP吸附能力最強。
2.2.2 洗脫劑的選擇
D335是一種弱堿性環(huán)氧系陰離子交換樹脂,選擇適合的洗脫劑,有利于提高目標產(chǎn)品的收率。向1.0 g吸附飽和3-HP的D335樹脂中分別加入5 mL 1.0 mol/L的NaCl、HCl、H2SO4、NH4OH和NaOH溶液,靜態(tài)洗脫24 h,考察了幾種洗脫劑對3-HP的洗脫效果,如圖9所示。可以看出,在該條件下 Cl-和 SO42-離子在樹脂D335上的吸附力要強于OH-離子,選用NaCl、 HCl和 H2SO4作為洗脫劑,解析率都可達到80%以上,其中用HCl解析的效果最好,最終回收率可達 90%,因此選用 1.0 mol/L HCl作為3-HP的洗脫劑。
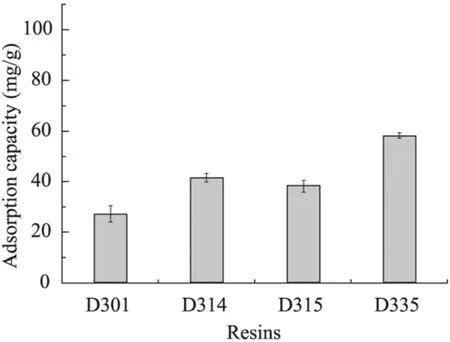
圖8 不同樹脂對3-羥基丙酸的吸附能力Fig. 8 The adsorption capacity of 3-hydroxypropionic acid by different resins.
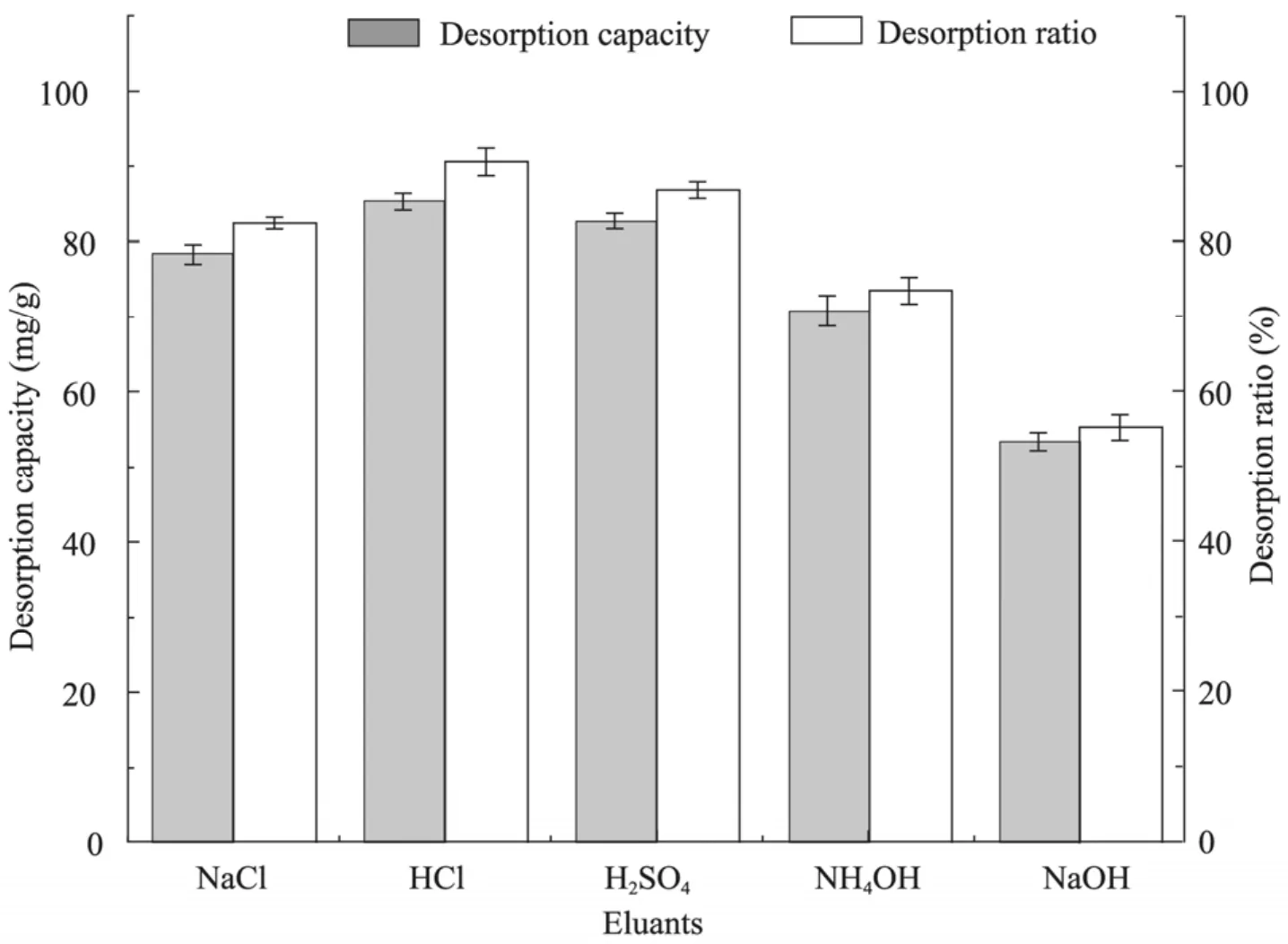
圖9 不同洗脫劑對吸附3-羥基丙酸的D335樹脂的洗脫情況Fig. 9 Elution of 3-hydroxypropionic acid adsorbed on D335 by different eluants.
2.2.3 生物轉化與分離相耦合合成3-HP
從上述結果可以看出,3-HP對該酶催化反應具有明顯的抑制作用,當產(chǎn)物濃度積累到60 g/L時,產(chǎn)物抑制效應明顯,轉化反應基本停止。為減輕產(chǎn)物抑制,獲得高濃度3-HP并提高生產(chǎn)強度,需要及時將生成的產(chǎn)物移除。因此,本實驗選用如圖10所示的生物轉化與分離相耦合技術,利用中空纖維膜實現(xiàn)細胞的循環(huán),同時利用陰離子交換樹脂D335對反應產(chǎn)生的產(chǎn)物不斷進行吸附,從而在一定程度上減少產(chǎn)物的抑制作用,提高產(chǎn)物濃度和轉化效率。
由于在反應的起始階段產(chǎn)物3-HP的產(chǎn)量較少,所以不啟動分離耦合裝置,待反應進行到12 h以后,開始進行生物轉化與分離耦合。從圖11結果可知,采用分批補料生物轉化與分離耦合合成3-HP,在不計算樹脂上吸附3-HP的量時,經(jīng)過50 h的轉化反應,3-HP的濃度可達59.8 g/L。若將 D335樹脂上吸附的 3-HP充分洗脫,并與轉化液中3-HP的量合并計算,目標產(chǎn)物總產(chǎn)量達76.3 g/L,轉化率83.7%,生產(chǎn)強度為1.5 g/(L·h)。
陳國強等以1,3-丙二醇為原料,利用工程菌發(fā)酵生產(chǎn) 3-HP,可獲得最高產(chǎn)物濃度為12.1 g/L[6];Rathnasingh等利用工程菌,以甘油為底物,可獲得最高產(chǎn)物濃度為 38.7 g/L,該結果也是目前報道中的最高產(chǎn)量[7]。本文利用G. oxydans生物轉化生產(chǎn) 3-HP,并獲得了最終目標產(chǎn)物總產(chǎn)量達 76.3 g/L,生產(chǎn)強度為1.5 g/(L·h),本研究中的產(chǎn)物濃度遠遠超過了利用工程菌發(fā)酵法獲得的最高產(chǎn)量38.7 g/L。由于在生物轉化中存在底物和產(chǎn)物抑制效應,若能對本研究中的鼓泡塔中的放大催化工藝以及生物轉化與分離相耦合的過程進一步優(yōu)化,目標產(chǎn)物濃度和生產(chǎn)強度還有提升的空間和潛力。
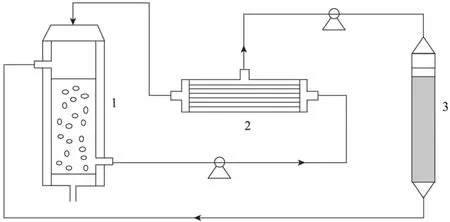
圖10 生物轉化與分離耦合裝置圖Fig. 10 Schematic diagram for bioconversion coupled with in situ product removal. 1: bubble column reactor; 2: hollow fiber membrane; 3: rein packed column.
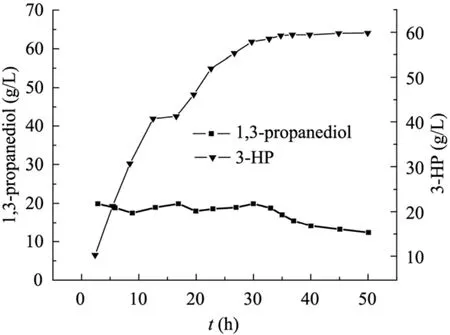
圖11 分批補料生物轉化-分離耦合轉化產(chǎn)3-HPFig. 11 Fed-batch biotransformation of 1,3-propanediol to 3-hydroxypropionic acid coupled with in situ product removal.
3 結論
利用實驗室保藏的G. oxydans ZJB09112生物催化 1,3-丙二醇合成 3-HP,在所考察的因素中,發(fā)現(xiàn)高濃度底物 (≥20 g/L) 和高濃度產(chǎn)物對細胞催化效率和產(chǎn)物合成有明顯的抑制效應,并確定了最佳搖瓶催化反應條件:6 g/L (DCW)菌體量,pH 5.5。為消除底物抑制作用,在1 L鼓泡塔中,利用流加補料方式維持反應體系中底物濃度在15~20 g/L,經(jīng)過60 h的催化反應,3-HP的濃度達到60.8 g/L,生產(chǎn)強度為1.0 g/(L·h),轉化率為 84.3%。為同時減輕底物和產(chǎn)物抑制效應,本研究采用生物轉化與D335陰離子交換樹脂原位分離相耦合的方法,及時將部分生成的產(chǎn)物移除,經(jīng)過50 h的轉化反應,3-HP的總產(chǎn)量達76.3 g/L,生產(chǎn)強度為1.5 g/(L·h),轉化率為83.7%。
[1] Jiang XL, Meng X, Xian M. Biosynthetic pathways for 3-hydroxypropionic acid production. Appl Microbiol Biotechnol, 2009, 82(6): 995?1003.
[2] Behr A, Botulinski A, Carduck F, et al. Process for preparing 3-hydroxypropionic acid: EP, 0579617. 1994-01-26.
[3] van Maris AJA, Konings WN, van Dijken JP, et al. Microbial export of lactic and 3-hydroxypropanoic acid: implications for industrial fermentation processes. Metab Eng, 2004, 6(4): 245?255.
[4] Gokarn Ravi R. 3-hydroxypropionic acid and other organic compounds: US, 20090053783. 2009-02-26.
[5] Jo JE, Raj SM, Rathnasingh C, et al. Cloning, expression, and characterization of an aldehyde dehydrogenase from Escherichia coli K-12 that utilizes 3-Hydroxypropionaldehyde as a substrate. Appl Microbiol Biotechnol, 2008, 81(1): 51?60.
[6] Chen GQ, Shi ZY, Zhang L, et al. Method for producing 3-hydroxypropionic acid: CN, 101445813A. 2009-06-03.陳國強, 石振宇, 張磊, 等. 一種生產(chǎn) 3-羥基丙酸的方法: CN, 101445813A. 2009-06-03.
[7] Rathnasingh C, Raj SM, Jo JE, et al. Development and evaluation of efficient recombinant Escherichia coli strains for the production of 3-hydroxypropionic acid from glycerol. Biotech Bioeng, 2009, 104(4): 729?739.
[8] Hu ZC, Liu ZQ, Zheng YG, et al. Production of 1,3-dihydroxyacetone from glycerol by Gluconobacter oxydans ZJB09112. J Microbiol Biotech, 2010, 20(2): 340?345.
[9] Hu ZC, Zheng YG, Shen YC. Dissolvedoxygen-stat fed-batch fermentation of 1,3-dihydroxyacetone from glycerol by Gluconobacter oxydans ZJB09112. Biotechnol Bioproc E, 2010, 15(4): 651?656.
[10] Hu ZC, Zheng YG. A high throughput screening method for 1,3-dihydroxyacetone-producing bacterium by cultivation in a 96-well microtiter plate. J Rapid Meth Aut Microbiol, 2009, 17(2): 233?241.
[11] Gao KL, Wei DZ. Asymmetric oxidation by Gluconobacter oxydans. Appl Microbiol Biotechnol, 2006, 70(2): 135?139.
[12] Sun LH, Hu ZC, Zheng YG, et al. Progress in metabolic engineering of microbial production of 1,3-dihydroxyacetone. Chin J Biotech, 2010, 26(9): 1218?1224.孫麗慧, 胡忠策, 鄭裕國, 等. 微生物法生產(chǎn)1,3-二羥基丙酮代謝工程研究進展. 生物工程學報, 2010, 26(9): 1218?1224.
[13] Deppenmeier U, Hoffmeister M, Prust C. Biochemistry and biotechnological applications of Gluconobacter strains. Appl Microbiol Biotechnol, 2002, 60(3): 233?242.
[14] Li MH, Wu J, Lin JP, et al. Expression of Vitreoscilla hemoglobin enhances cell growth and dihydroxyacetone production in Gluconobacter oxydans. Curr Microbiol, 2010, 61(5): 370?375.
[15] Herrmann U, Merfort M, Jeude M, et al. Biotransformation of glucose to 5-keto-d-gluconic acid by recombinant Gluconobacter oxydans DSM 2343. Appl Microbiol Biotechnol, 2004, 64(1): 86?90.
[16] Claret C, Salmon JM, Romieu C, et al. Physiology of Gluconobacter oxydans during dihydroxyacetone production from glycerol. Appl Microbiol Biotechnol, 1994, 41(3): 359?365.
[17] Wei GD, Yang XP, Zhou WY, et al. Adsorptive bioconversion of ethylene glycol to glycolic acid by Gluconobacter oxydans DSM 2003. Biochem Eng J, 2009, 47(1/3): 127?131.
[18] Gao KL, Zhang SL, Wei DZ. Enhancement of Gluconobacter oxydans catalyzing D-lactic acid production by coupling of synthesis and separation. J Chem Technol Biotechnol, 2009, 84(11): 1742?1746.
[19] Wei GD, Wei DZ, Lin JP. Enantioselective oxidation of 2-methyl-1,3-propanediol tob-hydroxyisobutyric acid using whole cells of Gluconobacter oxydans DSM 2003. Food Fermen Ind, 2010, 36(8): 12?16.魏國棟, 魏東芝, 林金萍. 氧化葡萄糖酸桿菌立體選擇催化 2-甲基-1,3-丙二醇合成(R)-b-羥基異丁酸. 食品與發(fā)酵工業(yè), 2010, 36(8): 12?16.
[20] Wei LJ, Yang XP, Gao KL, et al. Characterization of enzymes in the oxidation of 1,2-propanediol to D-(-)-lactic acid by Gluconobacter oxydans DSM 2003. Mol Biotechnol, 2010, 46(1): 26?33.
[21] de Muynck C, Pereira C, Soetaert W, et al. Dehydrogenation of ribitol with Gluconobacter oxydans: production and stability of L-ribulose. J Biotechnol, 2006, 125(3): 408?415.

