LuxS基因缺失對變異鏈球菌生物學性狀的影響
張耀超
(西安醫(yī)學院口腔醫(yī)學系,陜西西安710021)
變異鏈球菌(Streptococcus mutans,Sm,以下簡稱變鏈菌)是G+性微需氧菌,可使碳水化合物分解產酸而導致牙齒無機質脫礦,并與牙菌斑生物被膜的形成密切相關。因此,變鏈菌在人類口腔微生物環(huán)境中占有重要的生態(tài)地位,是最重要的致齲菌[1]。在自然條件下,絕大多數微生物粘附在一個表面上,以生物被膜(biofilm)的形式生存。牙菌斑就是一種典型的生物被膜,是齲病和牙周病發(fā)生的始動因子。生物被膜中的種群基因表達的調節(jié)與浮游細菌不同,細菌必須協調大量基因的表達以形成穩(wěn)定的生物被膜[2]。LuxS基因在G-和G+細菌中都高度保守,由約450~550個堿基對組成。變鏈菌基因圖譜中LuxS基因編碼160個氨基酸的LuxS蛋白,LuxS蛋白是一種合成酶,能合成LuxS系統的信號分子即AI-2信號分子[3]。LuxS編碼的AI-2信號參與牙菌斑內細菌間的信息交流,并利用群體感應系統調控特定的生理功能[4]。本研究在前期成功構建變鏈菌LuxS基因缺失突變株的基礎上,進一步觀察LuxS基因缺失對變異鏈球菌生長特點和生物被膜形成能力的影響。
1 材料和方法
1.1 主要材料和設備
變異鏈球菌UA159標準株(四川大學華西口腔醫(yī)學中心);變鏈菌LuxS基因突變株(本實驗室成功構建并保存);TSA固體培養(yǎng)基、TSA-Cmr固體培養(yǎng)基(含10 μg/mL氯霉素)、BHI液體培養(yǎng)基(北京陸橋生物制品公司);BHI固體培養(yǎng)基(含有25 μg/mL氯霉素的BHI瓊脂用以選擇性培養(yǎng)突變株);氯霉素粉劑(中國藥品生物制品檢定所標準產品);結晶紫溶液(天津金章科技發(fā)展有限公司);光學顯微鏡(Olympus,日本);R200電子天平(德國);標準24孔微量板(Costar 3524,Corning Inc.);直徑為12 mm圓形蓋玻片(江蘇鹽城恒泰玻璃儀器廠);微量加樣器 (Eppendorf公司,德國);紫外分光光度計(BECKMAN,美國)。
1.2 變鏈菌標準株和LuxS突變株生長特性觀察
1.2.1 兩菌株在不同培養(yǎng)基中生長情況和鑒定
取-70℃凍存的變鏈菌 UA159標準株和LuxS突變株,常規(guī)復蘇后分別接種于TSA固體培養(yǎng)基和 TSA-Cmr固體培養(yǎng)基中,37℃厭氧(800 mL/L N2、100 mL/L H2、100 mL/L CO2)條件下培養(yǎng)48 h后,觀察兩菌株在兩種培養(yǎng)基中的菌落生長情況。同時挑取單個菌落分別進行常規(guī)生化鑒定和革蘭染色涂片鑒定。
1.2.2 兩菌株生長曲線觀察
將常規(guī)復蘇24 h的變鏈菌UA159標準株和LuxS突變株分別接種于BHI瓊脂培養(yǎng)基,37℃厭氧(800 mL/L N2,100 mL/L H2,100 mL/L CO2)條件下培養(yǎng)48 h,分別挑取兩菌株單菌落轉種于BHI液體培養(yǎng)基增菌,37℃厭氧條件下培養(yǎng)過夜。涂片檢查為純培養(yǎng)后充分混勻,于紫外分光光度計600 nm處制備成吸光度A=1.0的菌懸液備用。將上述菌懸液1 000倍稀釋接種于BHI液體培養(yǎng)基,置37℃恒溫搖床中孵育,定時取樣測量A值,每次每個菌種測3份取均值,以不接種細菌的BHI液體培養(yǎng)基作陰性對照組。實驗重復3次。
1.3 變鏈菌UA159標準株和LuxS突變株生物被膜形成能力的觀察
根據Loo等[5]的方法并加以修改,建立變鏈菌LuxS基因突變株和標準株生物被膜,并染色觀察。先在標準24孔微量板中放入直徑12 mm的蓋玻片,再將復蘇24 h的兩菌株的菌懸液調節(jié)濃度至A600=0.1后,各取500 μL滴至蓋玻片表面,同時向孔中加入1 mL BHI液體培養(yǎng)基,另在空白蓋玻片滴加等量BHI培養(yǎng)液作為陰性對照組。上述每組復3孔,分別于37℃厭氧條件(800 mL/L N2,100 mL/L H2,100 mL/L CO2)條件下培養(yǎng)48 h后,取出24孔板,微量吸液器吸棄孔內菌懸液,用PBS緩沖液輕輕沖洗以去除表面未粘附的細菌,室溫下自然干燥20 min,肉眼觀察玻片上生物膜形成情況。然后每孔加入10 g/L結晶紫溶液200 μL,室溫下放置20 min后吸棄染色液,用PBS緩沖液輕輕沖洗掉玻片表面的染色液和浮游菌,自然干燥30 min,光學顯微鏡下分別觀察標準株和突變株生物被膜形成情況。
1.4 統計學分析
應用SPSS 13.0統計軟件進行統計分析,兩組間計量資料(±s)比較用t檢驗,檢驗水準α=0.05。
2 結果
2.1 變鏈菌UA159標準株與LuxS突變株生長特性比較
2.1.1兩菌株在不同培養(yǎng)基中的生長情況和鑒定結果
在含10 μg/mL氯霉素的TSA-Cmr固體培養(yǎng)基中,標準株基本不能生長,而突變株的生長狀況基本正常。在TSA固體培養(yǎng)基中,兩菌株均生長正常,且在菌落形態(tài)學上沒有明顯的表型差別,菌落均為乳白色、呈細小而光滑的隆起狀,且邊緣整齊。經常規(guī)生化鑒定,兩菌株均為血清C型(表1)。
涂片、革蘭染色后光學顯微鏡下觀察,兩菌株均為革蘭染色陽性,但形態(tài)上存在一定的差異:標準株菌體呈長鏈狀排列而且相互纏繞,局部甚至呈小的團塊狀,為典型的變鏈菌形態(tài)(圖1);而LuxS突變株菌體多數呈短鏈狀排列,形成長鏈的較少,甚至可以見到不少游離的單個菌體(圖2)。
2.1.2兩菌株生長曲線的比較
以A值為縱座標,時間為橫座標繪制兩菌株生長曲線可見,兩種菌株在生長模式上基本一致,均呈典型的“S”曲線,只是在進入生長穩(wěn)定期(11.5~22.5 h)后,兩者在細菌飽和度上有一定的差異,即:11.5 h之前各時間點兩菌株的A值均無統計學差異(P>0.05);而自11.5 h起至22.5 h內各時間點,LuxS突變株的A值均低于標準株,且差異具有統計學意義(P<0.05)(表2,圖3)。
2.2 變鏈菌UA159標準株與LuxS突變株生物被膜形成能力的比較
培養(yǎng)48 h后肉眼觀察,標準株和突變株均能在玻片上形成生物被膜,而陰性對照組未見生物被膜形成。其中標準株的生物膜光滑而完整,且分布均勻,呈乳白色;突變株的生物被膜形態(tài)則較標準株粗糙、薄且分布不均勻、大部分形成較大的團塊(圖4)。當PBS輕輕沖洗蓋玻片時,標準株生物被膜與玻片表面結合的較牢固,基本上不受沖洗的影響;突變株被膜內的部分細胞較易脫落,會重新懸浮到沖洗液中。
經結晶紫染色后光學顯微鏡觀察,標準株呈完整片狀,幾乎較均勻的粘附于玻片表面,并且有一定的厚度;而LuxS突變株形成的被膜量少且薄,被膜團塊間有較大的間隙,呈散在的篩孔狀分布(圖5)。

表1 變鏈菌UA159標準株和LuxS突變株形態(tài)和生化鑒定結果
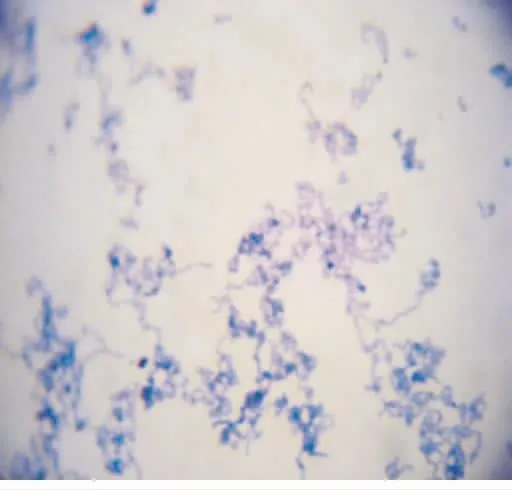
圖1 標準株(革蘭染色×1 000)

圖2 突變株(革蘭染色×1 000)
表2 24 h內變鏈菌LuxS突變株與標準株生長情況比較 (A值,n=9,±s)

表2 24 h內變鏈菌LuxS突變株與標準株生長情況比較 (A值,n=9,±s)
*與標準株相比P<0.05
時間(h)標準株 突變株0.5 0.018±0.014 0.018±0.020 1.5 0.079±0.024 0.079±0.018 2.5 0.146±0.071 0.143±0.021 3.5 0.247±0.082 0.242±0.032 4.5 0.301±0.079 0.302±0.043 5.5 0.343±0.095 0.343±0.051 6.5 0.394±0.098 0.390±0.057 7.5 0.489±0.083 0.481±0.069 8.5 0.746±0.102 0.703±0.095 9.5 1.258±0.191 1.229±0.107 10.5 2.253±0.304 2.059±0.313 11.5 2.558±0.373 2.272±0.304* 12.5 2.901±0.411 2.457±0.351*………21.5 2.663±0.394 2.399±0.394* 22.5 2.599±0.371 2.369±0.313* 23.5 2.342±0.322 2.217±0.336

圖4 變鏈菌標準株和突變株生物膜肉眼觀察
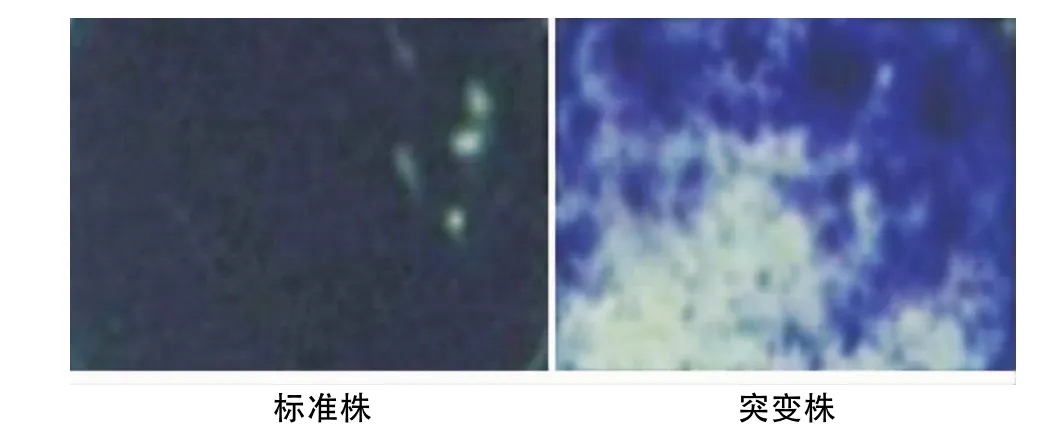
圖5 標準株和突變株生物膜結晶紫染色后的鏡下觀察(×40)
3 討論
變鏈菌是最重要的致齲菌,長期以來一直是國內外齲病防治研究的熱點。隨著分子生物學技術的發(fā)展,為了更好地研究某個與齲病相關的酶或基因,通常采用生物學手段突變該基因,構建出基因突變株[6],以期分析該基因在致病方面的作用[7-8]。
目前研究發(fā)現:在微生物界存在著兩種群體感應調控系統,一種是具有嚴格種屬特異性的種內群體感應調控系統[9-10],另一種是從哈氏弧菌(Vibrio harveyi)研究中發(fā)現了特異性的種間群體感應調控系統,即LuxS系統[11],存在于多種擁有特征性LuxS基因的細菌菌群當中。由于LuxS基因在不同菌屬中均高度保守,并已陸續(xù)發(fā)現超過40種致病生物膜構成菌能表達同源的LuxS蛋白,并且合成參與哈氏弧菌LuxS調控的自體誘導物(autoinducer,AI)信號分子,因此推測該系統可能具有種屬間的調控作用。在G+和G-細菌中存在一個共同的信號分子為呋喃酰硼酸二酯 (furanosylborate diester),即AI-2信號分子,它可以在細菌菌群間的相互作用中作為一種普遍密度感應信號而發(fā)揮功能,LuxS基因就是合成該信號分子的標志性基因。依賴于LuxS的信號系統被認為是一種種屬間感應群體系統,在許多種類細菌的重要生理功能和毒性的調節(jié)中發(fā)揮著重要作用[12]。
有研究顯示:細菌生物被膜并不是細菌菌體隨機粘連的結果,而是細菌群落相互合作分化成良好結構的結果。生物被膜的生成有賴于幾個步驟,即從最初粘附到完全成熟再到成型,從浮游生物到生物被膜生成的轉變需要繁瑣的代謝作用和生理學變化,其中存在一些促進這一過程的基因調節(jié)子。而群體感應系統作為一種基因調節(jié)系統被發(fā)現涉及細菌生物被膜的生成。
本課題組在先前的實驗中采用同源重組法構建了LuxS基因缺失的變鏈菌突變株:先用PCR方法擴增LuxS基因兩端區(qū)域目的基因片段,運用基因重組的方法將氯霉素抗性基因連接到上下游兩片段之間,并共同構建到PUC19載體的多克隆位點中,構建出帶氯霉素抗性標志的LuxS基因缺失突變的pUCluxKO載體;再用電穿孔技術對變鏈菌進行轉化,將突變載體pUCluxKO轉化進入變鏈菌標準株菌體,突變載體與標準株染色體之間發(fā)生同源重組,使氯霉素抗性基因置換標準株的LuxS基因,隨后因突變載體不能在S.mutans菌體內生長復制而丟失,從而得到LuxS基因缺失的突變株MS△LuxS。為了進一步了解LuxS基因缺失對變鏈菌生物學性狀的影響,本研究通過常規(guī)生化鑒定、革蘭染色涂片鑒定以及生長曲線測定和體外生物膜模型的建立,以期觀察變鏈菌標準株與LuxS突變株在生物學性狀方面的異同。
實驗結果顯示:標準株在高濃度氯霉素存在的環(huán)境下生長受到了明顯抑制,甚至會被滅活;而突變株中因含有氯霉素抗性基因片段,因此能在含氯霉素的培養(yǎng)基中正常生長。在不含有氯霉素的TSA固體培養(yǎng)基中培養(yǎng)48 h后,兩菌株均能正常生長,且在菌落形態(tài)學上沒有明顯的表型差異,菌落均為乳白色、呈細小而光滑的隆起狀且邊緣整齊。這說明LuxS基因突變后并不會導致變鏈菌較嚴重的生長缺陷,提示AI-2分子的生成并不是基本代謝過程中所必需的條件[13]。LuxS基因突變后,變鏈菌的生長模式或基本營養(yǎng)素需要量也并沒有發(fā)生顯著的變化[14]。常規(guī)生化鑒定顯示兩種菌株均為血清C型;涂片、革蘭染色后觀察,兩菌株均為革蘭染色陽性,但形態(tài)有差別:標準株的菌體呈長鏈狀排列且相互纏繞,局部呈團塊狀,為典型的變鏈菌形態(tài),而突變株菌體多呈短鏈狀排列,形成長鏈的比較少,甚至能見到不少游離的單個菌體。這可能是因為LuxS基因突變后變鏈菌依賴于該基因的群體感應調節(jié)機制有了缺陷,在一定程度上影響了菌群間信號分子的傳遞,從而對菌群的生長方式產生了影響[15]。生長曲線比較發(fā)現:兩菌株的生長模式基本相同,只是在進入生長穩(wěn)定期后,標準株的細菌飽和度(A值)明顯高于LuxS突變株,提示LuxS基因突變可一定程度上抑制變鏈菌的生長。生物被膜形成情況觀察顯示:兩菌株均能在玻片上形成肉眼可見的生物被膜,但標準株形成的生物膜相對光滑、比較完整且分布均勻,而突變株的生物膜較為粗糙、分布不均勻、有較大的分散狀團塊。另外,標準株的生物被膜與玻片表面結合的較牢固,基本不受沖洗的影響,而突變株生物膜內的一部分細胞易脫落,僅少量細胞粘附在玻片上。結晶紫染色后顯微鏡觀察,標準株生物膜呈一定厚度的完整片狀,幾乎鋪滿玻片表面,而突變株的被膜量少而薄,有分布不均勻的團塊,呈散在的篩孔狀分布。說明LuxS基因介導的種間群體感應系統在變鏈菌生物被膜形成中發(fā)揮了重要作用,但其確切的機制還有待于進一步探討。
[1] Aguilera-Galaviz LA,Aceves-Medina,Mdel C,et al.Detection of potentionally careiogenic strains of Streptococcus mutans using the polymenase chain reaction[J].Clin Pediatric Dent,2005,27(1):47-51.
[2] Costerton JW,Lewandowski Z,Caldwell DE,et al.Microbial biofilms[J].Annu Rev Microbiol,1995,49(3):711-745.
[3] Fuqua C,Parsek MR,Greenberg EP.Regulation of gene expression cy cell-to-cell communication:acyl-h(huán)omoserine lactone quorum sensing[J].Annu Rev Genet,2001,35:439-468.
[4] Kolenbrander PE,Andersen RN,Blehert DS,et al.Communication among oral bacteria[J].Microbiol Mol Biol Rev,2002,66 (3):486-505.
[5] Loo CY,Corliss DA,Ganeshkumar N,et al.Streptococcus gordonii biofilm formation:identification of genes that code for biofilm phenotypes[J].J Bacteriol,2000,182(5):1374-1382.
[6] Thurnheer T,van der Ploeg JR,Giertsen E,et al.Effects of Streptococcus mutans gtfC deficiency on mixed oral biofilms in vitro[J].Caries Res,2006,40(2):163-171.
[7] Igarashi T,Asaga E,Sato Y,et al.Inactivation of srtA gene of Streptococcus mutans inhibits dextran-dependent aggregation by glucan-binding protein C[J].Oral Microbiol Immun,2004,19 (1):57-60.
[8] Lee SF,McGavin MK.Identification of a point mutation resulting in loss of cell wall anchoring activity of srta of Streptococcus mutans NG5[J].Infect Immun,2004,72(7):4314-4317.
[9] Parsek MR,Greenberg EP.Acyl-h(huán)omoserine lactone quorum sensing in gram-negative bacteria:a signaling mechanism involved in associations with higher organisms[J].Proc Natl Acad Sci USA,2000,97(16):8789-8793.
[10] Dunny GM,Leonard BA.Cell-cell communication in gram positive bacteria[J].Annu Rev Microbiol,1997,51:527-564.
[11] Schauder S,Shokat K,Surette MG,et al.The LuxS family of bacterial autoinducers:biosynthesis of a novel quorum-sensing signal molecule[J].Mol Microbiol,2001,41(2):463-476.
[12] Yoshida A,Ansai T,Takehara T,et al.LuxS-based signaling affects Streptococcus mutans biofilm formation[J].Applied Environment Microbiol,2005,71(5):2372-2380.
[13] Day WA Jr,Maurelli AT.Shigella flexnexi LuxS quorum-sensing system modulates virB expression but is not essential for virulence[J].Infect Immun,2001,69(1):15-23.
[14] Merritt J,Qi F,Goodman SD,et al.Mutation of LuxS affects biofilm formation in Streptococcus mutans[J].Infection and immunity,2003,71(4):1972–1979.
[15] Lyon WR,Madden JC,Levin JC.Mutation of LuxS affects growth and virulence factor expression in Streptococcus mutans[J].Mol Microbiol,2001,42(1):145-157.

