小鼠仙臺病毒ELISA抗體檢測規范化試劑盒的研制與應用
向志光,佟 巍,劉先菊,張麗芳,李雨函,王艷蓉,劉云波,魏 強
(中國醫學科學院,北京協和醫學院,醫學實驗動物研究所,衛生部實驗動物檢測中心,北京 100021)
仙臺病毒是實驗用大鼠和小鼠嚴格控制的病毒性疾病,嚴重影響實驗動物的質量,因此清潔級以上實驗大小鼠中必須嚴格控制[1]。目前在病毒性病原體的檢測中多采取血清學方法,在我國的實驗動物國家標準中也推薦了如免疫熒光法(IFA)、免疫酶法(IEA)和酶聯免疫吸附試驗(ELISA)等傳統的血清學方法[2]。但是目前我國的實驗動物的檢測過程中多是以各自實驗室自行制備的試劑進行檢測,而檢測過程中檢測試劑的質量會最終影響到檢測結果的判定,因此對現有的檢測試劑進行標準規范化的研究十分必要。
根據我中心多年的工作積累,我們按照我國農業部對于獸醫診斷制品的要求[3],對小鼠仙臺病毒抗體ELISA檢測試劑盒進行了較為規范的研制。
1 材料和方法
1.1 病毒、細胞等的來源和種子批、庫的建立
仙臺病毒和病毒培養細胞BHK-21來自美國ATCC。培養仙臺病毒用SPF雞胚來自北京梅里亞維通實驗動物技術有限公司。培養BHK-21細胞的EMEM培養基來自美國ATCC。胎牛血清和其他添加劑為Invitrogen公司產品。100μL仙臺病毒原液接種SPF雞胚收獲尿囊液,繼續在雞胚傳代分別混合成批,經病毒的種子批純凈性和毒力等檢定分別建立仙臺病毒的原始種子批,基礎種子批和工作種子批。BHK-21細胞經擴大培養傳代建立相應的3層細胞庫。
1.2 病毒抗原的生產和純化
以一定毒力的工作種子批病毒接種培養成單層的BHK-21細胞,培養一定時間后對培養物做反復凍融,經56℃30 min對培養物做滅活處理,經連續的差速離心去除細胞碎片,收集病毒。病毒經超聲處理,離心后的可溶性蛋白組分測定濃度,作為仙臺病毒ELISA檢測中的抗原蛋白進行后續包被。
1.3 標準血清的制備
以雞胚尿囊液培養的仙臺病毒多次不同途徑接種6~8周齡SPF級BALB/C小鼠,最后一次接種一周后收集血清,并作滅活處理[4]。以IFA方法和ELISA方法對免疫血清做滴度檢測,IFA滴度大于1∶160的血清可混合成批,對每批混合血清做IFA滴度測試使其達到1∶160以上。批次免疫血清做梯度稀釋后進行ELISA檢測,按照測定值在1.1~1.6范圍內的稀釋度稀釋免疫血清可以做后續ELISA檢測的陽性對照(陽性標準血清)。能夠用IFA方法做陽性判定的最低稀釋度免疫血清作為ELISA檢測的陽性臨界判定血清(陽性臨界值血清)。普通的SPF小鼠經鑒定排除仙臺病毒感染,血清混合作為陰性對照(陰性標準血清)。
1.4 ELISA反應板體系的優化
分別以不同濃度的抗原蛋白包被ELISA平板,測定梯度稀釋的免疫血清,選擇最優的抗原包被濃度。測定不同反應條件(反應溫度)對于檢測結果的影響。確定最優反應條件。
1.5 樣品的檢測
對照標準血清和待檢樣品做1∶40倍稀釋100μL,加入預先水化的ELISA孔中,每個樣品做復孔,留空白孔做對照,37℃孵育1 h;扣除孵育液,PBST洗板3次后加入酶標記物,37℃孵育1 h;扣除孵育液,PBST洗板3次后加入酶底物液,室溫孵育10 min以內,待陽性標準血清顯色至OD600讀值至0.8加入終止液終止顯色反應,OD450讀值檢測。陽性臨界血清測量值作為陽性樣品判定標準;陰性標準血清測量值加0.15做陰性樣品判定標準。
1.6 IFA和Westernblot對于結果的驗證
參照國家標準中的IFA方法制備仙臺病毒感染細胞的抗原玻片,進行IFA方法檢測。使用包被ELISA平板的抗原蛋白行SDS-PAGE電泳轉至NC膜上和1∶100稀釋的血清樣本進行雜交,使用酶標記二抗顯示特異條帶,ECL發光顯影。
1.7 檢測體系的質量控制
對ELISA試劑盒的生產、保存、使用等環節進行質量控制。關鍵質控點包括:抗原蛋白的純度測定;酶標板批內批間的穩定性檢測;標準血清的批次滴度測定;檢測體系中空白孔、陰性標準血清、陽性標準血清、陽性臨界濃度血清測量值范圍做限定。
2 結果
2.1 仙臺病毒種子批和BHK-21細胞庫的建立和鑒定
將500μL仙臺病毒原液接種5只SPF雞胚收獲尿囊液混合成批,作為原始病毒的種子批,在雞胚繼續傳代混合成批,分別制備基礎種子批和工作種子批,使用血凝法對病毒的毒力進行測定,血凝毒力達到要求的1∶128以上。3層種子批通過了無菌檢驗、支原體檢驗、病毒的特征性血凝抑制實驗,達到農業部對于病毒的種子批純凈性和毒力等檢定的要求。BHK-21細胞經擴大培養分別建立了原始細胞庫、基礎細胞庫、工作細胞庫,通過了農業部要求的檢驗。每3個月對病毒種子批進行毒力測定,發現病毒保存6個月內毒力無明顯變化,細胞庫6個月復蘇測定細胞復蘇效率未發現明顯變化。建立了病毒種子批和細胞庫的保藏管理和更新維護的體系,以滿足后續試劑盒的長期生產需求。
2.2 病毒抗原的生產和純化工藝研究
以不同劑量的仙臺病毒接種培養成單層的BHK-21細胞,結果發現血凝滴度低于1∶64的仙臺病毒雞胚尿囊液培養物感染BHK細胞在1周以內不能很好的引起細胞病變,測試血凝滴度低于1∶32;當血凝滴度高于1∶512時細胞病變發生迅速(小于24 h),但血凝滴度未能達到1∶64;使用血凝滴度1∶128的仙臺病毒培養物感染BHK-21細胞,在60~84 h間細胞培養物中病毒的滴度處于增殖狀態,而之后的時間段病毒滴度下降,在更換培養基后滴度有少量提高。

圖1 不同劑量仙臺病毒接種BHK-21細胞培養病毒血凝滴度變化Fig.1 HI changes of Sendai virus cultured in BHK-21 cells with different inoculation doses
對病毒細胞培養物做反復凍融,經56℃30 min對培養物做滅活處理,做后續抗原蛋白純化。直接使用細胞培養物作為ELISA抗原,結果顯示抗原特異性差;使用10000 rpm低溫離心30 m in能有效去除細胞碎片,在經過35000 rpm低溫離心3 h收集病毒顆粒。直接使用病毒顆粒進行ELISA平板包被,和對照血清的反應結果顯示不同孔之間檢測數值存在差異,差值較大。對病毒顆粒進行超聲處理,收集可溶性抗原蛋白進行平板包被,平板孔與孔之見差異極小,適用于ELISA抗原生產(具體數據另文報告)。因此確定為病毒抗原生產工藝。
2.3 標準血清的制備
每批50只國家標準檢測合格的6周齡SPF級 BALB/c小鼠,使用SeV雞胚尿囊液,濃度為100 TCID50/100μL,先后以一次腹腔、2次滴鼻的方式每隔一周進行一次接種。最后一次免疫后第10天,尾尖采血,56℃30 min滅活,5000 rpm/min離心20 m in后取上清測定抗體IFA效價。效價高于1∶160認為免疫合格進行后續采血。對同一批次的免疫血清進行檢驗。每批混合血清做IFA滴度測試,3批次免疫血清均達到1∶320。
混合成批的免疫血清從1∶40開始進行倍比稀釋至1∶40960將稀釋好的血清加入用已包被有SeV抗原的ELISA板中,根據ELISA反應條件進行操作,最后在450 nm波長處測OD值。測定值在1.1~1.6范圍內的稀釋度為1∶640左右,對3批次免疫血清做1∶16倍稀釋后作為陽性對照。再做1∶40稀釋達到1∶640,多次測量OD450吸光度在1.1~1.6范圍內。檢測吸光度達到合理范圍,可以做后續ELISA檢測的陽性對照(陽性標準血清)。陽性標準血清再進行8倍稀釋后可以被IFA方法做陽性判定。繼續稀釋不能做IFA法陽性判定。因此將陽性標準血清做8被稀釋可做ELISA檢測的陽性臨界判定血清(陽性臨界值血清)。普通的SPF小鼠經鑒定排除仙臺病毒感染,血清混合成批作為陰性對照(陰性標準血清)。
2.4 ELISA反應板體系的優化
將抗原稀釋成10μg/m L、5μg/m L、2.5μg/ m L、1.25μg/m L蛋白濃度,小鼠抗SeV免疫血清從1∶40開始倍比稀釋,進行間接ELISA實驗,結果表明,包被抗原為1.25μg/m L時為最適抗原包被濃度。
對于30份標準樣品進行檢測,選擇不同的血清孵育溫度,以及不同二抗孵育反應的溫度分析標準樣品在不同條件下的檢測結果,結果發現不同反應溫度的變化影響到ELISA檢測讀數,也會影響實驗結果的判定。控制反應溫度在37℃,反應1 h可以保證免疫反應的充分進行,實驗結果較為穩定。因此確定血清樣本的反應溫度和二抗的反應溫度均在37℃,各自反應1 h可作為試劑盒檢測的最適條件。
2.5 小鼠血清樣品測試ELISA試劑盒
來源清晰的SPF級小鼠血清樣本、仙臺病毒免疫小鼠血清和其它方法測定仙臺病毒陽性小鼠血清樣本的作為測試樣本,測定多批次小鼠仙臺病毒ELISA檢測試劑盒陰性樣本的均值和標準差。結果發現:513份SPF小鼠血清ELISA檢測OD450均值在3次實驗中分別為0.043±0.035;0.056±0.045; 0.067±0.052;IFA法判定的仙臺病毒陽性的免疫血清的臨界濃度在ELISA檢測中OD450的測量值在0.3~0.45之間變動;672份待測血清樣本使用陰性對照測量均值+0.15(3倍標準差)作為陰性樣本的判定標準,測得試劑盒的特異性高于99.7%;使用仙臺病毒陽性的免疫血清的臨界濃度在ELISA檢測中OD450的測量值作為陽性樣本的判定標準,敏感性高于99.5%。
2.6 IFA和Westernblot對于結果的驗證
參照國家標準中的IFA方法制備仙臺病毒感染細胞的抗原玻片,進行IFA方法檢測。小鼠仙臺病毒ELISA檢測試劑盒與國家標準IFA方法的符合率為98.33%;將ELISA檢測結果處于2個臨界濃度之間的血清進行Western blot檢測,在被檢的10份血清中有6份存在陽性條帶。
2.7 ELISA試劑盒的質量控制
3批次抗原蛋白行SDS-PAGE電泳,轉至NC膜和免疫血清進行雜交,結果如圖3所示:3批抗原蛋白均顯示出主要抗原蛋白條帶,無明顯雜帶存在。符合此標準的抗原蛋白可以進行后續抗原包被工作。
為了測定小鼠仙臺病毒ELISA檢測試劑盒批間和批內檢測標準樣品的實驗重復性,測定同一樣品的在不同批次產品測試結果的變異率,以及批間和批內的測試變異對于檢測結果的影響,隨機抽取3批ELISA平板樣品,每批樣品隨機抽取6塊ELISA平板,使用同一組測試血清樣品30份,在每個測試平板上測試,并做復孔。統計測試結果在不同批次和批內的變異率,同時計算測試的敏感性和特異性,評價批內結果的變異率和批間結果的變異率對檢測結果的影響。結果發現:用IFA方法測定30份血清樣品,其中5份為陽性,25份為陰性血清樣品。使用ELISA方法測定陽性樣本為5份,陰性樣本為25份。不同批次和批內不同試劑盒平板不影響檢測結果的判定。陰性樣本OD450測定數值的批內變異率小于5%,批間變異率小于5%(圖4);陽性樣本OD450測定數值的批內變異率小于5%,批間變異率小于10%(圖5)。

圖3 3批抗原和標準免疫血清雜交的結果Fig.3 Western blot reaction of 3 batches antigens with standardized immune serum

圖4 25份陰性樣本測試ELISA試劑盒批內變異率和批間變異率Fig.4 The variability of 3 batches ELISA kitstested by 25 SeV negative sera
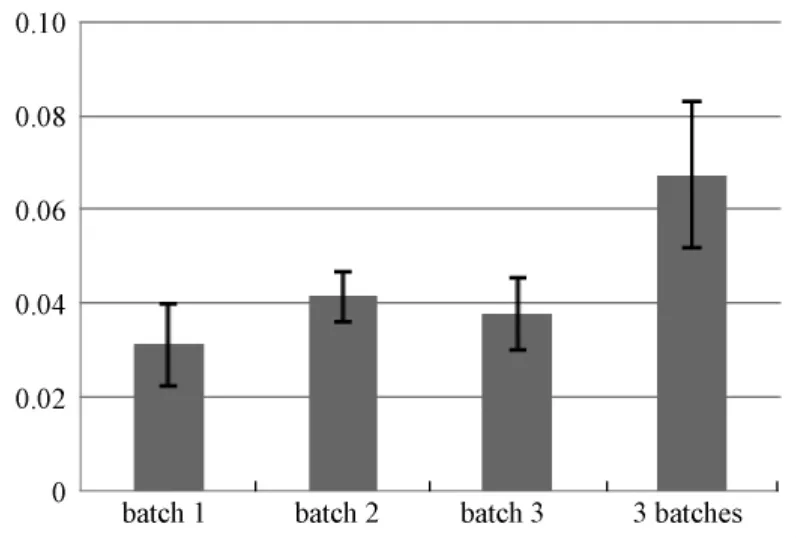
圖5 5份陽性樣本測試ELISA試劑盒批內變異率和批間變異率Fig.5 The variability of 3 batches ELISA kitstested by 5 SeV positive sera
混合制備的小鼠仙臺病毒陰性血清ELISA檢測多次重復試驗OD450的測量值在0.1以下;對3個批次的免疫血清的批次滴度進行測定,結果如圖6所示,進行倍比稀釋用ELISA試劑盒進行檢測,3批次免疫血清測量值重復性較好。

圖6 3批仙臺病毒免疫血清用ELISA方法做質控檢驗Fig.6 The quality control tests of 3 batches SeV immune sera
3 討論
酶聯免疫吸附試驗作為較為常規的血清學檢測方法操作簡便,對設備要求不高,樣品檢測通量較大,目前在實驗動物的質量控制方面應用前景廣闊。但是作為一種實驗動物的診斷用試劑,其質量的穩定性十分重要。在ELISA試劑盒的質量控制中最為關鍵的問題包括抗原的質量,生產工藝的穩定性,參比血清的穩定性等,因此本文就我中心研發小鼠仙臺病毒ELISA試劑盒過程中的質控技術做了闡述。
包被抗原是酶聯免疫吸附試驗的重要因素。天然抗原目前仍是最具代表性的抗原物質,因此我們在本試劑盒的開發中首選天然病毒抗原。考慮到生產成本和生產工藝的穩定性,本試劑盒采用BHK-21細胞作為病毒擴大培養的載體,和雞胚來源的病毒相比,該方法排除了雞胚蛋白對于實驗的干擾(結果未展示),生產工藝穩定。在病毒抗原生產中感染用仙臺病毒的接種劑量有一定的范圍要求。當病毒接種劑量過低時,短時間內不能很好的引起細胞的病變,一方面影響了病毒的增長,對于生產的病毒的質量產生影響;同時病毒生產的周期過長,不利于病毒培養的條件控制,也提高了生產的成本。而病毒接種劑量過高導致被感染細胞病變速度過快,同樣影響了病毒的質量,使得病毒的生長不完全,而細胞破碎嚴重。適當接種劑量的仙臺病毒(在本研究中選擇了血凝滴度1:128的接種劑量)可以在感染細胞2~3 d的時間范圍出現病毒的快速增長,病毒的培養較為穩定,在接種后72 h收獲病毒,符合試劑盒病毒生產的需要,可以作為最適的培養條件。
仙臺病毒作為顆粒性抗原,大小在100 nm以上,對于酶標板表面的吸附性較差。本研究中將病毒抗原做超聲處理,收集可溶性成分進行酶標板的抗原包被,結果顯示包被孔之見差異較小,有效的提高了抗原包被的穩定性。而對于抗原純度的控制我們采用了免疫印記的方法對于主要抗原帶型進行了鑒定。通過此種質控手段,本試劑盒的批間檢測結果的變異率控制在較低水平。
通過對大量檢測樣品的測試,我們發現SPF級動物的血清檢測數據多控制在0.2以下。而不同實驗對此標準會有一定影響,例如顯色時間和顯色程度,因此我們采取陰性參比血清的檢測結果加0.15作為陰性判定標準。以此標準對大量樣品做多次檢測,檢測的特異性達到99%以上。因此在檢測過程中低于此標準的樣品可做陰性判定。而高于此標準的血清樣品,仍有少量不能用IFA和Western blot等其他方法做陽性判定,而高于IFA法臨界濃度的樣品,在陽性結果的判定上有較高的一致性。可以看出對于小鼠仙臺病毒的檢測最為靈敏的方法為ELISA方法,其次為Western blot,而IFA方法靈敏度相對較低。因此在本試劑盒中增設了陽性臨界濃度血清判定指標,當ELISA檢測結果高于此標準時,使用其他方法可對此樣品做出一致的判斷。而低于此標準高于陰性判定標準的樣品,其來源動物的種群需要做進一步的檢測。我們對仙臺病毒感染小鼠也做了消長規律的研究,在感染一周后就可以用ELISA試劑盒檢測抗仙臺病毒的抗體,而感染3個月后抗仙臺病毒抗體的水品任然維持在高位,因此目前國家標準對于實驗小鼠仙臺病毒檢測周期的要求是合理的。
[1]國家標準:實驗動物微生物學等級及監測,GB14922.2 -2001.
[2]國家標準:實驗動物仙臺病毒檢測方法,GB/T 14926.23 -2001.
[3]獸醫診斷制品注冊分類及注冊資料要求。農業部公告第442號發布.
[4]侯麗波,謝軍芳,佟巍,等.小鼠仙臺病毒標準化血清的制備及鑒定[J].中國比較醫學雜志,2008,18(9):57-59.

