木犀草素對人胃癌HGC-27細胞遷移的影響及機制
王 鵬,姜戰武,孫玉國,曲 杰
(1承德醫學院,河北承德067000;2保定市第一中心醫院;3承德醫學院附屬醫院)
木犀草素是一種天然黃酮類化合物,多以糖苷的形式存在于多種植物中,以全葉青蘭、辣椒、野菊花、金銀花、紫蘇含量較高,具有鎮咳和祛痰作用,臨床上多用于止咳、祛痰、消炎、治療心血管疾病、治療炎癥性脫髓鞘疾病、SARS、干燥性皮膚瘙癢等[1~5]。近年來對木犀草素抗腫瘤作用的研究主要是其抑制腫瘤的增殖與促進凋亡[6,7],未見關于其抑制胃癌細胞遷移功能的報道。本研究旨在觀察木犀草素對人胃癌細胞系HGC-27細胞體外遷移能力的影響,并探討其可能的機制。
1 材料與方法
1.1 材料
1.1.1 細胞株 人胃癌HGC-27細胞由承德醫學院附屬醫院中心實驗室提供。
1.1.2 主要試劑及儀器 RPMI Medium1640培養基干粉和胎牛血清(FBS)為Gibco公司產品,胰蛋白酶為Amersco公司產品,二甲基亞砜(DMSO)、Luteolin、MMP-7及β-actin抗體為Sigma公司產品,辣根過氧化物酶標記的二抗為北京中杉金橋公司產品。Lu溶解在DMSO中,濃度為100μmol/L,-20℃保存,實驗中用相應的培養液或溶劑稀釋。
1.1.3 儀器 Primo R型低溫高速離心機(德國Heraeus公司),CO2培養箱(美國Forma公司),倒置熒光顯微鏡(Zeiss公司),HFsafe-1500型生物安全柜(HEAL FORCE公司),Transwell小皿(Millipore公司),3633型高壓消毒鍋(美國Yamato scientificwc公司),HP-8453紫外—可見分光光度計(惠普公司),梅特勒—托利多AG245電子分析天平(瑞士梅特勒—托利多公司)。
1.2 方法
1.2.1 細胞分組及培養 HGC-27細胞置37℃、5%CO2培養箱,用含10%FBS以及青、鏈霉素各100 U/mL的RPM1640培養液培養。倒置顯微鏡觀察細胞生長情況,0.25%胰蛋白酶消化傳代,取對數生長期細胞接種于6孔培養板,每孔容積1 mL,其中3孔分別加入10、20、40 μmol/L的木犀草素溶液100 μL,分別為A、B、C組,另外3孔加入等量DMSO作為對照(對照組)。常規培養。培養24 h后于倒置相差顯微鏡下直接觀察培養板中腫瘤細胞形態特征。
1.2.2 細胞遷移能力檢測 ①細胞劃痕實驗:將HGC-27細胞鋪滿6孔培養板,待細胞貼壁長滿后進行劃痕,PBS洗1遍,更換為無血清培養基,培養24 h。結果以培養24 h后HGC-27細胞覆蓋區域占起始劃痕面積的百分比表示。②Transwell實驗:取指數生長期的HGC-27細胞,胰酶消化,RPM1640培養基制備細胞懸液,細胞計數。調整細胞數為每100 μL懸液含5×104個細胞進行鋪板。24孔培養板中每孔加入600 μL含15%小牛血清的RPM1640完全培養基,在Transwell小室的上室分別加入100 μL HGC-27細胞懸液,各含5×104個細胞,最后上室加入10 μL的1%BSA,使BSA最終濃度為0.1%,以保持上室內的滲透壓。加入不同濃度的木犀草素100 μL,37℃、5%CO2培養箱常規培養15 h。取出小室用90%乙醇固定,0.1%結晶紫溶液染色,置于顯微鏡下觀察并拍照,隨機選取4個低倍視野(× 400)進行細胞計數,并計算平均值。實驗重復3次。結果以實驗組HGC-27細胞穿膜數量占對照組細胞穿膜數量的百分比表示。
1.2.3 MMP-7水平檢測 采用Western blot法。分別取木犀草素處理前后的HGC-27細胞均約5× 106個,加入300 μL細胞裂解液,冰上裂解30 min后轉移至1.5 mL EP管中,12 000 r/min 4℃離心4 min,取上清液置于-20℃保存。BCA法測定蛋白濃度。每個泳道上樣蛋白量為40 μg,上樣于12%聚丙烯酰胺凝膠電泳(SDS-PAGE電泳),80 V電泳30 min,120 V電泳90 min,電泳完畢后,將蛋白轉移至PVDF膜,用新鮮配制的含5%脫脂奶粉的磷酸鹽吐溫緩沖液(PBST液)搖床上封閉2 h,加入MMP-7抗體(1∶500)及抗β-Actin抗體(1∶500),4℃反應過夜。然后將膜取出,用PBS液洗滌3次,每次15 min,辣根過氧化物酶標記的二抗(1∶3 000)室溫封閉1 h,然后用PBST液洗滌3次,每次10 min,最后用化學發光法檢測,X線片記錄結果。
1.2.4 統計學方法 采用SPSS17.0統計軟件。數據用±s表示。多組間的比較采用方差分析,兩兩比較采用LSD-t檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 形態學變化 正常培養條件下生長的HGC-27細胞形態不規則,呈三角形或梭形,輪廓清晰,包膜完整,胞體透亮,貼壁良好。培養24 h后與對照組相比A組HGC-27細胞形態沒有明顯變化;B組HGC-27細胞開始皺縮,生長緩慢,體積變小,胞質渾濁,細胞周緣模糊,出現細胞間隙;C組HGC-27細胞間隙增大,體積縮小,胞質濃縮,細胞生長緩慢,胞體皺縮,部分細胞破碎,總體呈分散懸浮生長,貼壁現象減弱甚至消失。
2.2 細胞遷移能力 劃痕實驗中培養24 h后,未經木犀草素處理的HGC-27細胞運動遷移基本完全覆蓋了劃痕區域,而A、B、C組HGC-27細胞僅覆蓋了96.2%、72.3%、55.6%的劃痕區域。Transwell實驗中A、B、C組HGC-27細胞穿膜數量占對照組細胞穿膜數量的百分比分別為97.6%、59.5%、20.0%。
2.3 MMP-7的表達情況 Western blot結果顯示,經木犀草素處理過的HGC-27細胞中MMP-7表達較對照組明顯降低,隨著木犀草素濃度的增加而減少,見圖1。
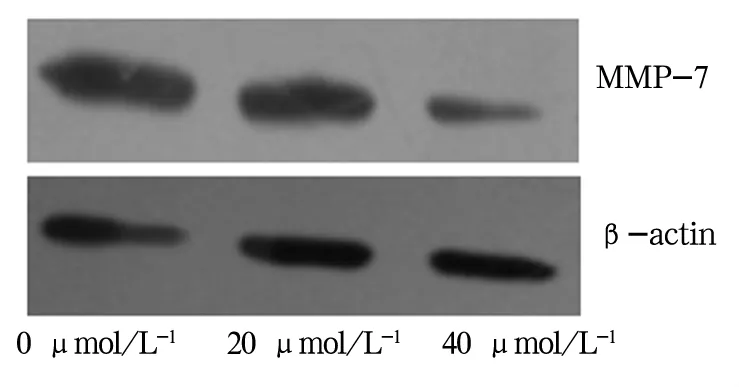
圖1 木犀草素對人胃癌HGC-27細胞中MMP-7表達水平的影響
3 討論
胃癌是世界范圍內最常見的惡性腫瘤之一。據2000年資料統計,全球每年新發胃癌87萬例,占所有新發癌癥病例的9%,僅次于肺癌、乳腺癌和腸癌,居第4位,每年約有64萬人因胃癌死亡,居癌癥死因的第2位[8]。胃癌的轉移仍然是外科手術治療的瓶頸。臨床研究統計表明[9],約60%就診的腫瘤患者就診時已經發生了轉移,80%的患者最終要發展到腫瘤晚期階段,約8.6%的患者就診時周圍血中能查見癌細胞,76%患者在腫瘤復發、轉移的2 a內死亡。
腫瘤的轉移過程機制和復雜伴隨著多種細胞因子的異常表達[10]。基質金屬蛋白酶(MMPs)是研究比較多的一個。目前已知腫瘤的侵襲與轉移是腫瘤發展過程中的重要步驟,也是導致患者死亡的主要原因。MMP-7又稱基質溶解素,是金屬蛋白酶家族中最小的成員,可表達于多種組織的病理和生理過程中。腫瘤細胞產生且能夠活化其他MMPs成員如MMP-2、MMP-9等,還能滅活絲氨酸蛋白酶抑制劑[11],因此推測MMP-7在腫瘤的轉移中發揮直接作用。
我國是天然藥物大國,應用中草藥治療腫瘤歷史悠久,現代藥理研究表明,木犀草具有抗腫瘤效果,可以通過抗增殖和誘導凋亡抑制惡性腫瘤細胞的生長,在體外對人非小細胞肺癌A549細胞、人子宮頸癌HeLa細胞、人乳腺癌MCF-7細胞、人結腸癌CaCO2細胞、人胃腺癌AGS細胞、人胃癌MGC-803細胞、人肝癌HepG2細胞多種癌細胞有抑制增殖作用[12],還可誘導一些癌細胞發生凋亡,在HeLa細胞和前列腺癌細胞系DU145等人類惡性腫瘤細胞中,木犀草素能顯著上調死亡受體(DR5,也稱為TRAILR2),引起細胞凋亡,并伴隨著Bcl-2-相互作用區域的剪切和Caspase-3、8、9、10的激活,而對正常細胞則沒有類似作用[13]。王煥等[14]采用小鼠自發性腫瘤轉移和被動轉移模型,通過檢測腫瘤轉移結節數及臟器指數來研究木犀草素對小鼠Lewis肺癌和4T1乳腺癌轉移的影響。結果顯示木犀草素可有效抑制小鼠Lewis和4T1肺轉移結節數,增強小鼠對癌癥的相伴免疫反應,有明顯的抗轉移作用。
木犀草素對胃癌細胞遷移的研究國內未見報道。本研究結果顯示木犀草素在10~40 μmol/L范圍內對人胃癌細胞系HGC-27的增殖產生抑制作用,且呈濃度依賴性。40 μmol/L木犀草素作用24 h后對細胞增殖抑制率達到55.6%,表明木犀草素在體外能夠有效的抑制胃癌細胞的增殖,Transwell實驗表明木犀草素對人胃癌HGC-27細胞的遷移有明顯的抑制作用,且其與用藥濃度呈正向相關。同時,遷移能力減弱細胞中細胞因子MMP-7的表達被強烈抑制。據此,我們推測木犀草素抑制人胃癌HGC-27細胞的遷移與其抑制細胞內MMP-7的蛋白表達水平從而減少細胞外基質大分子蛋白水解有關。
[1]范文輝,黃茂.木犀草素對哮喘小鼠氣道重塑的影響及機制探討[J].安徽醫藥,2006,10(9):647-649.
[2]呂立華,呂林華等木犀草素對自發性高血壓大鼠心肌組織的保護作用及 NF-κB表達的影響[J].時珍國醫國藥,2011,22 (7):1645-1646.
[3]van Meeteren ME,Hendriks JJ,Dijkstra CD,et al.Dietar y compounds prevent oxidative damage and nitricoxide production by cells involved in demyelinating disease[J].Biochem Pharmacol,2004,67(5):967.
[4]Wu WW,Liu BL,Tang N,et al,Topical application of luteolin inhibits dry skin prurius in mice[J].Chin J Nat Med,2005,3 (3):1731.
[5]Yi L,Li Z,Yuan K,et al.Small molecules blocking the entry of severe acute respiratory syndrome coronavirus into host cells[J].J Virol,2004,78(20):113341.
[6]Brusselmans K,Vrolix R,Verhoeven G,et al.Induction of cancer cell apoptosis by flavonoids is associated with their ability to inhibit fatty acid synthase activity[J].J Biol Chem,2005,280(7): 5636.
[7]Shi RX,Ong CN,Shen HM.Protein kinase C inhibition of apoptosis protein degradation contribute to the sensitization effect of luteilin on tumor necrosis factor related apoptosis inducing ligand induced apoptosis in cencer cells[J].Cancer Res,2005,65(17): 7815.
[8]徐飚,王建明.胃癌流行病學研究[J].中華腫瘤防治雜志,2006,13(1):1-7.
[9]李佩文.中西醫臨床腫瘤學[M].北京:中國中醫藥出版社,1996:336.
[10]張筱茵,陳詠儀.胃癌局部細胞因子表達譜分析[J].中華腫瘤雜志,2002,24(1):27.
[11]Parsons SL,Swatson SA,Brown PD,et al.Matrixmetalloproteinase[J].BritSurg,1997,84(2):160.
[12]王洪燕.木犀草素抗腫瘤增殖及增敏抗腫瘤藥物作用研究[J],浙江大學學報,2010,1(39):30-36.
[13]Horinaka M,Yoashida T,Shirai SHIT,et al.Luteolin induces apoptosis via death receptor 5 upregulation in human malignant tumor cells[J].Oncogene,2005,24(48):7180-7189.
[14]王煥,王荔.木犀草素抗腫瘤轉移作用[J].中國醫院藥學雜志,2010,30(22)1915-1917.

