APC基因啟動子區甲基化及環境因素與前列腺癌關系研究
張連升,梁 永,崔飛倫
(1興化市人民醫院,江蘇興化225700;2兗州市九一醫院;3江蘇大學附屬人民醫院)
前列腺癌(PCa)在歐美地區發病率較其他國家或地區高,占歐美男性癌癥的第2位,是發達國家導致男性死亡的主要威脅之一[1]。腺瘤樣結腸息肉易感基因(APC基因)編碼的APC蛋白是個多功能抑制腫瘤的蛋白家族,直接參與Wnt信號傳導途徑,還參與細胞骨架兩種主要成分微絲和微管的調節。2011年10月~2012年3月,我們檢測了60例前列腺癌患者APC基因啟動子區CpG甲基化情況,觀察其APC基因啟動子區CpG甲基化率的變化,分析環境危險因素的作用,探索預防和早期診斷PCa的思路和方法。
1 資料與方法
1.1 臨床資料 選擇2007年10月~2011年9月江蘇大學附屬人民醫院收治的60例新發PCa患者為PCa組,年齡61~86(75.85±6.79)歲,均經臨床病理證實。Gleason評分4~7分者56例,8~10分者4例。另取40例良性前列腺增生(BPH)患者為BPH組,年齡64~84歲。
1.2 方法
1.2.1 流行病學調查 由統一的調查員,利用統一的調查表,按照規定內容采用面試方式進行調查,逐一詢問并如實填寫,所有內容均獲得調查者的同意。收集的環境危險因素包括體質量指數(BMI)、飲酒、喝茶、吸煙、體育運動等。飲酒定義為每周至少1次并持續6個月以上;不飲茶為飲茶次數<4次/周,否則為飲茶;吸煙分為不吸、適度吸煙(≤20支/d)、重度吸煙(>20支/d)三類;運動時間超過30 min為運動1次,不運動為運動頻率<4次/周,否則為運動。
1.2.2 APC基因啟動子區CpG甲基化的檢測 采用亞硫酸鹽修飾后測序法檢測。①樣本處理及提取DNA:切取兩組患者PCa或BPH組織石蠟標本,用10%甲醛固定,用DNA提取試劑盒操作流程提取DNA。DNA提取量一般40~120 ng/μL,紫外分光光度計測定峰值260 nm,DNA無RNA和蛋白污染。②亞硫酸氫鹽修飾DNA:用EZ DNA Methylation-Gold TMKit DNA(ZYMO RESEARCH)試劑盒嚴格按照步驟處理,修飾DNA。③引物設計:用Primer5.0軟件進行設計APC基因引物設計。APC上游引物5'-GGGGTTAGGGTTAGGTAGGTTG-3',下游引物5'-AACACCTCCATTCTATCTCCAATAA-3',M13-47引物5'-CGCCAGGGTTTTCCCAGTCACGAC-3'。選APC基因轉錄起始位點上游1 000 bp至第一外顯子區富含CG位點密集的基因區824~1 054為研究序列,基因長度231 bp,其中包含13個CG位點。④PCR:反應體積50 μL,其中Hot Start Version Taq 0.5 μL,引物各1 μL,dNTP 4 μL,修飾后的DNA 8 μL,余下以ddH2O補齊,所有反應皆用ddH2O作為對照。PCR反應參數:94℃ 2 min 40 s,94℃ 30 s,57℃30 s,72℃ 40 s,37個循環;72℃ 5 min。APC基因產物片段為231 bp。PCR反應產物經2%瓊脂糖凝膠電泳,隨機選取10%標本進行重復實驗。⑤PCR產物純化回收:PCR產物經Axy Prep PCR清潔試劑盒純化回收后備基因克隆用。⑥目的基因克隆:分別從PCa組和BPH組隨機選取3個DNA樣本進行同組混合。混合后DNA用于基因克隆測序。實驗步驟為:pMD18-TVector載體1 μL,PCR產物1 μL,SolutionⅠ5 μL,ddH2O補至10 μL,混均后16℃反應90 min,全量(10 μL)加入100 μL大腸桿菌DH5α感受態細胞中,冰浴30 mim,42℃加熱60 s后,迅速再次冰浴2 min,加入890 μL的SOC培養(無氨芐西林),37℃下220 r/min震蕩,培養120 min,全速離心后棄去上清液,涂布于LB瓊脂平板(含氨芐西林100 μg/mL)上培養,37℃培養箱過夜。⑦PCR鑒定克隆及測序:從克隆后菌落中各挑選10個白色孤立克隆,置入200 μL LB液體培養基中搖菌3 h后PCR鑒定。PCR反應體系:鑒定引物RV-M 1 μL,M13-47 1μL,TaqPCR Master Mix 12.5 μL,模板(菌液)1 μL,ddH2O補至25 μL。PCR反應參數:94℃3 min;94℃30 s,55℃30 s,72℃30 s,30個循環;72℃5 min。PCR產物經2% 瓊脂糖凝膠電泳,鑒定APC基因大小382 bp(目的基因230 +載體區152 bp)。鑒定合格后隆送公司(上海邁浦生物科技有限公司)測序。
1.2.3 統計學方法 采用雙錄入的方式將實驗室檢測和流行病學調查資料錄入計算機。采用SPSS16.0統計軟件進行數據分析,組間比較采用χ2檢驗及精確概率法。P≤0.05為差異有統計學意義。
2 結果
2.1 PCa發病的環境危險因素 PCa發生的環境因素分析表明,PCa發病與飲酒、飲茶有關,其相對危險度的比值比(OR)分別為:2.46(95%CI為1.02~5.91)、0.29(95%CI為0.12~0.67);PCa發病與患者年齡、BMI、吸煙、運動無關。
2.2 APC基因啟動子區CpG甲基化程度 PCa組測序780個CG位點,381個(48.84%)有甲基化;對照組測序520個CG位點,6個有甲基化。PCa組APC基因啟動子區CpG甲基化率明顯高于對照組(P<0.05)。
2.3 APC基因啟動子區CpG甲基化與PCa臨床病理參數的關系 見表1。由表1可見,PCa組APC基因啟動子區CpG甲基化與血清前列腺特異性抗原(PSA)水平、Gleason評分、TNM分期有關(P均<0.05)。
3 討論
到目前為止,PCa的病因及致病機制仍不十分清楚。Lichtenstein等[2]研究表明,42%的PCa患者的發病可歸因于遺傳因素,其他的則與環境因素相關。
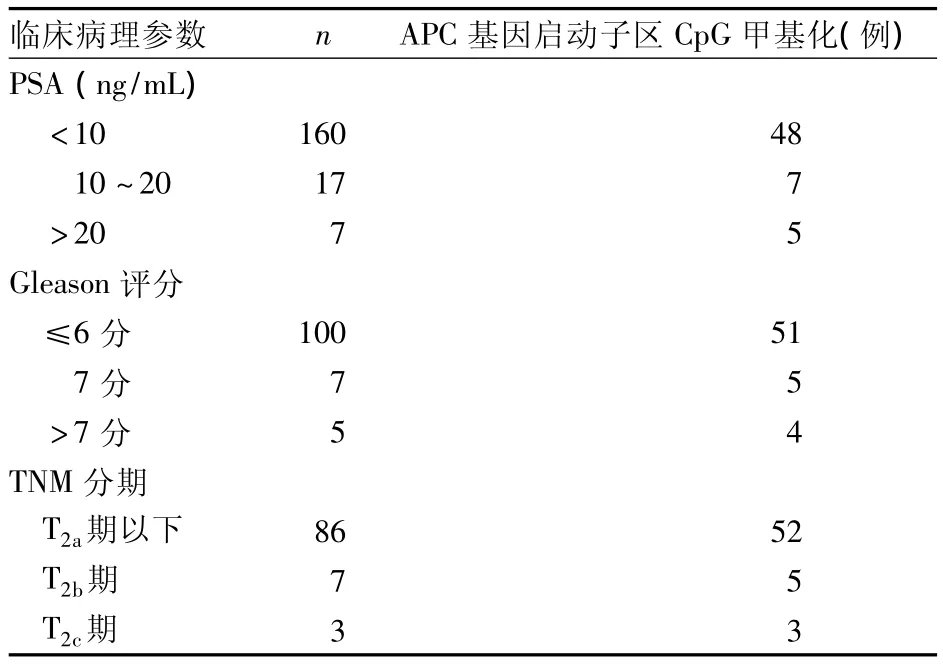
表1 PCa組APC基因啟動子區CpG甲基化與臨床病理參數的關系
根據2000年國際肥胖特別工作組提出的亞洲成人體質量分級標準,BMI 18.5~22.9為正常,23~24.9為超重,>25為肥胖;男性腰圍>90 cm,女性腰圍>80 cm,亦屬于中心性肥胖(腹型)。研究認為,高BMI與PCa風險增加有關[3]。由于肥胖者細胞內線粒體的脂質代謝能力下降,導致氧化損傷物質積聚,為腫瘤的發生提供了條件[4]。而本研究進行因素分析時BMI與PCa的關聯并沒有顯著意義。
生活行為方式中飲酒因素是目前的研究熱點之一。酒精可以改變體內雄激素和雌激素的平衡,從而影響激素依賴型腫瘤如PCa。有研究報道[5]飲酒量與PCa有關聯:隨著飲酒量的增加,患PCa的危險性升高。但也有研究表明飲酒與PCa發病無關聯[6]。此外酒的種類與PCa發病有無關聯也沒有明確結論。我們的調查顯示飲酒與PCa發生有顯著的關系,飲酒者患PCa的風險是不飲酒者的2.46倍。吸煙不僅是引起肺癌的直接原因之一,也使患PCa的相對危險度增加到 1.5~2.0,并有可能使PCa向惡性程度更高的類型轉化[7]。國外有研究認為,年輕時過多的吸煙將增加 PCa的患病可能性[8]。但是本研究結果顯示吸煙與PCa的關聯并沒有統計學意義。綠茶中含有茶多酚類物質,能夠引起癌細胞的死亡,從而發揮抗癌功效。Henning等[9]的研究首次在人體中證實口服茶多酚后患者前列腺組織中的多酚類物質濃度較對照組顯著增高。盡管血清中無法檢測到多酚類物質,但是用含口服茶多酚后患者血清的培養液可以在體外顯著抑制PCa細胞增殖。然而Choan等[10]在一項Ⅱ期臨床試驗中給予19例難治性PCa患者250 mg綠茶提取物2次/d口服,療程至少持續2個月,然后復查PSA或進行影像學檢查,結果顯示綠茶提取物并無積極治療效果。2001~2002年,一項旨在調查綠茶是否與PCa有病因學關系的病例對照研究[11]在中國杭州進行,結果發現飲茶量與PCa有關,綠茶對PCa具有保護性。其原因是綠茶中含有抗氧化劑。本研究發現飲茶者患PCa的危險性是不飲茶者的0.29倍,與文獻相符。
Wnt信號傳導通路的異常激活與人類腫瘤的發生發展密切相關。APC基因是Wnt信號的下游抑制因子,APC基因的失活后則會導致β-catenin降解減少,β-catenin從胞質中轉移到細胞核中與Tcf-4相結合,活化靶基因刺激腫瘤生長[12]。研究證明在結腸癌等消化道腫瘤中APC基因啟動子甲基化率很高[13],而在PCa中APC基因甲基化狀況國內外相關報道較少。
亞硫酸鹽修飾后測序法是目前公認的研究基因甲基化的金標準[14]。本研究采用此方法,研究結果顯示PCa組和BPH組CG位點甲基化發生率分別為48.84%、1.19%,PCa組高于BPH組。表明APC基因啟動子區CpG甲基化的發生與PCa的發生及臨床病理參數相關聯。由于樣本量較小,本研究的結果仍需擴大樣本進一步驗證,同時可以結合蛋白組學進一步探討該目的基因在PCa發生、發展中的作用。
一些研究表明,DNA甲基轉移酶能減少阻斷細胞分化或抑制腫瘤形成[15]。另外,DNA甲基轉移酶基因在體外實驗中具有抗腫瘤活性,并且能在一定程度上逆轉惡性表型[16]。
本研究發現,APC基因CpG位點甲基化率及環境因素如飲茶和飲酒在PCa的發生及發展中起著一定的作用。APC基因CpG位點甲基化率與飲茶、飲酒之間在PCa的發病中存在拮抗作用。環境危險因素與PCa的發生產生影響,有關環境因素、表觀遺傳因素與PCa發病之間的關系仍需進一步擴大樣本進行更加深入的研究,以揭示其間的關系。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]Lichtenstein P,Holm NV,Verkasalo PK,et al.Environmental and heritable factors in the causation of cancer:analysis of cohorts of twins from Sweden,Denmark,and Finland[J].N Engl J Med,2000,343(2),78-85.
[3]劉國良,羅幫堯,周北凡,等.肥胖癥[J].中國實用內科雜志,2003,23(9):513-515.
[4]Fradet V,Chang I,Casey G,et al.Dietary omega-3 fatty acids,cyclcoxygenase-2 genetic variation,and aggressive prostate cancer risk[J].Clin Cancer Res,2009,15(7):2559-2566.
[5]Putnam SD,Cerhan JR,Parker AS,et al.Life style and anthropometric risk factors for prostate cancer in a cohon of lowa men[J].Ann Epidemiol,2000,10(6):361-369.
[6]Albensen K,Gronbak M.Does amount or type of alcohol influence the risk of prostate cancer[J].The Prostate,2002,52(4):297-304.
[7]Rooney C,Beral V,Maconochie N,et al.Case-control study of prostatic cancer in employees of the united kindom atomic energy authority[J].BMJ,1993,307(6916):1391-1397.
[8]Hsing AW,Mclaughlin JK,Hrubec Z,et al.Tobacco use and prostate and prostate cancer:26-year follow-up of US veterans[J].Am J Epidemiol,1991,133(5):437-441.
[9]Henning SM,Aronson W,Niu Y,et al.Tee polyphenols and theaflavins are present in prostate tissue of humans and mice after green and black tea consumption[J].J Nutr,2006,136(7): 1839-1843.
[10]Choan E,Segal R,Jonker D,et al.A prospective clinical trial of green tea for hormone refractory prostate cancer:an evaluation of the complementary/alternative therapy approach[J].Urol Oncol,2005,23(2):108-113.
[11]Jian L,Xie LP,Lee AH,et al.Protective effect of green tea against prostate cancer:a case control study in southeast China[J].Int J Cancer,2004,108(1):130-135.
[12]Kastritis E,Murray S,Kyriakou F,et al.Somatic mutations of adenomatous polyposis coli gene and nuclear β-catenin accumulation have prognostic significance in invasive urothelial carcinomas:evidence for Wnt pathway implication[J].Int J Cancer,2009,124 (1):103-108.
[13]Lacopetta B,Grieu F,Li W,et al.APC gene methylation is inversely correlated with features of the CpG island methylator phenotype in colorectal cancer[J].Int J Cancer,2006,119(10):2272-2278.
[14]Rouprêt M,Hupertan V,Yates DR,et al.Molecular detection of localized prostate cancer using quantitative methylation-specific PCR on urinary cells obtained following prostate massage[J].Clin Cancer Res,2007,13(6):1720-1725.
[15]Laird PW,Jackson-Grusby L,Fazeli A,et al.Suppression of intestinal neoplasia by DNA hypomethylation[J].Cell,1995,81 (2):197-205.
[16]MacLeod AR,Szyf M.Expression of antisense to DNA methyltransferase mRNA induce DNA demethylation and inhibits tumorigenesis[J].J Biol Chem,1995,270(14):8037-8043.

