自生固氮菌的篩選及其在滅菌土壤中的生長特性
黃慧岳,謝達平
(湖南農業大學生物科學與技術學院,湖南 長沙 410128)
氮是農作物生長所必須的營養元素[1]。在農業生產中,氮被視為衡量土壤養分狀況乃至土壤肥力的一個重要指標[2]。作物每年都要從土壤中帶走大量的氮素,為補充土壤氮素的損失,工業化學氮肥至今仍然是人類向土壤補給氮素的重要來源。而工業氮肥的使用造成了土壤酸化和環境污染等一系列問題,阻礙了農業的可持續發展[3-5]。利用固氮微生物和聯合固氮微生物等生物固氮來提高土壤無機氮含量是土壤氮肥補充的有效途徑[6]。利用固氮微生物提高農作物產量的研究國內報道較多,其中有選用內生固氮菌的,也有選用自生固氮或聯合固氮微生物的。筆者擬從土壤分離出的自生固氮菌為試驗材料,測定其固氮能力和對水稻苗生長的影響,并選擇固氮力較強的菌株,施用于土壤,檢測其在土壤中的變化趨勢和對土壤氮含量的影響,以期尋找到有應用價值的固氮微生物。
1 材料與方法
1.1 材料
1.1.1 供試菌株 試驗菌株為自生固氮菌,分離出該菌株的4份土壤來自湖南農業大學,采集地點分別為藝苑、實驗基地、二食碗池周邊、八教垃圾收集處周邊。
1.1.2 培養基 Ashby無氮培養基:甘露醇1%,KH2PO40.02%,MgSO4·7H2O 0.02%,NaCl 0.02%,CaSO4·2H2O 0.01%,CaCO30.5%。固體培養基另加瓊脂8%。
1.1.3 儀 器 恒溫搖床、超凈工作臺、試管、培養皿、移液管、燒杯、恒溫培養箱、三角瓶、量筒、蒸汽電熱滅菌鍋、吸管、電子天平、pH計、紫外分光光度計、涂布棒、酒精燈、移液槍、凱氏定氮儀等。
1.2 方法
1.2.1 自生固氮菌的初篩及形態觀察 從湖南農業大學4個不同區域采取土壤樣品,制備土壤菌懸液并取上清液在試管中作梯度稀釋。選取菌懸液0.1 mL涂布于Ashby無氮培養基上,28℃恒溫培養4 d,統計固氮菌的菌落數量。選取長勢良好的菌株,用接種環挑取不同種類的單菌落,接種到新鮮的無氮培養基上,連續劃線純化3次,篩選的優勢菌株用30%甘油-70℃保存備用。
用接種環挑取菌落,制備鏡檢標本,革蘭氏染色,觀察其菌體形態特征[7-9]。
1.2.2 高效固氮菌株的篩選及對水稻苗生長的影響 (1)菌株固氮能力測定:菌株在無氮培養基中連續3次分離純化后,選取長勢良好的優勢菌,進行搖瓶培養,菌液含菌量為2×106cfu/mL,每個菌株重復培養3瓶。以10%接種量于250 mL搖瓶中培養,培養液總體積50 mL,30℃培養7 d后,用比濁法(OD600值法)評估細菌數量,用微量凱氏定氮法測定最終菌液的含氮量,篩選固氮能力較強的菌株[10]。(2)菌株對水稻苗生長的影響。將篩選得到的4株固氮菌株(A1、A2、A3、A4),分別接種到 100 mL 無氮液體培養基中,28℃搖瓶培養5 d后血球計數板計數,用去離子水稀釋,獲得106cfu/mL的菌懸液。將洗凈滅菌的石英砂(粒徑為2.0 mm)等量分裝到直徑12 cm的培養皿中,分別加入以上4種稀釋到同濃度的固氮菌液20 mL,設置1個無菌對照,每個培養皿移種催芽露白的水稻種子20粒。處理和對照均重復3次。培養10 d后測量水稻苗的高度,用spss 16.0軟件進行統計分析。
1.2.3 自生固氮菌對土壤的影響 用固氮能力較強、對水稻生長起促進作用的菌株接種于土壤,對土壤中氮細菌數量及土壤含氮量進行測定。取篩選的自生固氮菌接種于100 mL無氮液體培養基,搖床培養4 d,對細菌計數并稀釋菌液使其活細菌濃度為2×106cfu/mL。取稀釋后的菌液100 mL均勻加入到已滅菌的1 kg土壤樣品中,另外取1 kg已滅菌土壤樣品作為對照樣品。將樣品置于實驗室內自然環境下40 d,每隔5 d補充噴灑適量蒸餾水,保持土壤濕度恒定。
(1)土壤中氮細菌數量的變化:在施用菌液后0、5、10、20、30、40 d,利用最大或然計數法(MPN)[11]對土壤中的細菌含量進行跟蹤測定。稱取1 g土壤樣品,用無菌水稀釋,于脫色搖床震蕩30 min,搖勻,取稀釋度10-1~10-7,分別進行平板活菌計數。取滅菌氮細菌固體培養基,并用不同稀釋度稀釋菌液各0.1 mL進行Ashby無氮培養基平板涂布,30℃培養5 d后進行平板菌落計數。從最大或然數表中查出最大或然數近似值,按下列公式計算樣品中的微生物數量:
土壤固氮菌數量(cfu/g)=MD/W
式中M為最大或然數近似值;D為全部出現菌落的最高稀釋倍數;W為土壤質量(g)。
(2)土壤中總氮含量的測定:凱氏定氮儀檢測法[12]測定土壤中總氮含量,分析施用固氮菌后對土壤中氮含量的影響。
2 結果與分析
2.1 自生固氮菌的初篩及形態觀察
利用無氮培養基平板,從供試的4種土壤中分離出了具潛在固氮能力、菌落形態不同的菌株23個。通過純化培養、革蘭氏染色觀察后,從4個土壤樣品分離的菌株各挑取1個典型菌株進行研究,分別命名為 A1、A2、A3、A4。如表 1 所示,A1、A2 和A4菌株為革蘭氏陽性菌,有芽孢產生,其菌落呈圓形,表面較干燥。A3為革蘭氏陰性菌,無芽孢產生,菌落形態不規則。
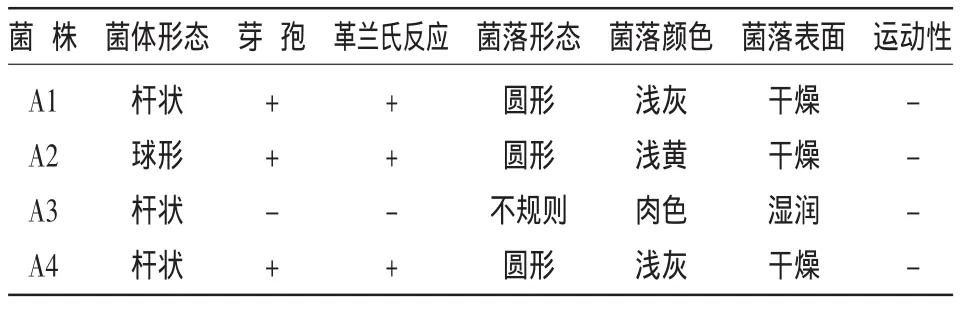
表1 固氮細菌的菌體形態和菌落特征
2.2 高效固氮菌株的篩選及對水稻苗的影響
2.2.1 固氮能力檢測 4株固氮菌搖瓶培養后,其生長數量、菌體和介質的總氮含量見表2。由于 試驗采用的是無氮培養基,因此氮含量可用于評估菌株的自生固氮能力。如表2所示,菌株A1、A2、A3、A4都有一定的固氮能力。總體來看,A1、A2的數量較大,其固氮能力也較強;而A3的數量一般,固氮能力最弱;A4生長最緩慢,其固氮能力一般。
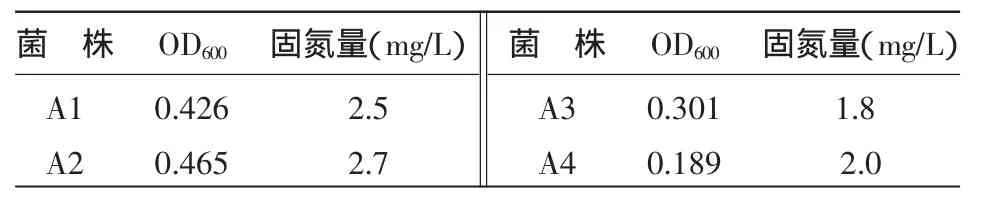
表2 菌株固氮能力檢測
2.2.2 對水稻苗生長的影響 固氮菌接種發芽水稻10 d后檢測生長相關的指標,結果如表3所示,A1對水稻的促進作用一般;A2和A3對水稻苗生長促進作用較為明顯,與對照有顯著性差異;A4與水稻苗共培養后,水稻長勢不好,甚至對水稻產生致病癥狀。研究結果表明,菌株A2的固氮作用較強、增殖能力較好,對水稻有明顯的促進生長作用。因此,選用菌株A2進行土壤中的生長特性研究。

表3 4株不同固氮菌對水稻生長的影響
2.3 固氮菌在滅菌土壤中的生長特性
2.3.1 滅菌土壤中氮細菌數量的變化 對接種A2固氮菌的土壤用MPN法測定菌數,通過查詢最大或然數表計算得出土壤總固氮菌數。接種培養0、5、10、20、30、40 d 后,土壤中固氮菌含量分別為1.9×105、4.0×105、5.0×106、2.2×107、9×106、5×106cfu/g。土壤固氮菌數量變化趨勢如圖1所示,固氮菌含量在第20天達到峰值,為2.2×107cfu/g,曲線呈現指數型增長,直至第30天細菌開始衰亡。
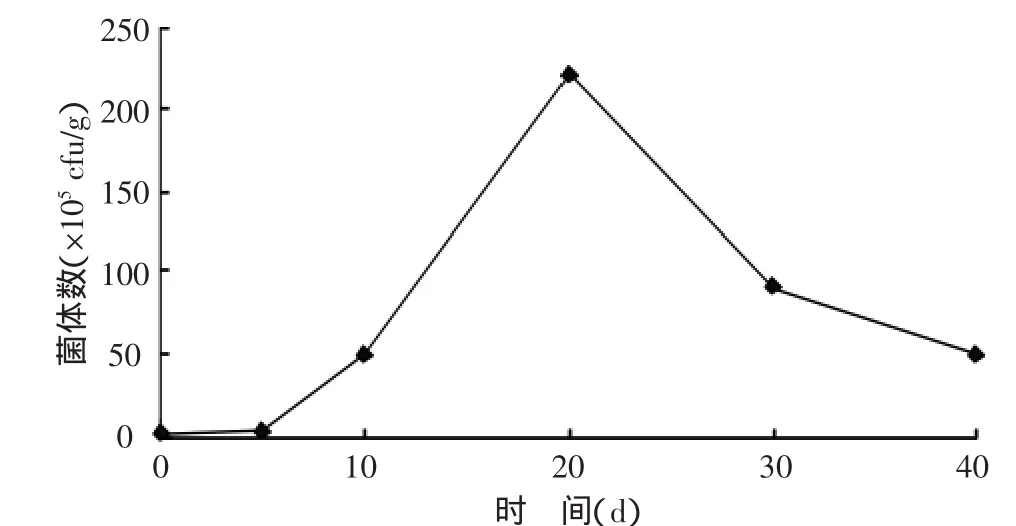
圖1 滅菌土壤固氮菌數量變化趨勢
2.3.2 滅菌土壤中總氮含量的變化 接種菌株A2培養 0、5、10、20、30、40 d 后,土壤氮含量分別為0.007%、0.014%、0.063%、0.280%、0.245%、0.252%。如圖2所示,從施用固氮菌開始,前20 d土壤中氮含量隨著固氮菌數量的增加而持續增加,與菌體數量基本呈現正相關關系,且于培育的第20天土壤中總氮含量達到峰值0.280%。根據全國第二次土壤普查土壤養分分級表,該值已達到一級土壤全氮含量標準指標(數據)以上。30 d后土壤全氮含量并不與微生物數量呈對應相關關系,隨著固氮菌開始出現衰亡,前階段所固定氮素并沒有隨著細菌的死亡而消失,而是持續保留于土壤中。
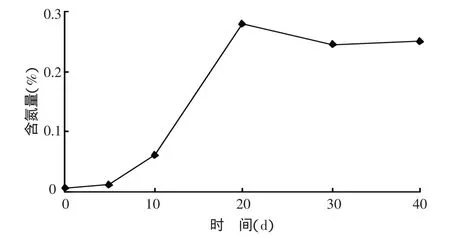
圖2 滅菌土壤氮含量變化趨勢
3 小結
滅菌土壤中施用自生固氮菌后,培養約20 d固氮菌數量達到最大,為2.2×107cfu/g,固氮菌數量增加約100倍。土壤中全氮含量高于國家土壤養分分級表全氮含量的一級標準。自生固氮菌作為活性微生物,在不同環境下其生物學特征、固氮能力、增殖能力等都有可能發生變化[13],這將有待于進一步的研究。
[1]張世清,李慶洋,高建明,等.24株劍麻根際聯合固氮菌的16S rDNA 序列分析[J].江西農業學報,2011,23(11):132-134.
[2]Ye J Q,Yuan R X,Yu H Y,et al.Dynamic changes of nitrogen in salinealkaline paddy field and its potential environmental impacts[J].Agricultural Science&Technology,2011,12(3):443-450,460.
[3]IFA.Sustainable Management of the Nitrogen Cyclein Agriculture and Mitigation of Reaetive Nitrogen Side Effects.Firsted[M].Paris:International Fertilizer Industry Assoeiation,2007.
[4]席寅峰,張孟婧,黃小帥,等.1株光合細菌的分離鑒定及其脫氮能力研究 [J]. 安徽農業科學,2010,38 (27):14847-14849,14875.
[5]Xu F X,Xiong H,Zhang L,et al.Variation of nitrogen uptake and utilization efficiency of mid-season hybrid rice at different ecological sites under different nitrogen application levels[J].Agricultural Science&Technology,2011,12(7):1001-1009,1012.
[6]Jaeoud C,Job D,Wadoux P ,et al.Initiation of root growth stimulation by Azospzillum lipoferum CRTI during maize seed germination[J].Mierobiology,1999,45:339-342.
[7]沈 萍,范秀容,李廣武.微生物學實驗[M].北京:高等教育出版社,2000.
[8]郭立忠,畢建水,祝王業,等.微生物菌肥中三類菌株的分離、純化與部分性質鑒定[J].萊陽農學院學報,2002,(4):248-250.
[9]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001.
[10]鮑士旦.土壤農化分析[M].北京:中國農業出版社,2000.
[11]楊從發,王淑軍,陳 靜,等.自生固氮菌的分離鑒定[J].淮海工學院學報,1998,8(3):56-58.
[12]胡江春,薛德林,馬成新,等.植物根際促生菌(PGPR)的研究與應用全景[J].應用生態學報,2004,15(10):1963-1966.
[13]張崇邦,金則心,施時迪.浙江天臺山幾種林型下土壤細菌生理群生態分布的特性[J].植物生態學報,2002,26(3):269-274.

