胰島β細胞功能紊亂與2型糖尿病以及中藥的干預
王克柱,劉保林
中國藥科大學 中藥藥理教研室,南京 211198
糖尿病(diabetes mellitus,DM)是一組由遺傳和環境因素共同作用而引起的臨床代謝綜合征[1]。胰島β細胞功能紊亂和胰島素抵抗是2型糖尿病的兩個發病機制。早期胰島β細胞通過胰島素高分泌來代償這種胰島素抵抗狀態,來維持正常血糖水平,但是,到達某一個點以后,不能夠分泌足量的胰島素時,此時就會發生糖尿病[2]。本文主要對胰島β細胞功能紊亂發生機制及相關藥物改善胰島β細胞功能的作用作一綜述。
1 2型糖尿病患者胰島β細胞分泌胰島素特點
正常人的胰島素分泌呈現雙相性。餐后血糖的迅速升高可引起胰島素的快速釋放,3至5 min達到高峰,之后迅速下降,此過程持續10 min左右,稱之為“第一相胰島素分泌”,之后胰島素分泌緩慢增加,并持續數個小時,直至血糖水平恢復正常,稱之為“第二相胰島素分泌”[3]。葡萄糖誘導的胰島素第一時相分泌受損是胰島β細胞功能障礙的最早標志之一,在2型糖尿病早期階段,第一時相胰島素分泌減少或者消失,常低于50 mU·L-1,由于第一時相異常導致血糖升高,使第二時相胰島素分泌量增加,且分泌峰值時間向后推移。隨著患者胰島功能的衰竭,第二時相可無峰值出現,最后基礎分泌也逐漸消失[4]。
2 糖尿病發展過程中,胰島β細胞功能紊亂的五個時相
Weir[5]等認為糖尿病發展過程中存在5個時相,每個時相都存在胰島β細胞體積、表型和功能的變化。第一時相(代償期):胰島素分泌增多補償胰島素抵抗,以維持機體血糖平衡。此時相胰島β細胞復制及胰島新生與胰島細胞凋亡尚保持一定的平衡,胰島體積有所增大,仍然保持了葡萄糖介導的急性胰島素分泌的胰島β細胞分化功能。第二時相(穩定適應期):在血糖濃度維持在5.0~6.5mmol·L-1時,糖刺激所致的胰島素分泌尚維持正常,但口服糖負荷所引起的胰島素第一時相分泌能力顯著下降而出現糖耐量異常,而第二時相的胰島素分泌上維持正常。此時相胰島β細胞數量及功能雖基本穩定,但胰島細胞表征缺失和分化停止,伴有促凋亡的基因表達增加。第三時相 (早期不穩定失代償期):當血糖水平繼續快速升高到7.3 mmol·L-1時,就進入了短暫的早期不穩定失代償期。此時胰島增生與胰島素抵抗關系出現失代償,不再相適應,胰島體積減小和胰島素分泌下降,病人可出現多尿和體重下降等癥狀。第四時相(穩定失代償期):此期仍有部分胰島β細胞分泌足量的胰島素,防止酮酸癥的發生。大部分的2型糖尿病患者此時相會持續一生。研究表明,2型糖尿病患者此時相中胰島β細胞數量可以減少到50%,胰島β細胞去分化嚴重。第五時相(嚴重失代償期):胰島形態結構發生改變,胰島纖維化,β細胞數量損失嚴重,不能分泌足量的胰島素,從而產生酮酸癥和嚴重高血糖(見圖1)。

圖1 糖尿病發生發展的五個階段示意圖
3 胰島β細胞產生功能紊亂的原因
3.1 糖毒性
糖毒性在2型糖尿病發展過程中起著非常重要的作用。當血糖持續升高,超過16.6 mmol·L-1時,胰島素的分泌量不但不隨血糖的升高而增加,反而會使β細胞分泌胰島素的能力顯著降低而發生持續高血糖現象,這就是所謂的“高血糖毒性作用”。這種高血糖毒性作用可以嚴重損傷胰島β細胞功能,胰島功能損害開始表現在有更多的未成熟的胰島素原進入血液循環,使成熟的胰島素數量減少,高血糖使胰島素的質量下降,胰島素的降血糖作用減弱,從而使血糖迅速升高,加重持續高血糖現象,進而胰島素分泌量減少和高血糖走向惡性循環[6]。高血糖主要是通過氧化應激反應損傷胰島β細胞,使胰島細胞分泌胰島素異常。其可能的機制是:體內過度升高的血糖經過胰島β細胞代謝后,產生大量的活性氧自由基(ROS),與機體肝臟等其他組織細胞相比,胰島β細胞內超氧化物歧化酶等抗氧化酶水平低[7],導致ROS在體內蓄積。蓄積的ROS可以通過直接抑制胰島素基因的轉錄、表達,也可以抑制胰腺-十二指腸同源盒-1(PDX-1)mRNA的表達、MafA蛋白的表達以及促進凋亡,共同抑制胰島素的分泌,導致胰島β細胞功能損傷,進而導致糖尿病的發生(見圖2)。
3.2 脂毒性
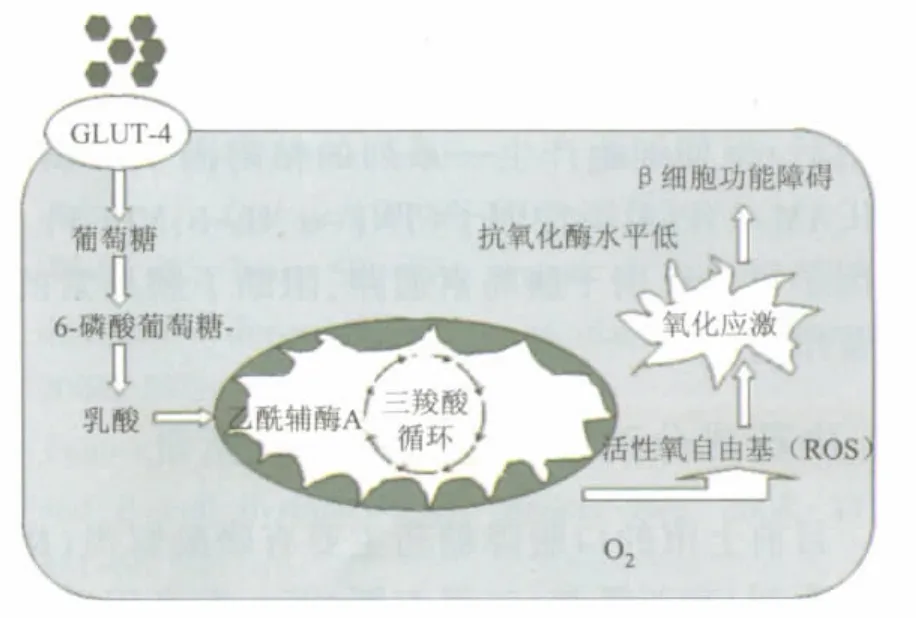
圖2 氧化應激與胰島β細胞功能紊亂的關系體內過高的葡萄糖經三羧酸循環產生過多的活性氧(ROS)。胰島β細胞內抗氧化酶水平低,導致ROS在體內蓄積。蓄積的ROS直接損壞胰島β細胞。
臨床上不難發現,2型糖尿病病人在高血糖的同時,往往伴有一系列脂質代謝異常,以循環游離脂肪酸(FFA)和甘油三酯水平升高為主[8],還會伴有不同組織脂肪異位沉積[9]。故有學者提出了“脂毒性”學說:即高水平的FFA短期內可以刺激胰島素分泌,長期則再酯化異位沉積于非脂肪器官,致使周圍組織對胰島素的敏感性降低,并使胰島細胞功能受損,最終導致T2DM的發生。細胞實驗證實:胰島細胞在高FFA環境中培養超過24~48 h(小時),葡萄糖刺激的胰島素分泌(GSIS)功能不同程度地受到抑制[10-13]。說明高FFA長期刺激胰島細胞則導致胰島β細胞功能異常。目前認為FFA升高損傷胰島β細胞功能的機制有以下幾個方面:(1)FFA影響胰島素原基因的轉錄、活化、表達[14];(2)FFA使β細胞線粒體氧化磷酸化解耦連[15],抑制胰島素的分泌;(3)促進胰島β細胞凋亡[16]等。
3.3 糖基化終末產物(AGEs)
高級糖基化終末產物(AGEs)是指在無酶催化條件下,葡萄糖分子游離醛或酮基與蛋白質氨基通過親核加成反應形成糖基化蛋白。近年大量研究證明,在高血糖狀態下蛋白質發生的非酶糖基化在糖尿病慢性并發癥的發病中起著重要作用。AGEs毒性主要途徑是:AGEs與AGEs受體(RAGE)結合,激活一系列胞內信號通路,促使細胞產生血管細胞黏附分子(VCAM-1)[17]、內皮細胞粘附分子(ICAM-1)和一些炎性因子如白介素-1(IL-1)、白介素-6(IL-6)、腫瘤壞死因子(TNF-α)、血管內皮生長因子(VEGF)[18]。炎性因子可以作用于胰島素通路,阻斷了胰島素的分泌及作用(見圖3)。
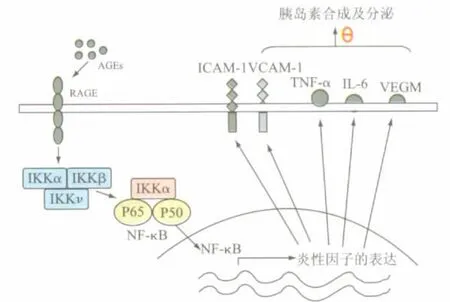
圖3 高級糖基化終末產物(AGEs)誘導胰島β細胞功能紊亂的原理圖
AGEs與AGEs受體(RAGE)結合,激活一系列胞內信號通路,包括核轉錄因子(NF-κB)。NF-κB激活后,促使細胞產生一系列的粘附因子(VCAM-1,ICAM-1)以及炎性因子(TNF-α,IL-6,VEGF)。炎性因子可以作用于胰島素通路,阻斷了胰島素的分泌及作用。
4 中藥成分改善胰島細胞功能紊亂
目前上市的口服降糖藥主要有磺酰脲類(格列苯脲系列)和雙胍類(二甲雙胍)等。前者因通過刺激胰島β細胞分泌胰島素而表現出較強的降糖作用,一直作為一線藥而應用。國外多項基于長期臨床觀察的調查表明,長期服用格列苯脲系列藥物控制血糖并不能有效阻止糖尿病的發展和心血管并發癥的發生,糖尿病的致殘率和致死率并無顯著下降,而胰島功能紊亂持續性發展或缺失是其重要原因。有報道,臨床2型糖尿病人的胰島體積只有正常人的50%[19]。在胰島結構和功能已顯著受損的情況下,繼續給予磺酰脲類藥物刺激胰島素分泌,無疑是加重胰島的負擔,使其長期超負荷運轉,最終導致胰島功能的不可逆型缺失。二甲雙胍降糖作用雖然較弱,因其通過改善胰島素抵抗,增加組織對糖的攝取利用而表現出胰島素增敏作用,有效減輕了胰島的負擔,表現出改善胰島功能的有效作用。臨床調查已證明,長期服用二甲雙胍可有效降低2型糖尿病的發展和減少心血管損害并發癥的發生,并可有效降低死亡率。所以二甲雙胍在沉寂十多年后,又重返口服降糖一線藥[20]。
目前上市的治療2型糖尿病的中藥新藥制劑達30余種,只注重考慮刺激胰島細胞,促進胰島素的分泌;在藥效評估中偏重單純的降糖作用,而對糾正胰島功能紊亂和改善胰島素抵抗認識不足。因此針對改善胰島功能紊亂設計的中藥新藥尚未問世,但學者們也在這方面做了一些中藥成分的研究。
陳培[21]研究發現,銀杏葉提取物(extract Gingko biloba,EGb)表現出對胰島β細胞的保護作用。銀杏葉提取物的主要成分是以黃酮苷形式存在。此類化合物中含有不飽和基團,易受氧化攻擊,分子進入細胞后,參與了氧化還原反應,消耗了活性氧自由基等,從而表現出強大的抗氧化、清除自由基、抑制脂質過氧化等作用能力[22]。銀杏葉提取物可以通過降低胰島β細胞內的氧化性的物質的含量,部分逆轉環境變化導致的氧化應激,改善胰島β細胞功能結構和胰島素分泌功能。大鼠2型糖尿病模型中,此類化合物表現出促進胰島β細胞分化增殖、促進細胞活化等作用,其可能的機制是:降低體內ROS的蓄積,促進PDX-1 mRNA的表達、MafA蛋白的表達以及抑制β細胞的凋亡。
山藥多糖(yam polysaccharide)是從山藥塊莖中分離提取的活性成分,實驗證明,山藥多糖對于糖尿病動物具有明顯的降糖作用,其降糖機理可能是通過保護糖尿病大鼠的胰島細胞來實現的[23-24]。楊宏莉[25]采取體外培養大鼠胰島細胞發現,胰島細胞在高糖刺激下,山藥多糖可以顯著的提高胰島素的釋放量,對胰島細胞增殖有明顯的促進作用,保護其活性,其機制與凋亡抑制基因(bcl-2)表達增強有關。Bcl-2的表達增強抑制了胰島細胞的凋亡,這提示山藥多糖對糖尿病病變導致的胰島細胞損傷修復可能發揮一定的作用。
劉曉萍[26]探討了石參水提物對高脂飲食誘導的2型糖尿病小鼠模型的影響。結果顯示,石參水煎液能明顯降低2型糖尿病小鼠的空腹血糖,顯著改善受損的葡萄糖耐量,促進胰島素的分泌,降低血清甘油三酯和游離脂肪酸水平,對胰島β細胞具有一定的保護作用。鏈脲佐菌素(STZ)誘導糖尿病的作用機制是通過誘導產生大量的ROS,破壞胰島細胞,導致胰島細胞壞死和胰島素分泌減少而誘發糖尿病[27]。Lin等人[28]發現,石參水提物中含有黃酮類、皂苷和還原性多糖,而大部分的黃酮類衍生物都表現有強烈的抗氧化活性。Yen等[29]研究表明,石參甲醇提取物在體外能顯著降低ROS活性,顯示出良好的抗自由基活性,進而推測石參醇提物保護胰島細胞功能,促進胰島素分泌的功能很有可能由其抗自由基活性所介導。同時石參醇提物可以降低血清甘油三酯和游離脂肪酸水平,表明石參可以改善糖尿病小鼠脂質代謝紊亂的作用。胰島素抵抗與游離脂肪酸循環有密切的關系,游離脂肪酸的升高會導致骨骼肌胰島素抵抗和肝臟的胰島素抵抗。此外,氧化應激也可以導致胰島素抵抗。故而推測石參醇提物通過降低循環中的游離脂肪酸或減輕氧化應激水平,進而改善糖尿病小鼠胰島素抵抗。
大量研究表明,植物中的黃酮化合物,如槲皮素、蘆丁、兒茶素等B環上有鄰酚羥基的化合物具有較強的抗氧化性作用。研究表明,番石榴葉中含槲皮素或槲皮素苷元的黃酮類化合物,對糖尿病小鼠胰島組織結構及合成分泌胰島素功能具有保護作用。王波[30]在STZ制備糖尿病小鼠模型中,對胰腺組織免疫組化和HE染色發現,糖尿病小鼠胰島組織結構發生病理性的改變,如胰島中出現淀粉樣沉淀,胰島和胰島β細胞的數目、密度、體積減少,胰島素表達減少,胰島β細胞變性,β細胞凋亡增加。胰島損傷的結果造成了胰島β細胞功能障礙,胰島素合成和分泌減少,導致糖尿病進一步惡化。在給予番石榴葉提取物后,發現糖尿病胰島病理改變減輕,主要表現為胰島的數目和體積增加,內分泌細胞變性程度減輕,抑制糖尿病的繼續惡化。其可能的原因與其抗氧化作用抑制自由基生成,或清除過量的氧自由基有關。
檳榔堿是從中藥檳榔果中提取的生物堿。元竹青[31]在研究高果糖誘導的大鼠2型糖尿病模型基礎上,采用檳榔堿干預模型大鼠,從胰腺組織形態觀察,TUNEL凋亡檢測都可以發現5 mg·kg-1檳榔堿有較好的胰腺細胞保護作用。對凋亡關鍵基因Bc1-2/Bax檢測發現,5 mg·kg-1檳榔堿能夠上調Bc1-2/ Bax比值,提示檳榔堿保護胰腺細胞可能是通過上調抑制凋亡基因,減少細胞凋亡,增加細胞數量相關。在研究胰島素分泌受損中,發現檳榔堿能有效逆轉2型糖尿病模型大鼠胰腺PDX-1基因表達,使其水平降低,同樣能增加糖尿病模型大鼠胰腺中與胰島素分泌及糖代謝密切相關的胰島素(insulin)、葡萄糖轉運蛋白2(GLUT2)、葡萄糖激酶(GK)的基因表達,有效地增強了胰島素的分泌。
5 小 結
胰島β細胞功能的正常對維持血糖平穩有相當重要的作用,尤其是胰島β細胞的“第一相胰島素分泌”對控制餐后血糖起到關鍵性作用。當β細胞功能受損時,胰島素分泌障礙,控制血糖水平降低,反之,當血糖持續升高時,高血糖會反過來進一步損傷胰島β細胞,加重了胰島β細胞的負擔,導致病情惡化。從胰島β細胞功能代償期發展到糖尿病期,經歷了五個時期,需要較長的時間。前三期通過藥物干預可以保護及改善胰島β細胞功能,從而延緩糖尿病病程,減少并發癥的發生,提高患者的生活質量。
[1] Steppan CM,Bailey ST,Bhat S,et al.The hormone resistin links obesity to diabetes[J].Nature,2001,409 (18):307-12.
[2] McGarry JD.What if Minkowski had been ageusic?An alternative angle on diabetes[J].Science,1992,258 (5083):766-70.
[3] Del Prato S,Marchetti P.Targeting insulin resistance and beta-cell dysfunction:the role of thiazolidinediones[J].Diabetes Technol Ther,2004,6(5):719-31.
[4] Boden G,Chen X,Polansky M.Disruption of circadian insulin secretion is associated with reduced glucose uptake in first-degree relatives of patients with type 2 diabetes[J].Diabetes,1999,48(11):2182-8.
[5] Weir GC,Weir SB.Five stages of evolving β-cell dysfunction during progression to diabetes[J].Diabetes, 2004,53(3):S16-21.
[6] Poitout V,Robertson R.Glucolipotoxicity:fuel excess and β-cell dysfunction[J].Endocr Rev,2008,29(3): 351-66.
[7] Danial NN.BCL-2 family proteins:critical checkpoints of apoptotic cell death[J].Clin Canc R,2007,13(24): 7254-63.
[8] Reaven GM.The fourth musketeer-from Alexandre Dumas to Claude Bernard[J].Diabetolog,1995,38(1):3-13.
[9] Schalch DS,Kipnis DM.Abnormalities in carbohydrate tolerance associated with elevated palsma nonesterified fatty acids[J].J Clin Inv,1965,44(12):2010-20.
[10] Yoshikawa H,Tajiri Y,Sako Y,et al.Effect of free acids on β-cell function:a possible involvement of peroxisome proliferator activated receptors or pancreatic duodenal homeobox[J].Metabolism,2001,50(5): 613-8.
[11] Yun-Ping Zhou,Valdemar EG.Long-term exposure of rat pancreatic islets to fatty acids inhibits glucose induced insulin secretion and biosynthesisthrough a glucose fatty acid Cycle[J].J Clin Inv,1994,93(2): 870-6.
[12] Kawai T,Hirose H,Seto Y,et al.Chronic effects of different fatty acids and leptin in INS-1 cells[J].Diabet Re C,2001,51(1):1-8.
[13]Lupi R,DeI Guerra S,Marselli L,et al.Rosiglitazone prevents the impairment of human islet function induced by fatty acids:evidence for a role of PPAR in the modulation of insulin secretion[J].Am J Physiol Endocrinol Metab,2004,286(18):E560-7.
[14] Hagman D K,Latour M G,Chakrabarti S K,et al. Cyclical and alternating in fusions of glucose and in tralipid in rats inhibit insulin gene expression and Pdx1 binding in islets[J].Diabetes,2008,57(2):424-31.
[15] Medvedev AV,Robidoux J,Bai X,et al.Regulation of the uncoupling protein-2 gene in INS-1 beta-cells by oleic acid[J].J Biol Chem,2002,277(45):42639-44.
[16] Rachek LI,Thornley NP,Grishko VI,et al.Protection of INS-1 cell from free fatty acid induced apoptosis by targeting hOGG1 to mitochondria [J].Diabetes,2006,55(4):1022-8.
[17] Boulanger E,Wautier MP,Wautier JL,et al.AGEs bind tomesothelial cellsvia RAGE and stimulate VCAM-1 expression[J].Kidney Int,2002,61(10): 148-56.
[18] Schmidt AM,Yan SD,Yan SF,et al.The multiligand receptor RAGE as a progession factor amplifying immune and inflammatory responses[J].J Clin Inv,2001, 108(7):949-55.
[19] Butler,AE,Janson J,Bonner-Weir S,et al.β-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes[J].Diabetes,2003,52(1):102-10. [20] Anfossi G,Russo I,Bonomo K,et al.The cardiovascular effects of metformin:further reasons to consider an old drug as a cornerstone in the therapy of type 2 diabetes mellitus[J].Curr Vasc Pharmacol,2010,8(3): 327-37.
[21] 陳 培,楊旭芳,王 莞.銀杏葉提取物對實驗性2型糖尿病大鼠胰腺的保護作用 [J].牡丹江醫學院學報,2008,29(6):16-8.
[22] La Casa C,Villegas I,Alarcon de la Lastra C,et al. Evidence for protective and antioxidant properties of rutin,a natural flavones,against ethanol induced gastric lesions[J].J Ethnophar,2000,71(122):45-53.
[23] 張忠泉,陳百泉,許啟泰.山藥多糖對大鼠血糖及胰島釋放影響的研究 [J].上海中醫藥雜志,2003,37(10):52-3.
[24] 何 云,戚玉敏,劉景升,等.山藥多糖對糖尿病大鼠胰島素及血小板數的影響[J].河北北方學院學報(醫學版),2009,26(1):29-31.
[25] 楊宏莉,張宏馨,李蘭會,等.山藥多糖對體外培養大鼠胰島細胞活性及胰島素分泌的影響 [J].河北大學學報(自然科學版),2010,30(4):408-12.
[26] 劉曉萍.石參提取物抗糖尿病作用的研究 [D].廣州:南方醫科大學,2010,5,8.
[27] Lenzen S.The mechanisms of alloxan-and streptozotocin-induced diabetes[J].Diabetolog,2008,51(2): 216-26.
[28] Lin MZ.Pharmacognostic identification of Uraria crinita [J].Subtropical Plant Science,2008,37(2):50-2.
[29] Yen GC,Lai HH,Chou HY.Nitric oxide-scavenging and antioxidant effects of Uraria crinita root[J].Food Chem,2001,74(4):471-8.
[30] 王 波.番石榴葉輔助降血糖作用及其機制研究[D].成都:四川大學,2007,5,10.
[31] 元竹青.檳榔堿對2型糖尿病大鼠胰腺細胞的保護作用及其機制[D].衡陽:南華大學,2010,5,01.